内质网应激激活剂通过上调GRP78增加肺癌A549细胞对顺铂的敏感性
石少敏 赵建军 赵凤芹 王 静
(吉林大学中日联谊医院呼吸内科,吉林 长春 130033)
内质网应激激活剂通过上调GRP78增加肺癌A549细胞对顺铂的敏感性
石少敏赵建军赵凤芹王静
(吉林大学中日联谊医院呼吸内科,吉林长春130033)
目的探讨内质网应激激活剂(TM)增加肺癌A549细胞对顺铂(DDP)敏感性的机制。方法DDP和TM处理肺癌A549细胞,MTT法检测肺癌A549细胞存活率,流式细胞术检测细胞凋亡水平,Western印迹检测凋亡相关蛋白Cleaved Caspase-7表达。结果不同浓度的DDP(0,10,20,50 μmol/L)作用于肺癌A549细胞24 h,细胞存活率以剂量依赖的方式下降;TM诱导内质网应激后,提高了DDP(20 μmol/L)诱导的细胞凋亡率(55.23%±2.31%,P<0.05);同时检测到凋亡相关蛋白Caspase-7表达增加。结论DDP能够诱导肺癌A549细胞凋亡,但是TM通过上调GRP78增加了肺癌A549细胞对DDP敏感性,联合应用TM和DDP有望成为治疗肺癌的新策略。
内质网应激;顺铂;凋亡;肺癌
顺铂(DDP)通过损伤细胞的DNA而发挥抗肿瘤作用〔1〕,可用于治疗卵巢癌、头颈部的肿瘤和肺癌等〔2〕,其治疗肿瘤的主要障碍是药物耐受〔3〕。新近报道,线粒体通路和内质网应激参与了DDP诱导的癌症细胞的凋亡〔4〕。同时,有研究显示,在人黑色素瘤和结肠癌细胞中,DDP通过影响内质网中的钙稳态而诱导内质网应激,进而导致癌症细胞凋亡〔5〕。当缺氧、DNA损伤、细胞内的钙紊乱时,诱导癌症细胞发生内质网应激。葡萄糖相关蛋白(GRP78)是细胞的内质网蛋白,当内质网应激发生时表达上调,并进一步活化内质网上横跨膜蛋白质传感器ATF6、IRE1、PERK〔6〕。有研究报道,在肺癌A549细胞中,GRP78上调能够增强肿瘤细胞对DDP的敏感性〔7〕。本研究旨在观察DDP作用于肺癌A549细胞前后细胞凋亡的变化,以及联合内质网应激激活剂TM对细胞凋亡产生的影响,并初步探讨其相关机制。
1 材料与方法
1.1细胞培养将人肺癌A549细胞用含10%胎牛血清、双抗(100 U/ml青霉素及0.1 mg/ml链霉素)的RPMI-1640培养液(Gibco公司),在37℃、5%CO2、饱和湿度的细胞培养箱中培养。
1.2实验方法
1.2.1MTT法检测细胞活力取生长状态良好的对数生长期肺癌细胞接种至96孔板,待细胞完全贴壁,加入既定浓度的DDP和(或)TM,每孔200 μl的终体积液体,每组设6个复孔,药物干预作用24 h后,每孔加入20 μl噻唑蓝(MTT)溶液(5 g/L),将细胞在培养箱继续培养4~6 h。弃去培养基,加入150 μl二甲基亚砜(DMSO)于每孔内,振荡摇匀后,用酶标仪于490 nm波长测定各孔的吸光度值,计算细胞的生存率。
1.2.2流式细胞仪技术检测细胞凋亡率 取生长状态良好的肺癌A549细胞,将细胞接种于6孔板,培养24 h后,换液并按既定浓度的DDP和(或)TM处理细胞,药物干预24 h后收集悬浮,并用胰酶消化贴壁细胞,加入400 μl结合缓冲液使细胞重悬,之后加入AnnexinV和PI溶液,于室温条件下避光孵育15 min;通过流式细胞仪检测细胞凋亡率,每组实验重复3次。
1.2.3Western印迹检测凋亡相关蛋白表达取生长状态良好的肺癌A549细胞,接种于细胞培养瓶,细胞贴壁后分别加入既定浓度的DDP和(或)TM处理细胞,药物干预24 h后,收集贴壁细胞和悬浮细胞,提取细胞蛋白,采用二喹啉甲酸(BCA)方法将蛋白进行定量。并使用十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)胶(200 V,45 min)进行电泳,之后用100 V转膜1 h,将蛋白转移至聚偏氟乙烯(PVDF)膜上,同时含15%脱脂牛奶的磷酸盐缓冲液(PBS)封闭2 h,用PBS洗涤3次,之后加入相应一抗,经4℃孵育过夜后,用PBS洗涤3次15 min、5 min、5 min后,加入辣根过氧化酶标记的二抗孵育2 h(Caspase-7抗体稀释比例1∶100、β-actin抗体稀释比例1∶1 000、二抗稀释比例1∶1 000),之后再用PBS洗涤3次,使用增强化学发光法(ECL)进行显影,之后再用凝胶成像系统分析条带的灰度值。
1.3统计学方法采用SPSS13.0软件行t检验。
2 结 果
2.1不同浓度的DDP对肺癌A549细胞活力及凋亡的影响0,10,20,50 μmol/L的DDP干预24 h后,MTT结果显示,随着药物浓度的增加,其对A549细胞生长抑制作用逐渐增加,细胞存活率分别为(1±0.066)、(0.74±0.11)、(0.52±0.054)、(0.32±0.021);并且随着药物浓度的逐渐增加,A549细胞逐渐皱缩,而且脱离贴壁的现象明显增加。10,20,50 μmol/L的DDP作用A549细胞24 h后,流式细胞术检测A549细胞凋亡分别为(2.14±0.68)%,(8.67±0.69)%,(13.16±1.11)%,(19.22±1.65)%。
2.2DDP诱导的肺癌A549细胞凋亡相关蛋白的表达水平0,10,20,50 μmol/L的DDP作用A549细胞24 h后,凋亡相关蛋白Cleaved Caspase-7的表达水平随着药物浓度增加而上调,分别为0.04±0.023,0.73±0.28,1.33±0.079,1.67±0.121,尤其DDP浓度在20,50 μmol/L时,与对照组相比,Cleaved Caspase-7的表达水平增加更明显。见图1。
2.3TM对内质网应激相关蛋白GRP78表达水平的影响0,1,2,4 μg/ml TM作用A549细胞24 h后,内质网应激相关蛋白GRP78的表达水平逐渐增加,分别为0.23±0.058、0.49±0.11、0.62±0.062、0.79±0.077,与对照组相比差异显著(P<0.05)。见图2。
2.4TM联合DDP对肺癌A549细胞存活率的影响1 μg/ml TM联合20 μmol/L DDP处理A549细胞24 h后,与对照组(1±0.18)相比,单加1 μg/ml TM组细胞生存率(0.95±0.075)无明显差异。DDP组(0.55±0.068)和二者联合组(0.24±0.03)的细胞存活率均明显降低,尤其二者联合组的细胞生存率明显低于单加DDP组(P<0.05),提示TM促进了顺铂对A549细胞生存率的影响。
2.5TM促进DDP诱导肺癌A549细胞凋亡TM联合DDP处理肺癌A549细胞24 h后,流式结果显示,与对照组〔(2.6±0.062)%〕相比,单加1 μg/ml TM组肺癌A549细胞凋亡率〔(3.3±0.17)%〕无明显差异(P>0.05);而20 μmol/L DDP组〔(10.21±0.32)%〕和二者联合组〔(18.69±1.12)%〕的细胞凋亡率均明显增加,尤其在二者联合组细胞凋亡率增加更明显(P<0.05),提示TM促进了DDP诱导的肺癌A549细胞凋亡率的增加。
2.6TM影响DDP诱导的肺癌A549细胞凋亡相关蛋白的表达TM联合DDP处理肺癌A549细胞24 h后,与对照组(0.03±0.02)相比,单加TM细胞凋亡相关蛋白Caspase-7的表达(0.043±0.031)无明显的变化(P>0.05);与单加DDP组(0.32±0.06)比较,二者联合组Caspase-7表达(0.71±0.054)明显升高(P<0.05),见图3。
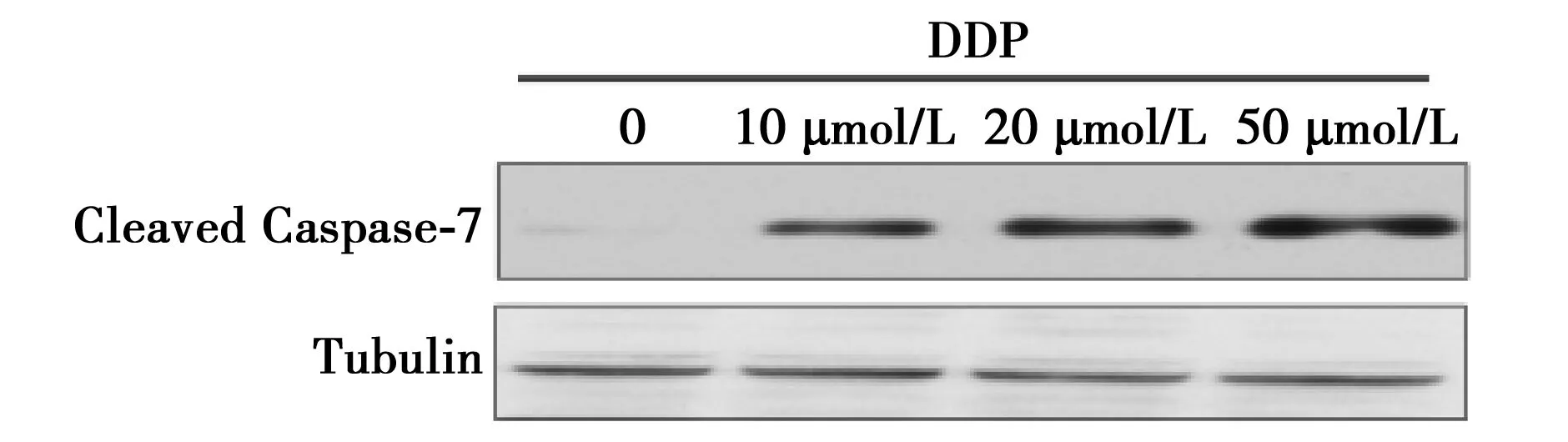
图1 DDP诱导的肺癌细胞凋亡相关蛋白的表达水平
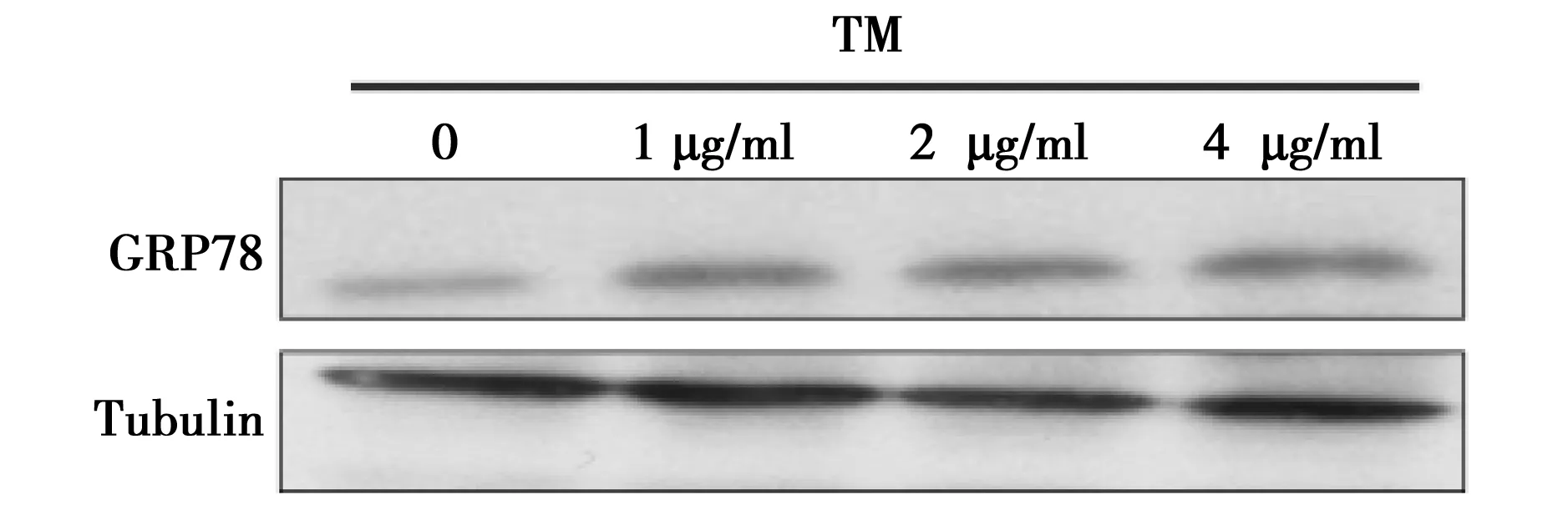
图2 TM对肺癌细胞内质网应激相关蛋白的表达水平
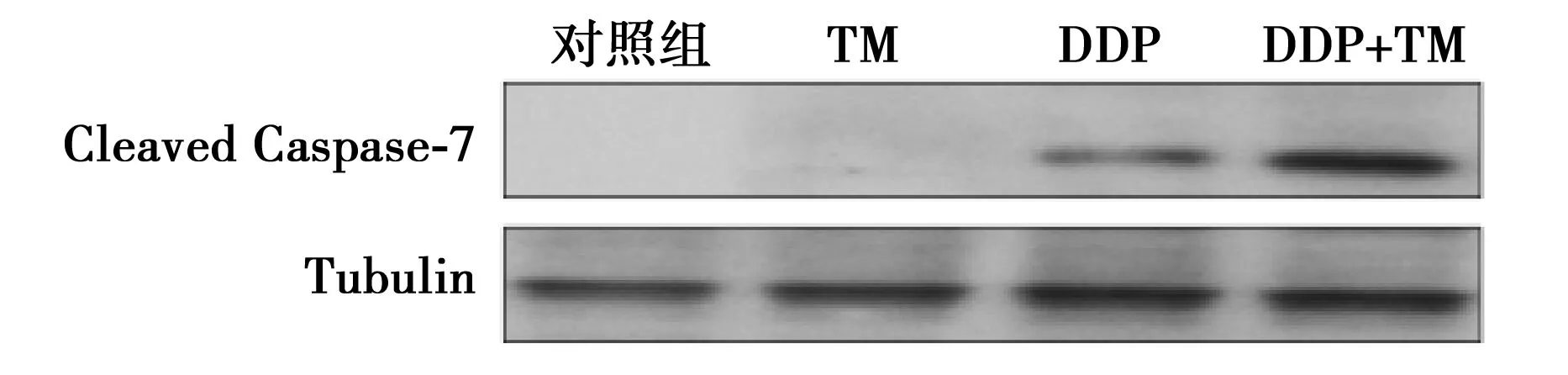
图3 联合应用对A549细胞凋亡相关蛋白表达水平的影响
3 讨 论
目前研究发现内质网应激在化疗药物诱导的肺癌凋亡中起到了重要的作用〔8〕。在以前的研究中,内质网应激被认为是一种生物学的级联反应,能够有效诱导细胞凋亡;事实上,内质网应激是对许多刺激因素如生物化学、病理及生理条件下的刺激产生的一种细胞反应,能够促发各种细胞功能紊乱包括错误折叠蛋白质的聚集和Ca2+稳态的改变〔9〕。并且在过度的内质网应激和凋亡性的细胞死亡之间的关系已经在巨噬细胞、神经细胞和内皮细胞,以及癌症细胞都已得到了证实〔10〕。在本研究中,也发现TM增强了肺癌细胞对DDP的敏感性。GRPs是内质网分子伴侣,普遍存在内质网中,能够辅助蛋白质的折叠〔11〕。GRP78(也被成为Bip)是典型的GRPs家族成员,是和细胞质中的热休克蛋白(HSP)70和90同源,并且一般被大家认为是内质网应激的分子标志〔12〕。在内质网应激发生时,GRP78表达水平明显上调。在本研究中也显示,在肺癌A549细胞中,TM能够剂量依赖性上调GRP78的表达,并且,当TM和DDP联合应用时,能够有效抑制肺癌A549细胞的生存率,同时明显增加肺癌A549细胞的凋亡率及凋亡相关蛋白Caspase-7的表达。
1Holford J,Beale PJ,Boxall FE,etal.Mechanisms of drug resistance to the platinum complex ZD0473 in ovarian cancer cell lines〔J〕.Eur J Cancer,2000;36(15):1984-90.
2Zhao J,Kim JE,Reed E,etal.Molecular mechanism of antitumor activity of taxanes in lung cancer(Review)〔J〕.Int J Oncol,2005;27(1):247-56.
3Perego P,Gatti L,Righetti SC,etal.Development of resistance to a trinuclear platinum complex in ovarian carcinoma cells〔J〕.Int J Cancer,2003;105(5):617-24.
4Di Sano F,Ferraro E,Tufi R,etal.Endoplasmic reticulum stress induces apoptosis by an apoptosome-dependent but caspase 12-independent mechanism〔J〕.J Biol Chem,2006;281(5):2693-700.
5Mandic A,Hansson J,Linder S,etal.Cisplatin induces endoplasmic reticulum stress and nucleus-independent apoptotic signaling〔J〕.J Biol Chem,2003;278(11):9100-6.
6Schroder M,Kaufman RJ.The mammalian unfolded protein response〔J〕.Annu Rev Biochem,2005;74(7):739-89.
7Ahmad M,Hahn IF,Chatterjee S.GRP78 up-regulation leads to hypersensitization to cisplatin in A549 lung cancer cells〔J〕.Anticancer Res,2014;34(7):3493-500.
8Zhao Y,Zhu C,Li X,etal.Asterosaponin 1 induces endoplasmic reticulum stress-associated apoptosis in A549 human lung cancer cells〔J〕.Oncol Rep,2011;26(4):919-24.
9Madeo F,Kroemer G.Intricate links between ER stress and apoptosis〔J〕.Mol Cell,2009;33(6):669-70.
10Tan Y,Dourdin N,Wu C,etal.Ubiquitous calpains promote caspase-12 and JNK activation during endoplasmic reticulum stress-induced apoptosis〔J〕.J Biol Chem,2006;281(23):16016-24.
11Gething MJ,Sambrook J.Protein folding in the cell〔J〕.Nature,1992;355(6355):33-45.
12Lee AS.The glucose-regulated proteins:stress induction and clinical applications〔J〕.Trends Biochem Sci,2001;26(8):504-10.
〔2015-12-11修回〕
(编辑袁左鸣)
王静(1976-),女,副主任医师,主要从事慢性阻塞性肺疾病研究。
石少敏(1981-),女,主治医师,主要从事肺癌诊治的基础研究。
R453
A
1005-9202(2016)16-3925-02;doi:10.3969/j.issn.1005-9202.2016.16.025
——疾病防治的新靶标

