老年性痴呆患者颞叶皮层差异基因的生物信息学分析
虞雪云 牛吉攀 张占军 王 磊 白卫国 卫东锋
(中国中医科学院中医临床基础医学研究所,北京 100700)
·心、脑血管及代谢性疾病·
老年性痴呆患者颞叶皮层差异基因的生物信息学分析
虞雪云牛吉攀1张占军2王磊3白卫国卫东锋
(中国中医科学院中医临床基础医学研究所,北京100700)
目的探讨老年性痴呆患者颞叶皮层的生物学网络调控机制及关键节点在痴呆早期的病机机制。方法从基因芯片公共数据库GEO中下载老年性痴呆患者颞叶皮层的基因芯片数据,采用在线分析软件STRING和PANTHER对表达明显差异的基因进行生物信息学调控网络分析,寻找关键节点基因。结果在40个差异表达基因编码的蛋白中,有19个蛋白与其他蛋白存在相互作用关系,TBP、AKT1、CS、HSPB1及PARD6A蛋白为调控网络的关键节点蛋白。差异明显的基因主要涉及分子结合、催化活性及转录调节活性功能,与阿尔茨海默病(AD)-早老素信号通路、γ-氨基丁酸合成通路、AD-淀粉样蛋白分泌酶通路有关,参与了颞叶皮层的细胞间通讯、糖脂代谢、细胞转运等生理学过程。结论AD颞叶皮层的发病与TBP、AKT1、CS、HSPB1及PARD6A等基因密切相关,主要涉及AD-早老素信号通路、γ-氨基丁酸合成通路和AD-淀粉样蛋白分泌酶通路,有利于针对性的采用具有调节相应网络功能的药物进行早期干预,保护AD患者的认知功能。
老年性痴呆;颞叶皮层;差异表达基因;生物信息学;蛋白降解
颞叶皮层是一个较为敏感的脑区,在老年性痴呆(即阿尔茨海默病,AD)早期受病程的影响会发生改变,分子机制较为复杂〔1,2〕。迄今为止,基因组学方法为AD的机制研究提供了大量的临床数据,采用生物信息学分析方法对这些临床检测数据进行进一步分析,探讨AD在早期的病机特征,可为AD的早期诊断、治疗及实验研究提供理论依据〔3〕。本研究利用来自基因芯片公共数据库(GEO)一组AD患者颞叶皮层(布洛德曼21区和22区)组织具有明显差异的基因数据进行生物信息学分析,深入探讨早期AD患者颞叶皮层的分子网络改变情况。
1 材料与方法
1.1差异明显的基因表达数据在GEO数据库搜索框中以“Temporal cortex of Alzheimer′s disease”为检索词,获得Tan MG和Lai MK提交的GSE37263基因芯片数据。GSE37263采用的是商业化的Affymetrix 人类外显子1.0 ST芯片平台GPL5175,基因数据分别来自25个AD患者和16个非AD正常对照的颞叶皮层组织,其中两组间前20个表达明显上调和下调的差异基因见表1。
1.2差异表达基因的蛋白-蛋白相互作用图谱分析将差异明显的39个基因相应的蛋白名称上传至STRING9.05蛋白-蛋白相互作用关系在线分析软件(http://www.string-db.org),通过调节可信度和附加节点参数,获得差异表达基因的蛋白-蛋白相互作用图,筛选出中心节点蛋白。
1.3差异表达基因的生物学特征分析分别将前20个表达上调和下调的明显差异基因ID号上传至PANTHER 8.1在线分类系统(http://www.pantherdb.org),通过调节数据类型及分析类型参数,分别获得上调和下调差异基因的分子功能、表达蛋白分类、生物学过程及信号转导通路分析结果。

表1 前20个表达上调和下调的差异基因
2 结 果
2.1差异表达基因的蛋白-蛋白相互作用结果STRING9.05蛋白相互作用在线分析软件分析结果表明,共有19个蛋白与其他蛋白存在相互作用关系,蛋白-蛋白相互作用网络见图1。拓扑网络中包含5个小的子网络,分别与基因转录、能量代谢、蛋白降解及信号转导、细胞黏附及应激反应、上皮细胞缝隙连接有关。其中,TBP、AKT1与网络中的其他≥8个蛋白存在相互作用关系,CS、HSPB1及PARD6A蛋白与网络中的其他≥3个蛋白存在相互作用关系,为5个蛋白子网络的中心节点。TP53和AKT1为总蛋白网络的核心节点,与其他大部分蛋白质均存在相互作用关系。删除这些核心节点蛋白后,网络结构涣散。蛋白-蛋白相互作用网络中预测的相关蛋白质见表2。2.2差异表达基因的分子功能分类结果通过PANTHER系统分类软件分析发现,前20个表达明显上调的差异基因共涉及8种分子功能,其中基因数≥2的分子功能包括分子结合、催化活性、酶调节活性、结构分子活性、核酸结合及转录调节活性,见表3。前20个表达明显下调的差异基因共涉及6种分子功能,其中基因数≥2的分子功能包括分子结合、催化活性及转录调节活性。见表4。

表2 蛋白-蛋白相互作用网络中预测的相关蛋白

续表2 蛋白-蛋白相互作用网络中预测的相关蛋白
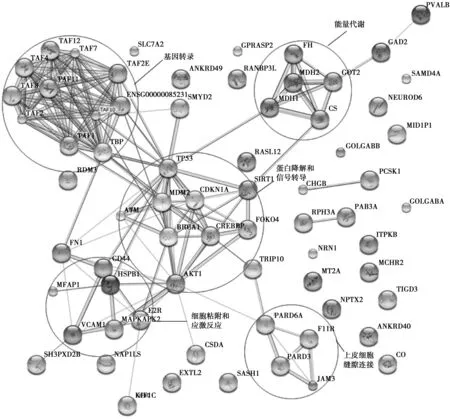
图1 差异明显基因的蛋白-蛋白相互作用网络图

序号分子功能基因数量基因简称百分比(%)AccessionID1分子结合7RASL12、ANKRD49、TRIP10、YBX3、TIGD3、FOXO4、RANBP3L3500054882催化活性2RASL12、ITPKB1000038243酶调节活性2ANKRD49、RANBP3L1000302344肌动活动1KIF1C500037745受体活性1CD44500048726结构分子活性3HSPB1、KIF1C、TRIP101500051987核酸结合2YBX3、FOXO41000305288转录调节活性2AQP1、SLC7A2100005215
2.3差异表达基因的蛋白分类结果Panther分类系统的蛋白分类结果发现,明显上调的差异基因共涉及11类蛋白,其中基因数≥2的蛋白类别包括细胞连接蛋白、细胞骨架蛋白、调节酶、核酸结合蛋白及转录因子,见表5。明显下调的差异基因共涉及13类蛋白,其中基因数≥2的蛋白类别包括裂解酶、膜转运蛋白、转录因子及转移酶,见表6。
2.4差异表达基因的生物学过程通过Panther分类系统的生物学过程分析发现,前20个表达明显上调的差异基因共涉及11个生物学过程,其中基因数≥2的生物学过程包括细胞黏附过程、细胞间通讯过程、细胞周期、细胞组分的组成过程、细胞生理过程、发育过程、免疫系统过程、代谢过程、系统过程及细胞转运过程,其所含基因数量、基因简称、百分比及ID号。见表7。前20个表达明显下调的差异基因共涉及14个生物学过程,其中基因数≥2的生物学过程包括细胞间通讯过程、细胞周期、细胞生理过程、发育过程、免疫系统过程、代谢过程及系统过程,其所含基因数量、基因简称、百分比及ID号。见表8。
2.5差异表达基因所涉及的信号转导通路分析结果生物学信号通路分析发现,差异明显的基因共涉及16条生物学信号转导通路,其中基因数≥2的信号通路为AD-早老素信号通路和γ-氨基丁酸合成通路,其他14条信号通路仅涉及1个差异基因,其通路名称、所占百分比及ID号,见表9。

表4 下调基因的分子功能分类结果

表5 上调基因所涉及的蛋白分类

表6 下调基因所涉及的蛋白分类

表7 上调基因所涉及的的生物学过程

表8 下调基因所涉及的生物学过程

表9 差异明显基因所涉及的信号转导通路
3 讨 论
已有研究表明,由β淀粉样蛋白(Aβ)聚集形成的老年斑是AD的特征性病理变化之一,而Aβ是由跨膜蛋白β淀粉样前体蛋白(APP)经β-分泌酶和γ-分泌酶分解后产生〔4,5〕。有研究认为,寡聚化的Aβ会对神经细胞产生毒性作用,其机制与氧化应激损伤、炎症反应、线粒体能量代谢障碍、突触损伤、Tau蛋白过度磷酸化引起的神经纤维缠结和细胞凋亡有关〔6〕。研究表明,由Tau蛋白异常如蛋白结构错误折叠、Tau蛋白过度磷酸化可导致神经细胞微管结构稳定性下降、神经纤维缠结、囊泡转运功能失调及轴突转运障碍,从而引起Tau蛋白介导的神经退行性疾病如AD的发生〔7〕。
本研究数据来源于人脑颞叶皮层组织,涉及的水通道蛋白1、冷休克域蛋白A、热休克27 kD蛋白、肌醇-1,4,5-三磷酸盐-3激酶B、神经突蛋白1、神经源性分化因子 6、驱动蛋白家族成员1C、苹果酸脱氢酶1、谷氨酸脱羧酶2、谷氨酸-草酰乙酸转移酶 2及神经元正五聚蛋白Ⅱ等与氧化应激、蛋白质代谢、神经传递、细胞骨架、能量代谢等相关,表明颞叶皮层的病理变化与之前的AD研究结果具有一些相似之处,但部分基因的表达变化有所不同,值得进一步深入研究。蛋白-蛋白相互作用研究结果表明,AD患者颞叶皮层的差异基因之间存在相互作用关系,以基因转录、能量代谢、蛋白降解及信号转导、细胞黏附及应激反应、上皮细胞缝隙连接方面的基因关系较为密切,其中TBP、AKT1、CS、HSPB1及PARD6A作为网络节点值得进一步深入研究,为早期AD的诊断提供了线索和依据。
中医药对老年性痴呆的防治作用是典型的复杂系统作用的结果,具有多靶点,网络综合调控的生物学特点。采用“网络对网络”的生物信息学方法研究老年性痴呆的发病机制,是适合中医药作用特点的研究新方法和新模式,才有可能真正揭示其相互作用关系及作用机制,使其“复杂而可知”。本研究生物信息学分类结果表明,AD患者颞叶皮层的差异明显基因主要涉及分子结合、催化活性及转录调节活性功能,通过调节AD-早老素信号通路、γ-氨基丁酸合成通路、AD-淀粉样蛋白分泌酶通路及三羧酸循环信号转导通路,参与了颞叶皮层的细胞间通讯、糖脂代谢、细胞转运及细胞黏附等生理学过程,为早期AD患者大脑皮层的病机研究提供了新思路和防治靶标。
1Kerrigan TL,Randall AD.A new player in the “synaptopathy” of Alzheimer′s disease-arc/arg 3.1.〔J〕.Front Neurol,2013;4(9):1-7.
2Zhou B,Liu Y,Zhang Z,etal.Impaired functional connectivity of the thalamus in Alzheimer′s disease and mild cognitive impairment:a resting-state fMRI study〔J〕.Curr Alzheimer Res,2013;10(7):754-66.
3Farrer LA.Expanding the genomic roadmap of Alzheimer′s disease〔J〕.Lancet Neurol,2015;14(8):783-5.
4Sindi S,Mangialasche F,Kivipelto M.Advances in the prevention of Alzheimer′s Disease〔J〕.F1000 Prime Rep,2015;7(1):50.
5Roberson ED,Mucke L.100 years and counting:prospects for defeating Alzheimer′s disease 〔J〕.Science,2006;314(5800):781-4.
6Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5580):353-6.
7Ballatore C,Lee VM,Trojanowski JQ.Tau-mediated neurodegeneration in Alzheimer′s disease and related disorders〔J〕.Nat Rev Neurosci,2007;8(9):663-72.
〔2016-05-06修回〕
(编辑袁左鸣)
Bioinformatic analysis of differentially expressed genes of temporal cortex in Alzheimer′s disease patients
YU Xue-Yun,NIU Ji-Pan,ZHANG Zhan-Jun,et al.
Institute of Basic Research in Clinical Medicine,China Academy of Chinese Medical Sciences,Beijing 100700,China
ObjectiveTo observe the biological network regulation mechanism and key nodes of temporal cortex to provide new thoughts for basic research and clinical treatment of Alzheimer′s disease(AD) at early stage.MethodsThe microarray genes data from temporal cortex of AD patients were downloaded from the Gene Expression Omnibus(GEO) database and analyzed by bioinformatics methods using STRING and PANTHER online analysis software.ResultsOf all the 40 differentially expressed genes,19 were found to encode proteins with interactions,in which TBP,AKT1,CS,HSPB1 and PARD6A proteins were key nodes of the protein-protein network.Bioinformaties results indicate that the differentially expressed genes had binding,catalytic activity and transcription regulator activity and were involved in AD-presenilin pathway,Gamma-aminobutyric acid synthesis pathway and AD-amyloid secretase pathway.These genes also participated in cell communication,glucose and lipid metabolism and transport process of temporal cortex.ConclusionsThe pathology of temporal cortex in AD patients might be closely related to TBP,AKT1,CS,HSPB1 and PARD6A genes and are mainly involve in AD-presenilin pathway,Gamma-aminobutyric acid synthesis pathway and AD-amyloid secretase pathway.It contributes to the prevention and treatment of AD using drug based on gene regulatory network.
Alzheimer′s disease;Temporal cortex;Differentially expressed genes;Bioinformaties;Protein degradation
国家自然科学基金资助项目(81274001);国家科技重大专项-重大新药创制(2013ZX09103002-002,2013ZX09301307)
卫东锋(1982-),男,助理研究员,博士,主要从事中医药防治老年性痴呆研究。
虞雪云(1984-),女,助理研究员,主要从事医学生物信息学研究。
R741
A
1005-9202(2016)16-3927-06;doi:10.3969/j.issn.1005-9202.2016.16.026
1河南省省直第二医院肿瘤科
2北京师范大学认知神经科学与学习国家重点实验室
3南方医科大学中医药学院

