局部晚期乳腺癌新辅助化疗病理完全缓解与预后相关性的Meta分析
乔伟强 潘淋淋 寇长贵 文庆一 赵亚宁 李 珂 杨 明
(吉林大学第一医院乳腺外科,吉林 长春 130021)
局部晚期乳腺癌新辅助化疗病理完全缓解与预后相关性的Meta分析
乔伟强潘淋淋寇长贵1文庆一赵亚宁李珂杨明
(吉林大学第一医院乳腺外科,吉林长春130021)
目的对局部晚期乳腺癌新辅助化疗病理完全缓解与预后的相关性进行综合评价。方法从Pubmed、Embase、The Cochrane Library、Web of Science和中国学术期刊全文数据库、中国生物医学文献数据库和万方数据库中检索有关局部晚期乳腺癌新辅助化疗病理完全缓解和预后的文献,用比值比(OR)评价局部晚期乳腺癌新辅助化疗病理完全缓解和预后的关系,采用固定效应模型计算合并OR值,用RevMan5.3软件进行Meta分析。结果共纳入8篇文献(英文6篇,中文2篇),局部晚期乳腺癌患者共1 376例。5年总生存率(OS)(OR=5.16,95%CI:2.98~8.94)、5年无病生存率(DFS)(OR=5.17,95%CI:3.26~8.20),差异均具有统计学意义(P均<0.01)。结论局部晚期乳腺癌新辅助化疗后获得病理完全缓解患者的5年OS和DFS均高于未获得病理完全缓解患者,提示局部晚期乳腺癌新辅助化疗获得病理完全缓解与预后呈正相关。
局部晚期乳腺癌;新辅助化疗;病理完全缓解;预后;Meta分析
乳腺癌是全世界女性最常见的癌症之一,陈万青〔1〕等统计2015年中国乳腺癌发病率约为15%,居女性肿瘤发病率第1位;死亡率约为7%,居女性肿瘤死亡率第6位,严重威胁女性健康。由于经济和健康意识等原因,在我国有相当比例的患者在就诊时就已经发展为局部晚期乳腺癌(LABC)。LABC是指病变在乳房内广泛浸润或合并有区域淋巴结转移,但临床上未发现有远处转移的乳腺癌〔2〕。LABC在发展中国家占乳腺癌的30%~60%〔3〕,其切除率低预后差,是一个非常突出的临床问题,其主要治疗方法之一就是新辅助化疗(NAC)〔4〕;新辅助化疗可以降低肿瘤分期,将不可手术的乳腺癌变成可手术的乳腺癌,提高手术切除率及保乳率同时监控治疗期间患者的反应性〔5〕。预测新辅助化疗疗效的指标对评价疗效及判断患者预后至关重要。有研究证明,病理完全缓解(pCR)是远期疗效的替代指标〔5〕。因此,本文运用循证医学的原理和方法,对国内外已发表的有关LABC患者新辅助化疗后获得pCR患者的生存和预后的相关性文章进行客观评价,以探讨新辅助化疗后获得pCR在LABC癌患者预后结果中的价值。
1 资料与方法
1.1文献检索计算机检索Pubmed、Embase、The Cochrane Library、Web of Science和中国学术期刊全文数据库、中国生物医学文献数据库和万方数据库。手工检索近5年重要国际肿瘤学会议记录,如美国临床肿瘤学会、圣安东尼奥乳腺癌会议。当同一个研究有多篇文献报道时,只评估最新、最近的文献数据。中文检索词包括局部晚期乳腺癌、新辅助化疗、病理完全缓解、预后等。英文检索词包括locally advanced breast cancer、neoadjuvant chemo therapy、pathological complete response、and prognosis等。文献检索语言为英语或中文,文献检索起止时间均为从建库至2015年12月。
1.2文献纳入标准①所有研究的患者均经过病理诊断为乳腺癌;②局部治疗前接受新辅助化疗的LABC;③文献记录获得病理完全缓解与未获得病理完全缓解患者的比例及预后关系;④生存预后研究指标包括5年总生存率和5年无病生存率。
1.3文献排除标准①术前接受放疗或内分泌治疗的LABC;②重复发表的文献;③综述、个案报道、会议报告、Meta分析等。
1.4统计学方法采用Cochrane国际协作网提供的RevMan5.3软件进行统计分析,计算总OR值和其95%可信区间(CI)。用χ2检验验证所纳入文献的异质性。若P异质性≥0.10或者I2<50%,表明各文献间具有同质性,则采用固定效应模型;若P异质性<0.10,或者I2>50%,表明各文献间有异质性,则采用随机效应模型进行Meta分析。利用RevMan5.3软件制作漏斗图,使用Stata 12.0软件进行Begg检验计算P值判断发表偏倚情况。
1.5敏感性分析应用固定效应模型或随机效应模型研究单项研究对总合并效应的影响,进行敏感性分析。
1.6文献质量评价采用纽卡斯尔-渥太华量表(NOS)进行文献质量评价,评价内容主要包括3个方面,即研究对象的选择、研究对象的可比性和暴露确定该量表满分为9分〔6〕。
2 结 果
2.1文献筛选情况及纳入研究的特征依据上述检索策略,严格按照纳入和排除标准筛选,最终有8篇文献纳入本系统评价〔7~14〕,共计1 376例LABC患者,其中英文研究6篇〔7~12〕,中文研究2篇〔13,14〕。文献筛选流程见图1,纳入研究的基本特征见表1。

表1 纳入研究的基本特征及其NOS评分
pCR:病理完全缓解;ypT0/is:乳腺原发灶(包括导管原位癌)中未检测到浸润性癌灶;ypT0/is ypN0:乳腺原发灶(包括导管原位癌)及腋下淋巴结未检测到浸润性癌灶
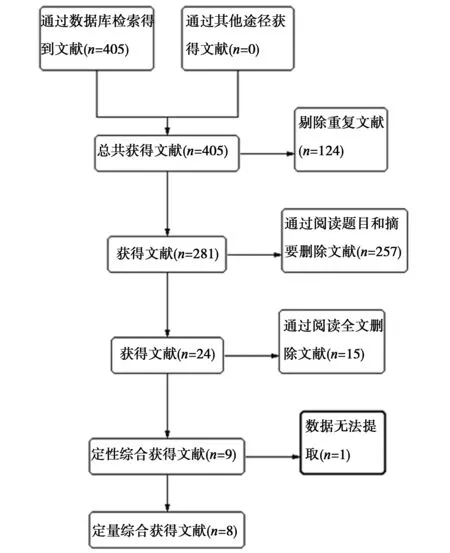
图1 文献筛选流程
2.2LABC新辅助化疗获得pCR的5年总生存情况共有8篇文献(1 376名患者)提供了5年总生存率(OS)相关数据,每篇文献及总的OR值及其95%CI见图2。异质性分析发现P=0.97,I2=0%,各研究同质采用固定效应模型进行合并分析,总OR值为5.16(95%CI:2.98~8.94),组间5年OS异具有统计学意义(Z=5.86,P<0.01)。
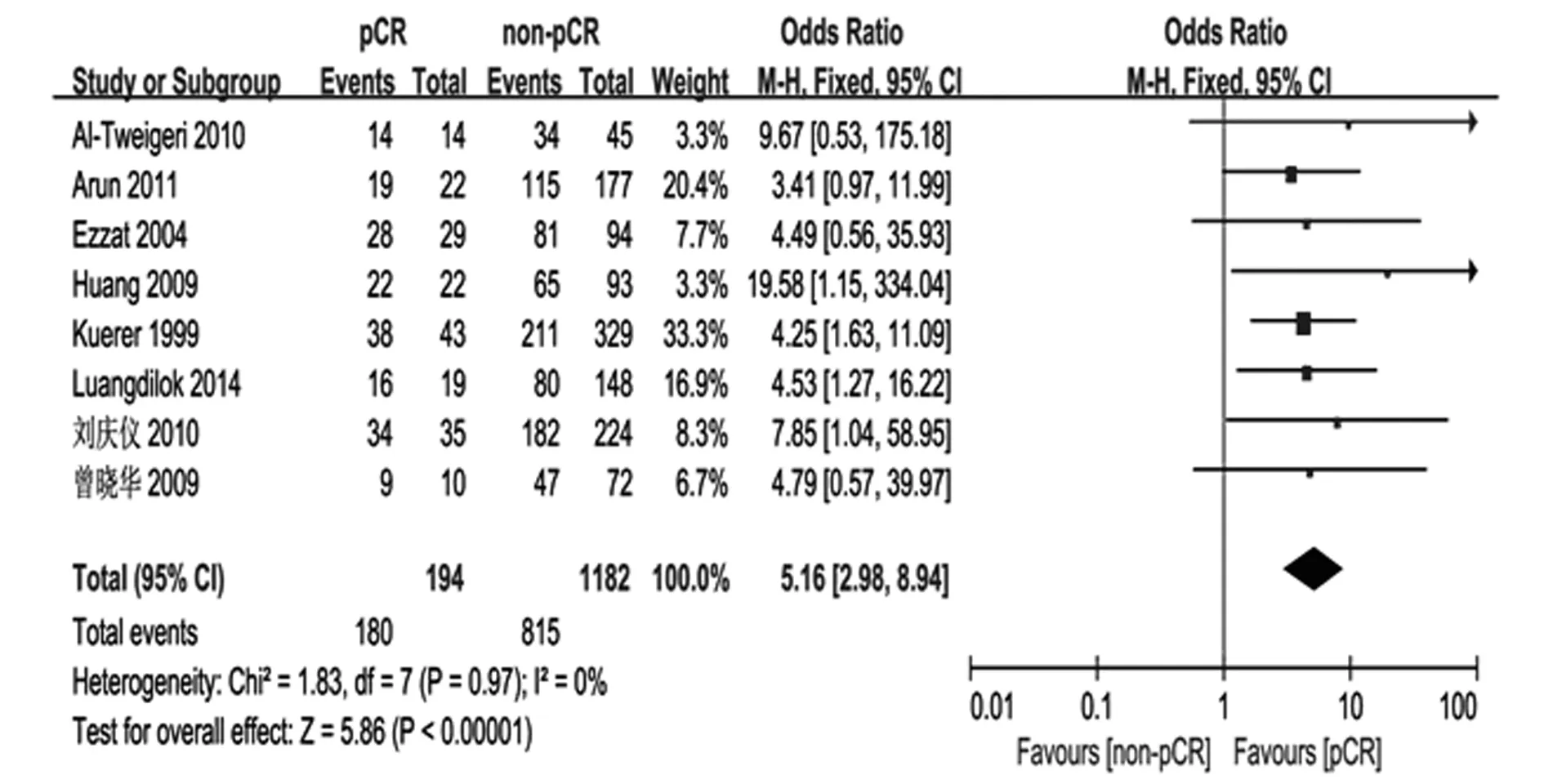
图2 局部晚期乳腺癌新辅助化疗获得pCR患者的5年总生存率
2.3局部晚期乳腺癌新辅助化疗获得pCR的5年无病生存情况共有8篇文献(1 376名患者)提供了5年无病生存率(DFS)相关数据,每篇文献及总的OR值及其95%CI见图3。异质性分析发现P=0.45,I2=0%,各研究同质采用固定效应模型进行合并分析,总OR值为5.17(95%CI:3.26~8.20),组间5年DFS率差异具有统计学意义(Z=6.98,P<0.01)。
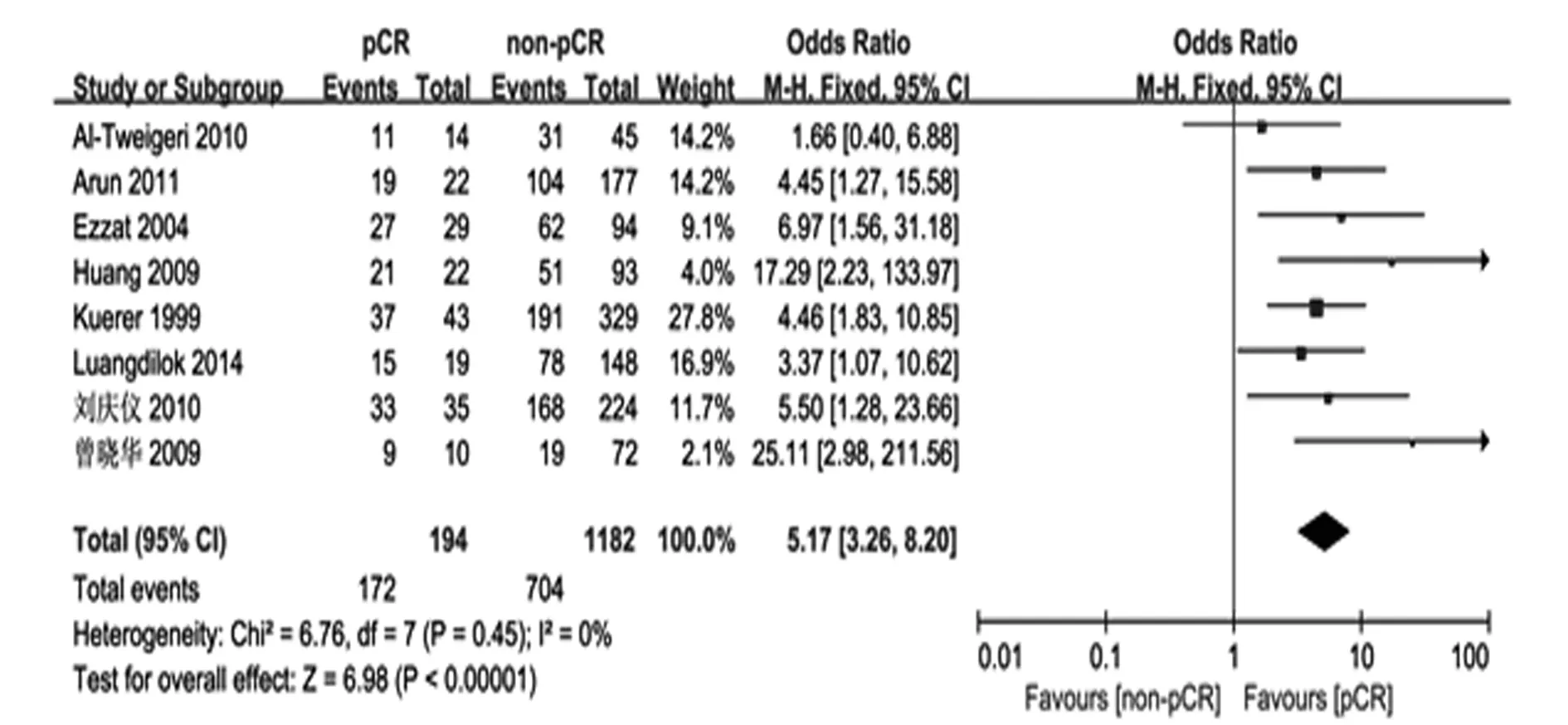
图3 局部晚期乳腺癌新辅助化疗获得pCR患者的5年无病生存率
2.4发表偏倚以LABC新辅助化疗获得pCR的5年OS的OR值作为效应量利用RevMan5.3软件制作漏斗图,Begg 检验所得P=0.026(见图4),提示存在发表偏倚。以LABC新辅助化疗获得pCR的5年DFS率的OR值作为效应量利用RevMan5.3软件制作漏斗图,Begg 检验所得P=0.113(见图5),提示不存在发表偏倚。
2.5敏感性分析应用固定效应模型时P>0.1,I2=0%,不存在异质性,敏感性低。使用Stata 12.0软件进行单项研究对总合并效应的影响的敏感性分析,LABC新辅助化疗获得pCR的5年OS率和DFS率的各项研究都在可信区间范围内并且都接近总效应量,提示敏感性低,结果较为稳健可信。见图6和图7。

图4 局部晚期乳腺癌新辅助化疗获得pCR的5年总生存率漏斗图
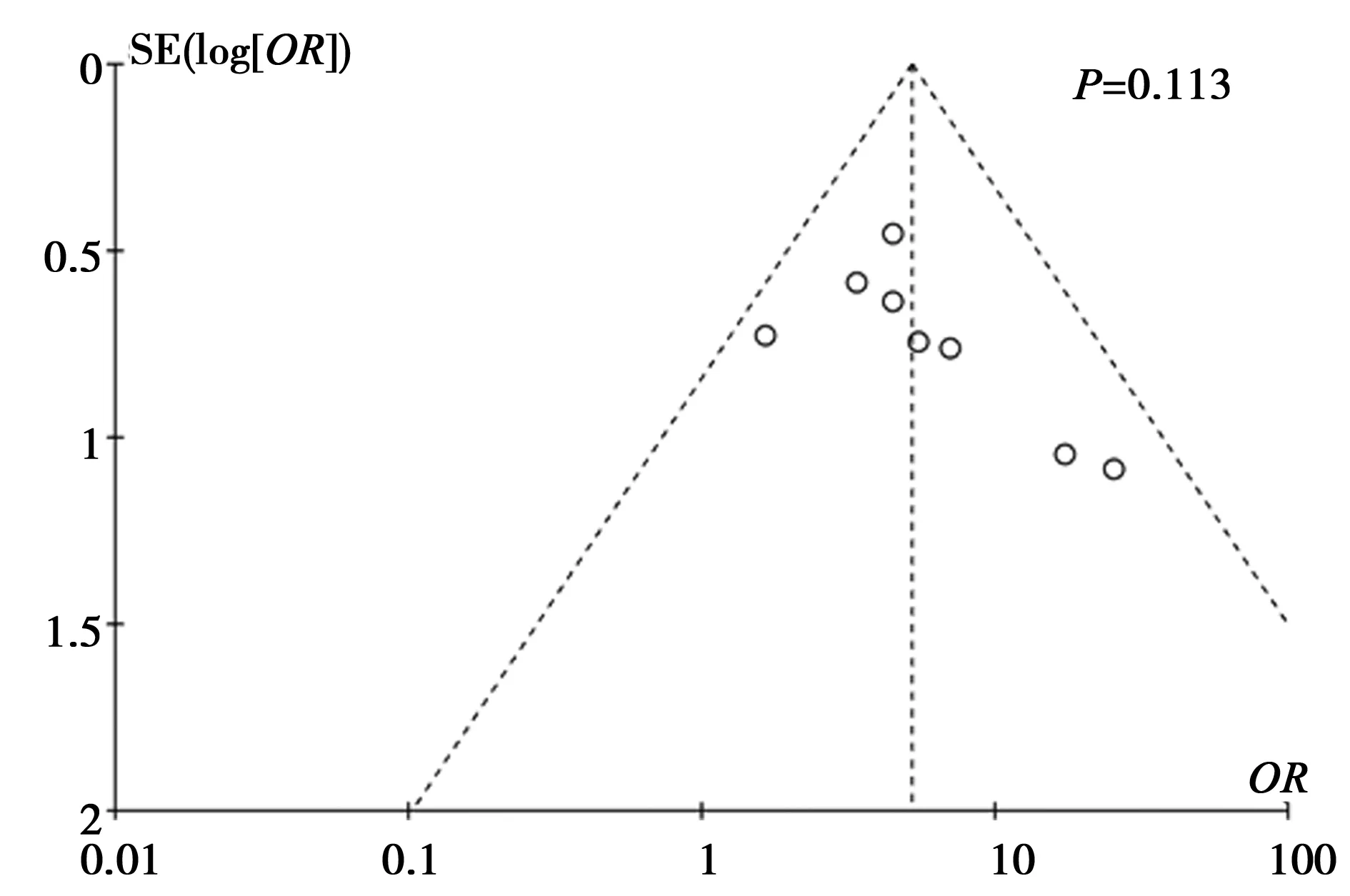
图5 局部晚期乳腺癌新辅助化疗获得pCR的5年无病生存率漏斗图

图6 局部晚期乳腺癌新辅助化疗获得pCR的5年总生存率敏感性分析

图7 局部晚期乳腺癌新辅助化疗获得pCR的5年无病生存率敏感性分析
3 讨 论
已有研究证明新辅助化疗后获得pCR是乳腺癌OS、DFS和无复发生存(RFS)的预测指标〔15〕,进一步的研究证实新辅助化疗后获得pCR是三阴性乳腺癌OS、DFS和人类表皮生长因子受体2(HER2)阳性乳腺癌OS与无事件生存(EFS)的效应指标〔16,17〕。有一些研究对局部晚期乳腺癌新辅助化疗病理完全缓解的预后进行研究报道但病例数少,尚存争议,缺乏共识与依据〔12,18〕。本研究运用Meta分析对以往的研究结果进行定量分析,评价LABC这一特殊类型新辅助化疗后获得pCR与OS和DFS的相关性,为乳腺癌的规范化和个体化治疗提供依据。
结果显示,LABC新辅助化疗后,获得pCR患者的OS率是未获得pCR患者OS率的5.16倍;获得pCR患者的DFS率是未获得pCR患者DFS率的5.17倍,获得pCR患者的OS和DFS均显著延长。OS(OR=5.16,95%CI:2.98~8.94)、DFS(OR=5.17,95%CI:3.26~8.20),差异均具有统计学意义(P均<0.01)。提示新辅助化疗获得pCR的LABC患者有更大的临床获益。此外,本研究的文献不存在异质性,提示本研究结果可信度较高。
新辅助化疗方案中的化疗周期与次数、用药顺序及药物剂量〔19~21〕,HER2阳性患者是否联合靶向药物治疗〔22〕,分子分型〔23〕都是影响pCR高低的因素,进而可能会影响乳腺癌患者的预后。本研究提示LABC的治疗应根据临床效果及时调整新辅助化疗方案,争取获得更高的pCR率,使患者获得更长的无病生存和总生存时间。
本研究的局限性:只检索了英语和汉语这两种语言的文献,这可能是产生发表偏倚的原因。本研究纳入文献的样本量较小,可能是由于近年随着医疗技术水平的发展和提高,乳腺癌的早期诊断和治疗不断完善,导致LABC患者数量下降。此外,LABC中有不同的分子分型,手术后是否联合内分泌治疗、放疗等局部治疗都可能影响患者的生存和预后。在以后的临床研究实践中还需要进行更高质量、更大样本、更多亚组分型的研究来进一步验证LABC新辅助化疗PCR与预后的关系。
1Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015〔J〕.CA Cancer J Clin,2016;66(2):115-32.
2Garg PK,Prakash G.Current definition of locally advanced breast cancer〔J〕.Curr Oncol,2015;22(5):e409-10.
3Rustogi A,Budrukkar A,Dinshaw K,etal.Management of locally advanced breast cancer:evolution and current practice〔J〕.J Cancer Res Ther,2005;1(1):21-30.
4Chia S,Swain SM,Byrd DR,etal.Locally advanced and inflammatory breast cancer〔J〕.J Clin Oncol,2008;26(5):786-90.
5Gampenrieder SP,Rinnerthaler G,Greil R.Neoadjuvant chemotherapy and targeted therapy in breast cancer:past,present,and future〔J〕.J Oncol,2013;2013:732047.
6Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses〔J〕.Eur J Epidemiol,2010;25(9):603-5.
7Al-Tweigeri TA,Ajarim DS,Alsayed AA,etal.Prospective phase Ⅱ study of neoadjuvant doxorubicin followed by cisplatin/docetaxel in locally advanced breast cancer〔J〕.Med Oncol,2010;27(3):571-7.
8Arun BK,Dhinghra K,Valero V,etal.Phase Ⅲ randomized trial of dose intensive neoadjuvant chemotherapy with or without G-CSF in locally advanced breast cancer:long-term results〔J〕.Oncologist,2011;16(11):1527-34.
9Ezzat AA,Ibrahim EM,Ajarim DS,etal.Phase Ⅱstudy of neoadjuvant paclitaxel and cisplatin for operable and locally advanced breast cancer:analysis of 126 patients〔J〕.Br J Cancer,2004;90(5):968-74.
10Huang O,Chen C,Wu J,etal.Retrospective analysis of 119 Chinese noninflammatory locally advanced breast cancer cases treated with intravenous combination of vinorelbine and epirubicin as a neoadjuvant chemotherapy:a median follow-up of 63.4 months〔J〕.BMC Cancer,2009;9:375.
11Kuerer HM,Newman LA,Smith TL,etal.Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy〔J〕.J Clin Oncol,1999;17(2):460-9.
12Luangdilok S,Samarnthai N,Korphaisarn K.Association between pathological complete response and outcome following neoadjuvant chemotherapy in locally advanced breast cancer patients〔J〕.J Breast Cancer,2014;17(4):376-85.
13刘庆仪,黄小云,李少英,等.新辅助化疗治疗局部进展期乳腺癌的临床观察〔J〕.中国癌症防治杂志,2010;37(13):85-8.
14曾晓华,刘长安,王继见,等.局部进展期乳腺癌雌、孕激素受体和HER2的表达与双周ET新辅助化疗疗效的相关性〔J〕.中国癌症杂志,2009;19(5):358-63.
15Kong X,Moran MS,Zhang N,etal.Meta-analysis confirms achieving pathological complete response after neoadjuvant chemotherapy predicts favourable prognosis for breast cancer patients〔J〕.Eur J Cancer,2011;47(14):2084-90.
16Tian M,Zhong Y,Zhou F,etal.Effect of neoadjuvant chemotherapy in patients with triple-negative breast cancer:A meta-analysis〔J〕.Oncol Lett,2015;9(6):2825-32.
17Broglio KR,Quintana M,Foster M,etal.Association of pathologic complete response to neoadjuvant therapy in HER2-positive breast cancer with long-term outcomes:a meta-analysis〔J〕.JAMA Oncol,2016;〔Epub ahead of print〕.
18Raina V,Kunjahari M,Shukla NK,etal.Outcome of combined modality treatment including neoadjuvant chemotherapy of 128 cases of locally advanced breast cancer:data from a tertiary cancer center in northern India〔J〕.Indian J Cancer,2011;48(1):80-5.
19Heys SD,Sarkar T,Hutcheon AW.Primary docetaxel chemotherapy in patients with breast cancer:impact on response and survival〔J〕.Breast Cancer Res Treat,2005;90(2):169-85.
20von Minckwitz G,Raab G,Caputo A,etal.Doxorubicin with cyclophosphamide followed by docetaxel every 21 days compared with doxorubicin and docetaxel every 14 days as preoperative treatment in operable breast cancer:the GEPARDUO study of the German Breast Group〔J〕.J Clin Oncol,2005;23(12):2676-85.
21Untch M,Mobus V,Kuhn W,etal.Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for high-risk primary breast cancer〔J〕.J Clin Oncol,2009;27(18):2938-45.
22Cortazar P,Zhang L,Untch M,etal.Pathological complete response and long-term clinical benefit in breast cancer:the CTNeoBC pooled analysis〔J〕.Lancet,2014;384(9938):164-72.
23Prat A,Fan C,Fernandez A,etal.Response and survival of breast cancer intrinsic subtypes following multi-agent neoadjuvant chemotherapy〔J〕.BMC Med,2015;13(1):303.
〔2016-04-11修回〕
(编辑徐杰)
吉林省科技厅科研基金资助课题(No.20150312033ZG)
杨明(1967-),男,教授,硕士生导师,主要从事乳腺癌的早期诊断与综合治疗研究。
乔伟强(1989-),男,在读硕士,主要从事乳腺癌的早期诊断与综合治疗研究。
R737.9
A
1005-9202(2016)16-3982-04;doi:10.3969/j.issn.1005-9202.2016.16.052
1吉林大学公共卫生学院

