双硫仑螯合铜对MCF-7和MCF-10A细胞超微结构和力学特性的影响*
杨亚萍, 张可凡, 梁志红, 杨海峰, 朱林燕
(暨南大学 1分析测试中心, 2医学院药理学教研室,广东 广州 510632; 3广东省中医院病理科,广东 广州 510120)
YANG Ya-ping1, ZHANG Ke-fan2, LIANG Zhi-hong1, YANG Hai-feng3, ZHU Lin-yan2
(1Analysis and Test Center, 2Department of Pharmacology, School of Medicine, Jinan University, Guangzhou 510632, China; 3Department of Pathology, Guangdong Provincial Hospital of Traditional Chinese Medicine, Guangzhou 510120, China. E-mail: yang_hf@126.com; linyanzhu_jnu@163.com)
·论 著·
双硫仑螯合铜对MCF-7和MCF-10A细胞超微结构和力学特性的影响*
杨亚萍1▲, 张可凡2▲, 梁志红1, 杨海峰3△, 朱林燕2△
(暨南大学1分析测试中心,2医学院药理学教研室,广东 广州 510632;3广东省中医院病理科,广东 广州 510120)
目的: 基于原子力显微镜(atomic force microscope,AFM)在纳米级分辨率和皮牛级力学测量探讨双硫仑(disulfiram,DSF)螯合氯化铜复合物(DSF/Cu)对人乳腺癌MCF-7和正常乳腺上皮MCF-10A细胞膜超微结构及力学特性的影响。方法: 采用流式细胞术比较DSF/Cu作用于2种细胞后凋亡率和细胞周期的改变。AFM探测细胞表面形貌、超微结构、细胞高度、宽度及粗糙度的变化。利用AFM纳米压痕技术检测DSF/Cu对2种细胞硬度(杨氏模量)的影响。结果: 流式细胞术结果显示:DSF/Cu可显著诱导MCF-7细胞凋亡,且呈浓度依赖性;而对MCF-10A细胞影响不大。细胞周期检测显示DSF/Cu对2种细胞的细胞周期影响不同。AFM 成像观察发现,400 和 800 nmol/L的DSF/Cu 作用于MCF-7 细胞6 h后,细胞形态明显皱缩,体积变小,表面变得平整,丝状伪足明显回缩、变短,有些变成了板状伪足,甚至完全消失。进一步定量分析发现细胞宽度变小,高度增高,均方根粗糙度和平均粗糙度均减小,且呈浓度依赖性。而对MCF-10A 细胞则影响甚微。 最后,单细胞水平生物力学检测显示:DSF/Cu作用于MCF-7和MCF-10A细胞6 h后,2种细胞的杨氏模量随药物浓度的增加均有所增加,且呈浓度依赖性,但 MCF-7细胞增加的比例要远远高于MCF-10A细胞。结论: DSF/Cu可能通过特异性影响MCF-7细胞的生物力学特性发挥高效低毒的抗乳腺肿瘤作用。
双硫仑; 原子力显微镜; 细胞凋亡; 杨氏模量
YANG Ya-ping1, ZHANG Ke-fan2, LIANG Zhi-hong1, YANG Hai-feng3, ZHU Lin-yan2
(1AnalysisandTestCenter,2DepartmentofPharmacology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;3DepartmentofPathology,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510120,China.E-mail:yang_hf@126.com;linyanzhu_jnu@163.com)
近年来,乳腺癌作为女性最常见的恶性肿瘤,全世界患者数量增长迅速,且患病年龄呈现出明显降低趋势。临床上,由于多药耐药性和毒副作用导致乳腺癌患者的治疗效果差,并易引起复发和转移[1]。双硫仑(disulfiram,DSF)又名戒酒硫,是一种能够抑制醇乙醛脱氢酶的二硫代氨基甲酸盐药物,可致酒精代谢产物乙醛在体内蓄积,使嗜酒者产生对酒精的厌恶而用于戒酒治疗[2]。近20年来,有大量研究证实,DSF与多种二价金属阳离子如铜(copper, Cu)、锌、镉等螯合后,可以显著增强其抗肿瘤活性,如抑制肿瘤血管的形成[3],抑制眼部黑色素瘤向肝的转移[4],抑制泛素-蛋白酶系统的活性等[5],且同时能够保护正常细胞[6]。此外,DSF/Cu还能明显增强癌细胞对传统化疗药物和放疗的敏感性[7]。
在细胞由正常向恶性演变的过程中,通常伴随有复杂的生物力学及细胞骨架重塑的过程,对肿瘤的侵袭和转移至关重要。癌细胞的硬度明显低于相对应的正常细胞,且侵袭能力越强的癌细胞越软,变形能力越强[8]。因此,可以根据细胞硬度(杨氏模量)的不同来辨识癌细胞和正常细胞,而且细胞的硬度及黏弹力可反映肿瘤的恶性程度。有报道,药物可以通过影响细胞生物力学特性和细胞骨架发挥抗肿瘤效应[9]。本文拟以人乳腺癌MCF-7细胞和正常乳腺上皮MCF-10A细胞为研究对象,探讨DSF/Cu对乳腺癌和正常乳腺上皮细胞的不同细胞毒作用及生物力学特性的不同影响,为DSF/Cu临床抗乳腺癌治疗提供实验依据。
材 料 和 方 法
1 材料与试剂
双硫仑和氯化铜购自Sigma;RPMI-1640 培养基、胎牛血清、胰蛋白酶、青霉素和链霉素均购自Gibco;Annexin V-FITC/PI Apoptosis Detection Kit购自eBioscience;PI/RNase Staining Buffer购自BD Pharmingen;150Al-G 硅探针(Bulgaria);AFM液体池探针(Bruker);其它试剂均为国产分析纯。细胞培养板、移液管、离心管、平皿和培养瓶均为Corning 产品。BD Falcon细胞过滤网为BD Pharmingen产品;流式细胞仪(Coulter Gallios)为Beckman Coulter产品;原子力显微镜(BioScope Catalyst NanoScope-V)为Veeco产品;倒置显微镜(IX51)为Olympus产品。
2 方法
2.1 细胞培养 人乳腺癌MCF-7和正常乳腺上皮MCF-10A细胞用含10% 胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640 培养基,置于5% CO2、37 ℃恒温培养箱中进行常规培养。每隔2 d用0.25% 胰酶和0.1% EDTA消化传代。
2.2 检测DSF/Cu对MCF-7和MCF-10A 细胞周期的影响 MCF-7和MCF-10A 细胞接种于6 孔板中,培养24 h 后分别换含0、400和800 nmol/L DSF/Cu的培养基2 mL继续培养6 h。 收集细胞与培养基于EP 管内,1 000 r/min 离心5 min,去除上清液,加入500 μL PBS 洗涤2 次,加入1 mL 70% 冷乙醇,于4 ℃下固定过夜,1 000 r/min离心5 min,沉淀细胞,吸去上清液,加入500 μL PBS 洗涤2 次、染色,每管样品中分别加入200 μL PI/RNase 染色液充分混合并重悬细胞,37 ℃室温避光孵育10 min,用BD Falcon细胞过滤网过滤细胞,上流式细胞仪检测,用激发波长488 nm,发射波长630 nm检测PI荧光信号。获取至少10 000个细胞,用MidFit软件分析细胞周期的分布。
2.3 Annexin V-FITC/PI 双染法检测细胞凋亡率 分组同上,收集各组细胞,于4 ℃ 离心5 min,1 200 r/min,冷PBS 漂洗细胞2 次。弃上清,将细胞重悬于200 μL binding buffer,各加入5 μL Annexin V-FITC和PI,混匀后室温避光孵育15 min,再加入200 μL binding buffer重悬细胞,上流式细胞仪检测。用激发波长488 nm,发射波长525 nm 和630 nm分别检测FITC和PI荧光信号。获取至少10 000个细胞,用Kaluza软件分析细胞凋亡率。
2.4 AFM成像观察 将多聚赖氨酸浸泡消毒过的盖玻片置于6孔板中,按1×108/L接种细胞,加入不同浓度的DSF/Cu孵育6 h 后,用1% 戊二醛固定细胞10 min,用超纯水洗涤细胞3 次,自然晾干。将制备好的样品置于原子力显微镜的XY 扫描台上,定位待扫描样品区域,采用ScanAsyst mode成像,150Al-G 硅探针,微悬臂的弹性系数为2.8 N/m,扫描速度为 0.8 Hz。用AFM 图像自带软件NanoScope Analysis 8.14对扫描方向上出现的低频背景噪音做平滑处理。
2.5 AFM单细胞水平检测生物力学特性 AFM单细胞力学测量在RPMI-1640培养基进行,采用接触模式,前进速度为1.63 m/s,扫描速度为0.8 Hz。选用AFM探针,半径为20 nm,弹簧常数为0.7 N/m,用热噪声方法校准弹性系数。使用相同的探针在每组3~5细胞测量超过1 000条力-距离曲线,用杨氏模量表示细胞的弹性,通过NanoScope Analysis 8.14计算和分析所有参数。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 17.0 进行统计学分析,多组间比较应用单因素方差分析,组间均数比较应用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 DSF/Cu对MCF-7和MCF-10A细胞凋亡的影响
流式细胞仪Annexin V/FITC双染法检测DSF/Cu诱导MCF-7和MCF-10A细胞凋亡率的变化。与对照组相比,400和800 nmol/L DSF/Cu作用乳腺癌MCF-7细胞6 h后,MCF-7细胞凋亡率分别增加至(24.06±15.2)%和(54.08±18.32)%,差异有统计学意义(P<0.01);而正常乳腺上皮MCF-10A细胞的凋亡率,由对照组的(0.30±0.24)%,略微增加至(2.97±2.06)%和(6.95±1.87)%,见图1。这表明DSF/Cu可显著诱导MCF-7细胞凋亡,而对MCF-10A细胞影响不大。
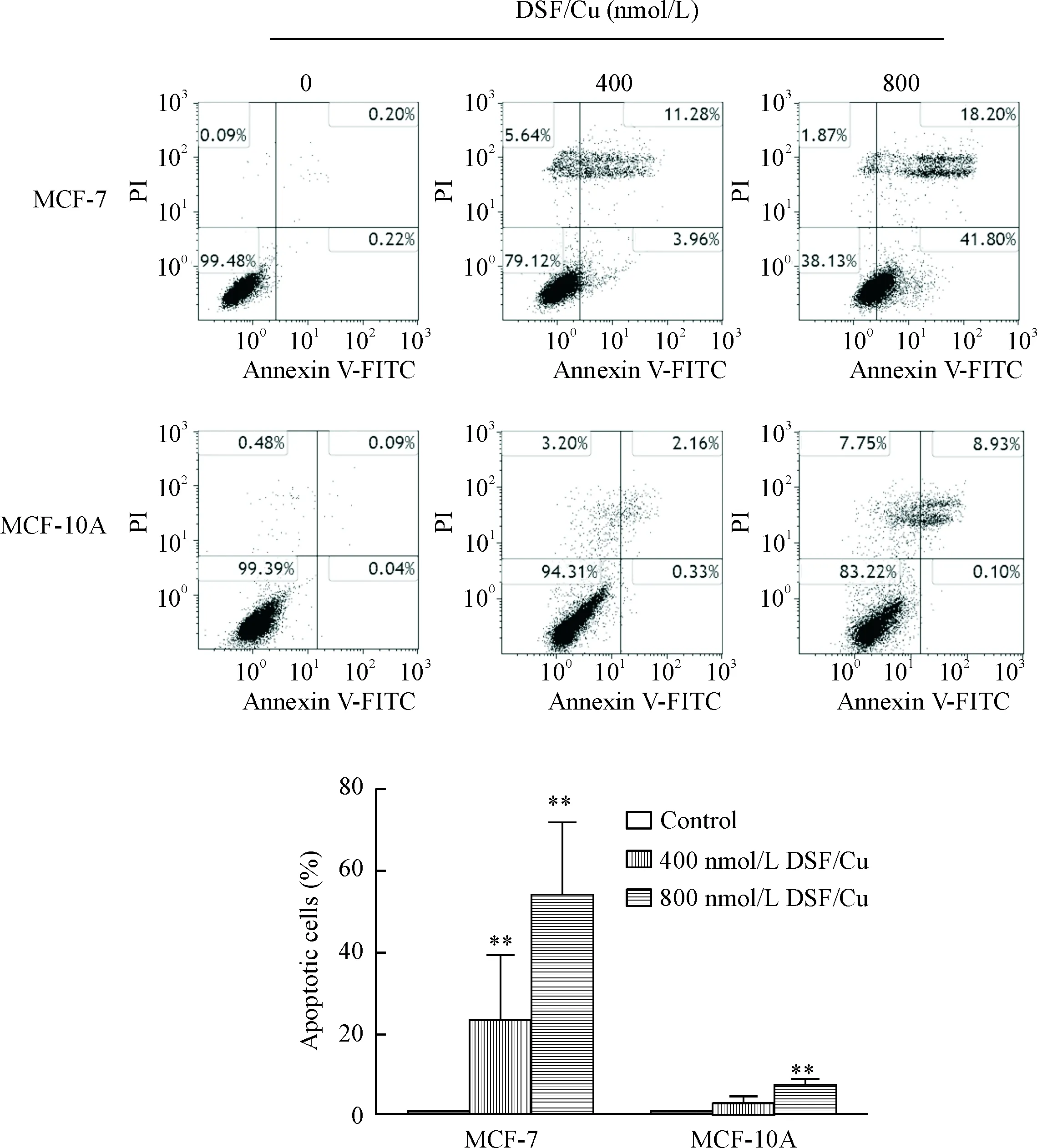
Figure 1.Apoptosis of MCF-7 and MCF-10A cells stained with Annexin V-FITC/PI after treated with 400 and 800 nmol/L of DSF/Cu for 6 h determined by flow cytometry. Mean±SD.n=3.**P<0.01vscontrol group.
图1 不同浓度DSF/Cu 对MCF-7和MCF-10A细胞凋亡的影响
2 DSF/Cu对MCF-7 细胞和MCF-10A细胞周期的影响
为了进一步说明DSF/Cu对MCF-7 和MCF-10A细胞的毒性杀伤作用,流式细胞仪检测DSF/Cu对MCF-7 和MCF-10A细胞周期影响。DSF/Cu作用于MCF-7细胞6 h后,与对照组G2/M期细胞比例(10.21±0.89)% 相比,400、800 nmol/L DSF/Cu 处理的MCF-7 G2/M 期细胞比例分别增加到(19.50±2.64)%和(22.16±0.51)%,差异有统计学意义(P<0.01);同时伴有G0/G1期细胞比例由对照组的(40.07±0.29)%减少到(28.17±1.69)%和(28.72±1.48)%,差异有统计学意义(P<0.01)。DSF/Cu对正常乳腺上皮MCF-10A细胞的周期也有影响,但与MCF-7有不同。主要表现在G0/G1期的比例升高,而S期比例降低,见图2。
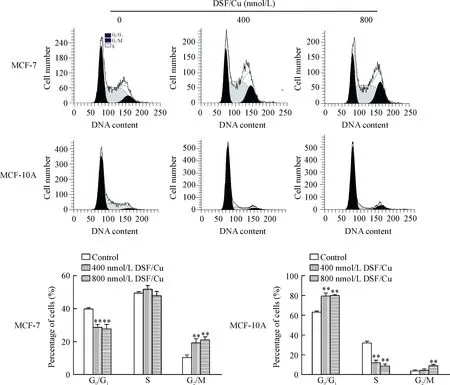
Figure 2.Cell cycle of MCF-7 and MCF-10A cells after treated with 400 and 800 nmol/L of DSF/Cu for 6 h determined by flow cytometry. Mean±SD.n=3.**P<0.01vscontrol group.
图2 不同浓度DSF/Cu 对MCF-7和MCF-10A细胞周期的影响
3 DSF/Cu对MCF-7和MCF-10A细胞表面超微结构的影响
AFM成像显示:对照组MCF-7细胞呈纺锤形,整个胞体表面分布有大小不等的凹陷或突起,非常粗糙,且胞体四周布满细丝状伪足。从放大的图片可以清晰地观察到丝状伪足似“树枝状”分布。 经400 和800 nmol/L DSF/Cu作用6 h后,细胞形态皱缩,细胞变小,表面逐渐变得平整,丝状伪足明显回缩、变短,尤其在800 nmol/L组,丝状伪足有些变成了板状伪足,甚至完全消失。而对正常MCF-10A细胞影响甚微,见图3。
定量分析显示:与对照组MCF-7细胞宽度(46.9±2.88)μm相比,作用400和800 nmol/L DSF/Cu组分别减小为(34.93±7.16)μm和(21.30±0.94)μm,呈浓度依赖性,差异有统计学意义(P<0.01)。而细胞高度与对照组(1.56±0.23)μm相比,400和800 nmol/L DSF/Cu组分别增加为(2.43±0.92)μm和(3.98±0.71)μm,呈浓度依赖性,差异有统计学意义(P<0.05)。均方根粗糙度(root-mean-square roughness,Rq)和平均粗糙度(average roughness,Ra),与对照组相比,加药组均减小,呈浓度依赖性,差异有统计学意义(P<0.05或P<0.01)。而对MCF-10A细胞基本没有影响,见图3、4。
4 DSF/Cu对MCF-7和MCF-10A细胞生物力学的影响
通过单细胞力学检测显示:当不同浓度 DSF/Cu 作用 MCF-7 和MCF-10A细胞6 h 后,2种细胞的杨氏模量随药物浓度的增加,均有所增加,呈浓度依赖性,差异有统计学意义(P<0.01)。但是,作用400和800 nmol/L DSF/Cu 6 h 后,MCF-7 细胞的杨氏模量分别增加了将近 1.3 倍和 2.5 倍,而MCF-10A细胞仅仅增加 0.1 倍和0.3 倍,MCF-7 细胞增加的比例要远远高于MCF-10A 细胞,见图5。
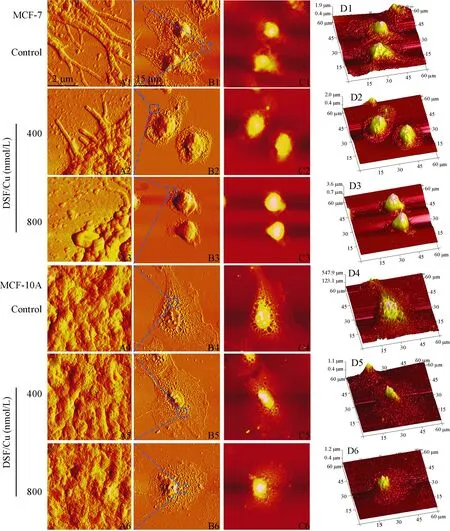
Figure 3.The morphological changes of MCF-7 and MCF-10A cells after treated with 400 and 800 nmol/L of DSF/Cu for 6h determined by atomic force microscopy. A1~A6: magnified images of filopodia in the edge of cell corresponding to the region indicated by blue frame in B1~B6, respectively; B1~B6: peak force error images; C2~C6: height images; D1~D6: three-dimensional morphology images.
图3 不同浓度DSF/Cu 对MCF-7和MCF-10A细胞膜表面形貌的影响
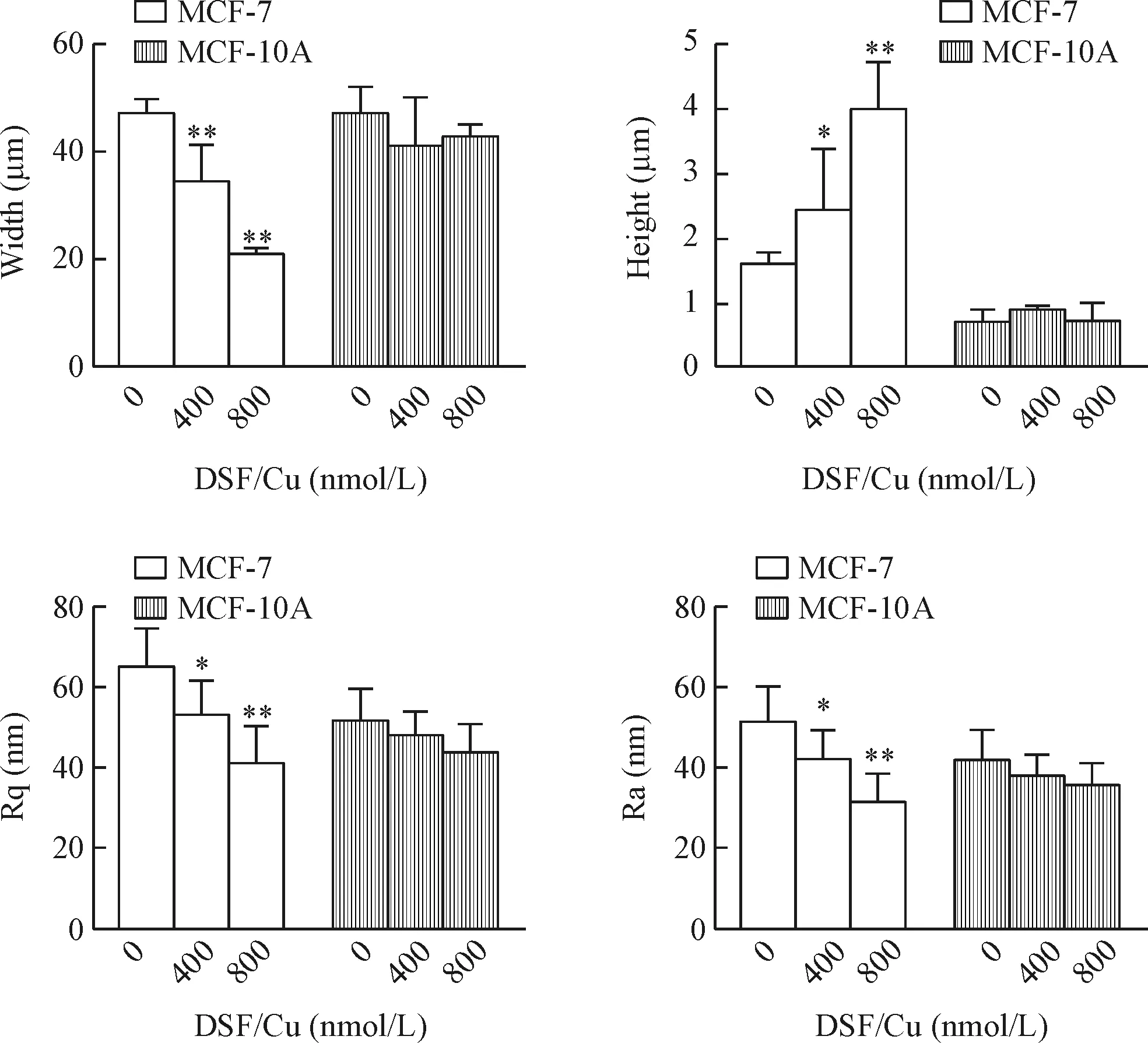
Figure 4.Histograms of statistical results of morphological changes of MCF-7 and MCF-10A cells after treated with 400 and 800 nmol/L of DSF/Cu for 6 h determined by atomic force microscopy. Rq: root-mean-square roughness; Ra: average roughness. Mean±SD.n=3.*P<0.05,**P<0.01vs0 nmol/L group.
图4 不同浓度DSF/Cu对MCF-7和MCF-10A细胞高度、宽度和粗糙度的影响
讨 论
乳腺癌属上皮源性恶性肿瘤,恶性程度高,有着高度的侵袭性及转移性,患者5 年生存率仅60%左右。临床上以乳腺癌根治术和辅助化疗为主,但手术治疗对机体造成的大面积损伤、化疗药物的毒副作用以及巨额的医疗费等问题,严重影响乳腺癌患者的疗效,导致癌症的复发。因此,寻找并研发高效低毒的分子靶向治疗药物不失为一种可行的临床抗乳腺癌治疗手段。
DSF分子式为C10H20N2S4,属二硫代氨基甲酸盐家族,拥有该家族的一般特性,即R1R2NC(S)SR3功能基团分子,以自身的巯基自发地结合金属元素Cu,螯合形成一种新的复合物DSF/Cu,该化合物具有显著的抗肿瘤效应[10-11]。有报道DSF/Cu显著诱导了乳腺癌细胞MCF10DCIS.com的细胞形态改变和核凋亡染色,同时抑制糜蛋白酶的活性,而对正常乳腺上皮细胞MCF-10A影响不大[6]。本研究进一步发现DSF/Cu在剂量为400和800 nmol/L、作用6 h即可显著诱导乳腺癌MCF-7细胞凋亡;而对正常乳腺上皮MCF-10A细胞几乎无凋亡作用。检测DSF/Cu对细胞周期的影响,发现DSF/Cu阻滞MCF-7细胞于G2/M期,伴有G0/G1期细胞的减少。而对MCF-10A细胞主要阻滞于G0/G1期。我们和前人的研究结果表明:DSF/Cu对乳腺癌细胞具有很强的细胞毒性作用,而对正常细胞却影响很少,具有特异高效低毒的抗乳腺癌作用。
目前关于DSF/Cu抗肿瘤的作用机制尚不完全明确。现有的研究提示其主要作为蛋白酶体抑制剂抑制NF-κB通路以及激活ROS,影响氧化还原稳态通过线粒体途径诱导细胞凋亡等功能有关。Xu等[12]报告DSF/Cu能够通过抑制NF-κB、激活ROS诱导急性淋巴细胞白血病Molt4细胞和淋巴瘤Raji细胞凋亡并抑制其增殖。 Chen等[6]报告DSF/Cu通过抑制乳腺癌细胞的20S和26S蛋白酶体的糜蛋白酶样活性,增加p27蛋白、上调促凋亡基因 Bax及激活caspase家族成员,最终促使细胞凋亡。在细胞凋亡过程中通常伴有细胞形貌、超微结构的改变[13]。本实验从纳米级水平上定性定量地分析了DSF/Cu分别诱导MCF-7和MCF-10A细胞的超微结构变化。
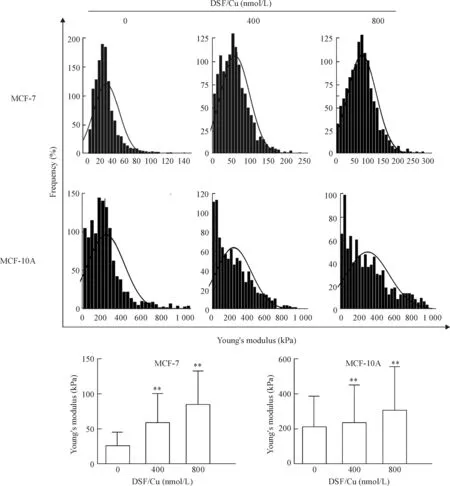
Figure 5.Young’s modulus of the MCF-7 and MCF-10A cells after treated with 400 and 800 nmol/L of DSF/Cu for 6 h determined by AFM. Mean±SD.n=1 000~1 200.**P<0.01vs0 nmol/L group.
图5 不同浓度 DSF/Cu 对MCF-7 和MCF-10A 细胞杨氏模量的影响
结果显示:DSF/Cu作用MCF-7细胞6 h后细胞形态皱缩、细胞变小、变圆,高度增加,Rq和Ra均下降,细胞丝状伪足明显回缩,变短,进而完全消失。而对正常MCF-10A细胞影响甚微。DSF/Cu对正常细胞和肿瘤细胞的超微结构的影响差异进一步说明DSF/Cu能够选择性杀伤癌细胞而不影响正常细胞。AFM 不仅是一种具有纳米级空间分辨率的表面成像工具,可获得二维、三维图像,对细胞表面形貌进行可视化表征;还可在皮牛级水平测量细胞的机械力学性质,比如杨氏模量和黏附力等,在研究细胞的生物力学功能、细胞与药物的相互作用,尤其抗肿瘤药物的抗癌机制等方面发挥了重要的作用[14-15],也成为当前研究的热点之一。我们进一步利用AFM的压痕技术并采集分析细胞与针尖之间随位移的变化作用力的改变,从而得到力-距离曲线,原位检测单个细胞的机械特性。结果显示:在未加药的情况下,人正常乳腺上皮MCF-10A细胞的杨氏模量要远远高于乳腺癌MCF-7细胞,将近增加了7倍,说明肿瘤细胞更软,变形能力很强,有助于癌细胞的转移,增加侵袭能力和恶性程度。当不同浓度DSF/Cu作用MCF-7和MCF-10A细胞6 h后,2种细胞的杨氏模量随药物浓度的增加,均有所增加,呈剂量依赖关系。然而,400和800 nmol/L DSF/Cu作用后的MCF-7细胞的杨氏模量分别增加了1.3倍和2.5倍,相比而言,MCF-10A细胞仅仅增加了0.1倍和0.3倍。由此可见,DSF/Cu对肿瘤细胞发挥更显著地细胞毒性作用,通过增加其硬度,降低变形能力来发挥抗肿瘤作用;而对正常细胞的影响小很多,这与我们前面得到的DSF/Cu对乳腺癌细胞具有高效低毒的细胞毒作用结果一致。
综上所述,本研究证实DSF/Cu可显著诱导人乳腺癌MCF-7细胞凋亡,而对正常乳腺上皮MCF-10A细胞影响较小。这可能与乳腺癌细胞和正常乳腺上皮细胞的生物力学差异有关。本研究为进一步探讨DSF/Cu影响细胞生物力学差异的分子机制如细胞骨架蛋白的排列等奠定前期实验基础;并且AFM以其纳米级超高分辨率和皮牛级力学测定可检测出药物处理后细胞反应的差异,这一优点可用于抗癌药物的筛选。
[1] Zghair AN, Sharma R, Sharma AK. Hormone responsive breast cancer and BRCA1 mutation: mechanism, regulation and iron-mediated effects[J].Curr Pharm Biotechnol, 2014, 15(12):1113-1124.
[2] Suh JJ, Pettinati HM, Kampman KM, et al. The status of disulfiram: a half of a century later[J]. J Clin Psychopharmacol, 2006, 26(3):290-302.
[3] Han J, Liu L, Yue X, et al. A binuclear complex constituted by diethyldithiocarbamate and copper(I) functions as a proteasome activity inhibitor in pancreatic cancer cultures and xenografts[J].Toxicol Appl Pharmacol, 2013, 273(3):477-483.
[4] Brar SS, Grigg C, Wilson KS, et al. Disulfiram inhibits activating transcription factor/cyclic AMP-responsive element binding protein and human melanoma growth in a metal-dependent mannerinvitro, in mice and in a patient with metastatic disease[J].Mol Cancer Ther,2004,3(9):1046-1060.
[5] Li LH, Yang HJ, Chen D, et al. Disulfiram promotes the conversion of carcinogenic cadmium to a proteasome inhibitor with pro-apoptotic activity in human cancer cells[J].Toxicol Appl Pharmacol,2008,229(2):206-214.
[6] Chen D, Cui QC, Yang H,et al. Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity[J].Cancer Res, 2006, 66(21):10425-10433.
[7] Wang YY, Li WD, Patel SS, et al. Blocking the formation of radiation-induced breast cancer stem cells[J].Oncotarget, 2014, 5(11):3743-3755.
[8] Zhao XQ, Zhong YX, Ye T, et al. Discrimination between cervical cancer cells and normal cervical cells based on longitudinal elasticity using atomic force microscopy[J].Nanoscale Res Lett, 2015, 10:482.
[9] Luo Q, Kuang DD, Zhang BY, et al. Cell stiffness determined by atomic force microscopy and its correlation with cell motility[J].Biochim Biophys Acta, 2016, 1860(9): 1953-1960.
[10]Yip NC, Fombon IS, Liu P, et al. Disulfiram modulated ROS-MAPK and NFκB pathways and targeted breast cancer cells with cancer stem cell-like properties[J].J Cancer, 2011, 104(10):1564-1574.
[11]Allensworth JL, Evans MK, Bertucci F, et al. Disulfiram (DSF) acts as a copper ionophore to induce copper-dependent oxidative stress and mediate anti-tumor efficacy in inflammatory breast cancer[J].Mol Oncol, 2015, 9(6):1155-1168.
[12]Xu B, Shi PC, Fombon IS, et al. Disulfiram/copper complex activated JNK/c-jun pathway and sensitised cytotoxicity of doxorubicin in doxorubicin resistant leukemia HL60 cells[J]. Blood Cells Mol Dis, 2011, 47(4):264-269.
[13]李梦佳, 马莲顺, 杨亚萍, 等. 大黄素阻抑人乳腺癌MCF-7细胞增殖和细胞周期进程[J].中国病理生理杂志, 2013, 29(8):1417-1421.
[14]Zhang L, Yang F, Cai JY, et al. In-situ detection of resveratrol inhibition effect on epidermal growth factor receptor of living MCF-7 cells by Atomic Force Microscopy[J]. Biosens Bioelectron, 2014, 15:271-277.
[15]Pi J, Li BL, Tu LY, et al. Investigation of quercetin-induced HepG2 cell apoptosis-associated cellular biophysical alterations by atomic force microscopy[J].Scanning, 2016, 38(2):100-112.
(责任编辑: 林白霜, 罗 森)
Effects of DSF/Cu on surface ultrastructures and mechanical properties of human breast cancer and normal breast epithelial cells
AIM: To study the effects of disulfiram/copper complex (DSF/Cu) on ultrastructures and mechanical properties of human breast cancer and normal breast epithelial cells by atomic force microscopy (AFM) based on the nanoscale resolution and piconewton force measurement level. METHODS: The change of cell cycle and apoptotic rate of MCF-7 cells and MCF-10A cells induced by DSF/Cu were compared by flow cytometry. The cell surface morphology, ultrastructure, height, width and roughness were detected by AFM. The effects of DSF/Cu on the hardness (Young’s modulus) of the 2 kinds of cells were determined by AFM with indentation technique. RESULTS: DSF/Cu significantly induced apoptosis of the MCF-7 cells in a dose-dependent manner, whereas had little effect on the MCF-10A cells. The cell cycle analysis showed that DSF/Cu induced G2/M arrest in the MCF-7 cells, but led to G0/G1arrest in the MCF-10A cells. The AFM images showed that the MCF-7 cells shrank and showed smaller and smoother morphology, and the filopodia were retracted obviously, even some became into lamellipodia, or disappeared completely after treated with DSF/Cu at concentrations of 400 and 800 nmol/L. The quantitative analysis indicated that the MCF-7 cells showed smaller width and larger height, and the root mean square roughness and average roughness were decreased significantly in a dose-dependent manner after treated with DSF/Cu at concentrations of 400 and 800 nmol/L. However, little effect in the MCF-10A cells was observed. The biomechanics test at a single cell level demonstrated that the Young’s modulus of the MCF-7 cells and MCF-10A cells were both increased, yet the proportion increased in the MCF-7 cells was much higher than that in the MCF-10A cells after treated with DSF/Cu at concentrations of 400 and 800 nmol/L. CONCLUSION: DSF/Cu has strong antitumor effect on breast cancer with high efficiency and low toxicity by changing the properties of the biomechanics specifically.
Disulfiram; Atomic force microscopy; Apoptosis; Young’s modulus
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1537- 08
2016- 05- 04
2016- 07- 13
国家自然科学基金资助项目(No.31070997;No.81372382);广东省自然科学基金资助项目(No.S2013010013780;No.2015A030313363);广东省医学科研基金资助项目(No.A2015506)
△通讯作者 杨海峰 Tel: 020-81887233; E-mail: yang_hf@126.com; 朱林燕 Tel: 020-85226219; E-mail: linyanzhu_jnu@163.com
▲并列第1作者
R363
A
10.3969/j.issn.1000- 4718.2016.09.001

