Notch3信号通路介导SAHA诱导的小细胞肺癌H446细胞凋亡*
陈红莲, 刘 辉, 杨旭光, 袁 磊
(漯河医学高等专科学校,河南 漯河 462002)
Notch3信号通路介导SAHA诱导的小细胞肺癌H446细胞凋亡*
陈红莲, 刘 辉, 杨旭光, 袁 磊△
(漯河医学高等专科学校,河南 漯河 462002)
目的: 观察辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid, SAHA)对人小细胞肺癌H446细胞凋亡的影响,并探讨其分子机制。方法: 选取人小细胞肺癌H446细胞作为研究对象,采用CCK-8法检测SAHA的细胞毒作用并测定IC50,采用流式细胞术检测细胞凋亡,转染N3ICD真核表达质粒构建高表达N3ICD的H446细胞系,采用RT-PCR法检测Notch3的mRNA水平,采用Western blot法检测Notch3、N3ICD、Puma和cleaved caspase-3的蛋白水平。结果: SAHA可显著降低H446细胞存活率且呈剂量依赖性(P<0.05),SAHA作用48 h的IC50为1.91 μmol/L;SAHA可诱导H446细胞凋亡且具有剂量依赖性(P<0.05);H446细胞中Notch3基因表达呈阴性,SAHA可使H446细胞Notch3基因恢复表达并激活Notch3信号通路(P<0.05);沉默Notch3基因可抑制SAHA对H446细胞的促凋亡作用(P<0.05);N3ICD高表达使H446细胞中Puma和cleaved caspase-3蛋白水平升高(P<0.01)。结论: 在体外SAHA可激活人小细胞肺癌H446细胞Notch3信号通路,上调Puma蛋白表达水平,诱导H446细胞凋亡。
辛二酰苯胺异羟肟酸; 小细胞肺癌; Notch3; 细胞凋亡; H446细胞
近年来,肺癌的发病率和病死率一直位居全球首位。在我国,肺癌的发病率和病死率一直处于上升趋势,目前在男性恶性肿瘤中占第一位,在女性中占第二位,已成为我国第一大癌症[1]。小细胞肺癌(small-cell lung cancer,SCLC)约占全部肺癌发生率的15%,尽管SCLC对初始化疗的敏感性高,但复发率高且二线治疗有效率低,患者预后较差[2]。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)是近年来出现的一种新型抗肿瘤药物,因其抑瘤效果好、毒副作用少,受到国内外的广泛关注。研究表明HDACi在体外可通过阻滞细胞周期和诱导细胞凋亡发挥抗肿瘤作用[3-4]。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA),又称伏立诺他,是第2代羟肟酸类的HDACi,目前已经进入III期临床实验[5]。然而目前关于SAHA对SCLC的抗肿瘤作用的研究较少[6-7],SAHA对SCLC的治疗作用还有待进一步实验证实。因此本研究在体外观察了SAHA对人小细胞肺癌H446细胞凋亡的影响并探究其分子机制,旨在初步探讨SAHA应用于治疗SCLC的潜在价值。
材 料 和 方 法
1 材料
人小细胞肺癌H446细胞购自中国科学院细胞库;胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基购自HyClone;SAHA购自Sigma;TRIzol试剂、RIPA裂解液、CCK-8试剂盒、Annexin V-FITC凋亡检测试剂盒和ECL化学发光试剂盒购自碧云天;脂质体Lipofectamine 2000购自Invitrogen;RT-PCR试剂盒和PCR引物购自大连宝生物公司;无内毒素质粒提取试剂盒购自北京康为世纪公司;Notch3干扰质粒(pRS-shNotch3)和空载体(pRS)购自OriGene;人Notch3胞内段(Notch3 intracellular domain,N3ICD)真核表达质粒(hN3ICD-pCDF1-MCS2-EF1-copGFP)和空质粒(pCDF1-MCS2-EF1-copGFP)购自Addgene;抗Notch3、Puma、cleaved caspase-3和β-actin抗体购自Cell Signaling Technology。
2 方法
2.1 细胞培养 人小细胞肺癌H446细胞在含10% FBS的RPMI-1640培养液中,于37 ℃、5% CO2培养箱中进行培养。当细胞融合度达到80%时,以0.25%的胰蛋白酶消化,按1∶3的比例传代。
2.2 SAHA工作液的配制 SAHA用DMSO配制成10 mmol/L的储备液,分装后于-20 ℃保存。使用时用含1% FBS的RPMI-1640培养液进行稀释,配制成所需SAHA浓度的工作液。
2.3 CCK-8实验检测细胞活力 取对数生长期的H446细胞,制成密度为1×108/L的细胞悬液,以每孔100 μL接种于96孔板,于37 ℃、5% CO2细胞培养箱中培养24 h。吸去原培养液,各孔分别加入200 μL含有不同浓度SAHA的工作液(0.1 μmol/L、0.2 μmol/L、0.4 μmol/L、0.8 μmol/L、1.6 μmol/L、3.2 μmol/L和6.4 μmol/L),每组设5个复孔,同时设调零孔和对照孔(0.1% DMSO),于37 ℃、5% CO2细胞培养箱中培养48 h。每孔加入20 μL CCK-8溶液,37 ℃培养1 h,用酶标仪检测各孔450 nm波长吸光度A值。细胞存活率=加药孔A值/对照孔A值×100%。采用SPSS 16.0软件Probit回归模型计算SAHA对细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)。
2.4 流式细胞术检测细胞凋亡 取对数生长期的H446细胞,制成密度为1×109/L的细胞悬液,以每孔2 mL接种于6孔板,于37 ℃、5% CO2细胞培养箱中培养24 h。吸去原培养液,各孔分别加入2 mL含有不同浓度SAHA的工作液(0.5 μmol/L、1 μmol/L和2 μmol/L),同时设对照组(0.1% DMSO),每组设3个复孔,继续培养48 h。收集各孔细胞,用预冷的PBS洗涤细胞1次,用预冷的结合缓冲液重悬细胞,加入Annexin V-FITC轻轻混匀后于室温避光孵育15 min。1 000 r/min离心5 min,弃上清,重悬细胞于预冷的结合缓冲液中,加入PI染色液轻轻混匀后于4 ℃避光保存,立即用流式细胞仪分析检测。
2.5 RT-PCR检测Notch3的mRNA表达 参照TRIzol说明书抽提上述各组细胞总RNA,取2 μg总RNA进行反转录,反转录条件:42 ℃ 60 min,70 ℃ 15 min,所得反转录反应液于-20 ℃冻存备用。取2 μL上述反转录反应液进行PCR,PCR反应条件为94 ℃ 1 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环。引物采用Primer Premier 5.0软件设计,经PubMed BLAST验证。Notch3的上游引物为5′-CCC-AGGGTGTCTTCCAGATT-3′,下游引物为5′-ATGTCCTGGTGCAGTCTCTC-3′,PCR产物为409 bp;GAPDH的上游引物为5′-CCTGACCTGCCGTCTAGAAA-3′,下游引物为5′-TACTCCTTGGAGGCCATGTG-3′,PCR产物为276 bp。PCR产物采用琼脂糖凝胶电泳成像,使用ImageJ软件进行条带灰度值分析。
2.6 质粒转染 将Notch3干扰质粒、人N3ICD表达质粒和空质粒分别转染H446细胞;转染方法参照Lipofectamine 2000操作说明书进行,置于37 ℃、5% CO2培养箱中培养48 h,得到4组细胞:shControl组为转染pRS质粒的H448细胞;shNotch3组为转染pRS-shNotch3质粒的H446细胞;control组为转染pCDF1-MCS2-EF1-copGFP质粒的H448细胞;N3ICD组为转染hN3ICD-pCDF1-MCS2-EF1-copGFP质粒的H446细胞。
2.7 Western blot法检测蛋白水平 用RIPA裂解各组细胞提取总蛋白,用紫外分光光度法测定蛋白质浓度,然后进行SDS-PAGE电泳并转移至PVDF膜,用封闭液(5% BSA/TBST)封闭1 h,加入Notch3、Puma、cleaved caspase-3和β-actin的I抗(均1∶1 000稀释),4 °C孵育过夜,TBST洗膜3次,加入II抗(1∶1 000稀释)室温下孵育1 h,TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,拍照后使用ImageJ软件进行灰度分析,β-actin蛋白条带为内参照。
3 统计学处理
采用SPSS 16.0分析数据,实验数据用均数±标准差(mean±SD)表示。两组间比较采用t检验;多组间比较采用单因素方差分析(one-way ANOVA),并用Bonferroni校正的t检验进行各组均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1 SAHA抑制H446细胞活力
CCK-8实验结果显示,自0.2 μmol/L开始,随着SAHA浓度逐渐升高,H446细胞存活率逐渐降低(P<0.05),当SAHA浓度达到6.4 μmol/L时H446细胞存活率降至最低(P<0.05),这表明SAHA对H446细胞生长的抑制作用具有剂量依赖性。SAHA作用48 h的IC50为1.91 μmol/L,见图1。
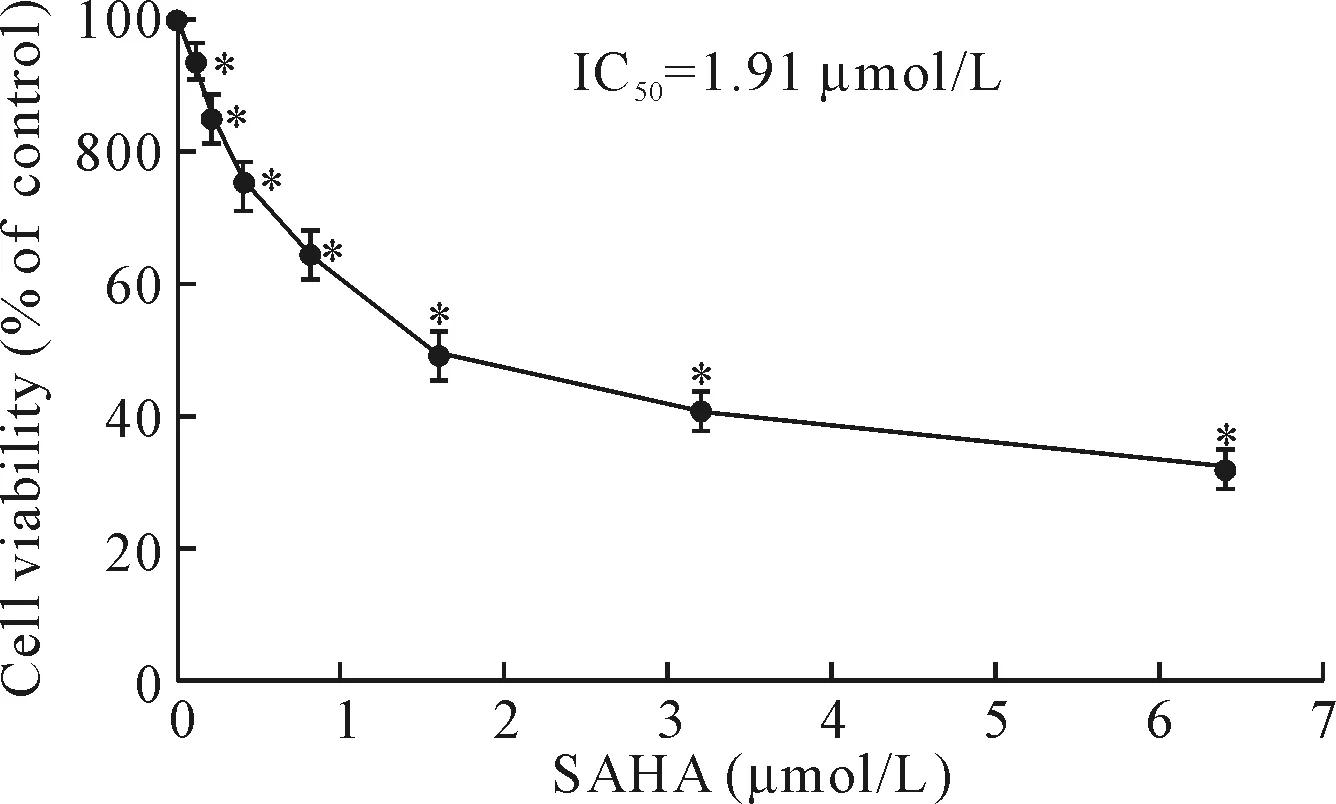
Figure 1.The effect of SAHA on the viability of H446 cells. Mean±SD.n=5.*P<0.05vs0 μmol/L.
图1 SAHA对H446细胞存活率的影响
2 SAHA促进H446细胞凋亡
流式细胞术检测结果显示,按照各不同浓度SAHA 组(0 μmol/L、0.5 μmol/L、1 μmol/L和2 μmol/L),H446细胞的凋亡率依次升高(P<0.05);2 μmol/L SAHA组的H446细胞凋亡率最高(P<0.05)。这表明SAHA促进H446细胞凋亡且具有剂量依赖性,见图2。
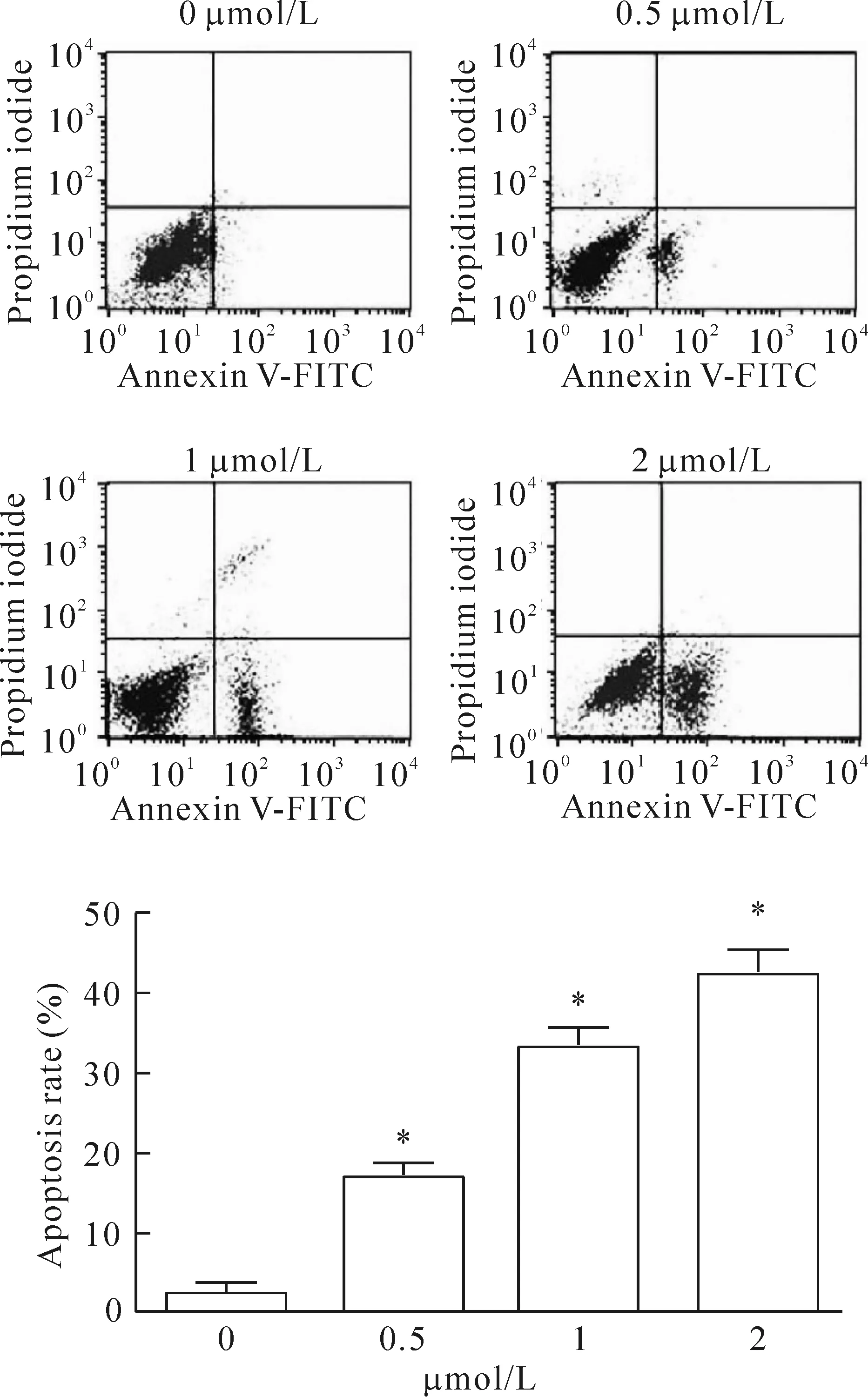
Figure 2.The effect of SAHA on the apoptosis of H446 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L.
图2 SAHA对H446细胞凋亡的影响
3 SAHA促进H446细胞中Notch3和N3ICD蛋白表达
Western blot实验结果显示,对照组H446细胞中的Notch3和N3ICD蛋白呈阴性表达;然而经不同浓度SAHA作用48 h后,H446细胞中Notch3和N3ICD的蛋白表达均呈阳性,且随着SAHA浓度的增加两者的表达水平依次升高(P<0.05),2 μmol/L SAHA组H446细胞中Notch3和N3ICD的蛋白表达水平最高(P<0.05)。这表明SAHA可激活H446细胞Notch3信号通路,见图3。
4 SAHA促进H446细胞中Notch3 mRNA表达
RT-PCR实验结果显示,对照组H446细胞中Notch3和N3ICD的mRNA表达呈阴性;经不同浓度SAHA作用48 h后,H446细胞中Notch3的mRNA表达均呈阳性,且随着SAHA浓度的增加而依次升高(P<0.05),2 μmol/L SAHA组H446细胞中Notch3的mRNA表达水平最高(P<0.05)。这表明SAHA可恢复H446细胞Notch3基因的表达,见图4。
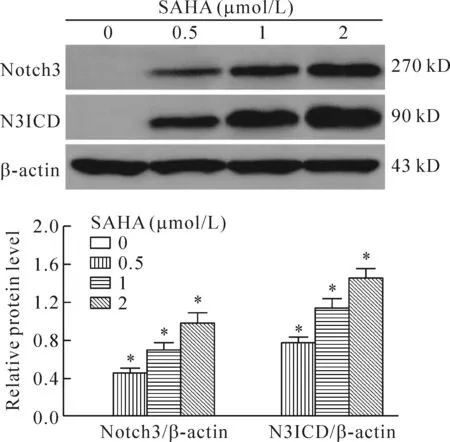
Figure 3.The effect of SAHA on the protein levels of Notch3 and N3ICD in the H446 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L.
图3 SAHA对H446细胞中Notch3和N3ICD蛋白水平的影响
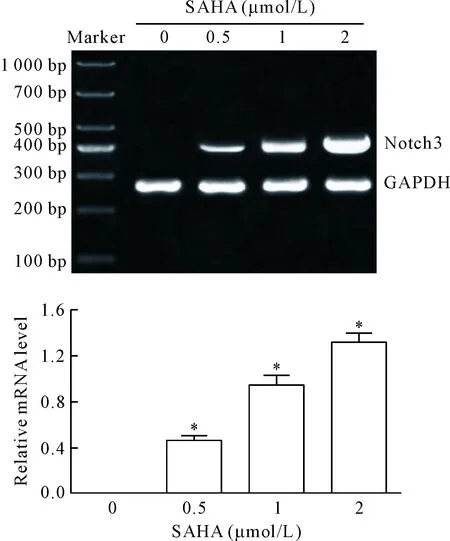
Figure 4.The effect of SAHA on the mRNA level of Notch3 in the H446 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L.
图4 SAHA对H446细胞中Notch3 mRNA水平的影响
5 沉默Notch3对细胞凋亡的影响
流式细胞术检测结果显示, shNotch3组的H446细胞凋亡率与对照组相比差异无统计学显著性;shControl+SAHA组的H446细胞凋亡率与对照组相比明显升高(P<0.05);与shControl+SAHA组相比,shNotch3+SAHA组H446细胞凋亡率显著降低(P<0.05),此2组中SAHA的终浓度均为1 μmol/L。这表明沉默Notch3基因可抑制SAHA对H446细胞的促凋亡作用,见图5。
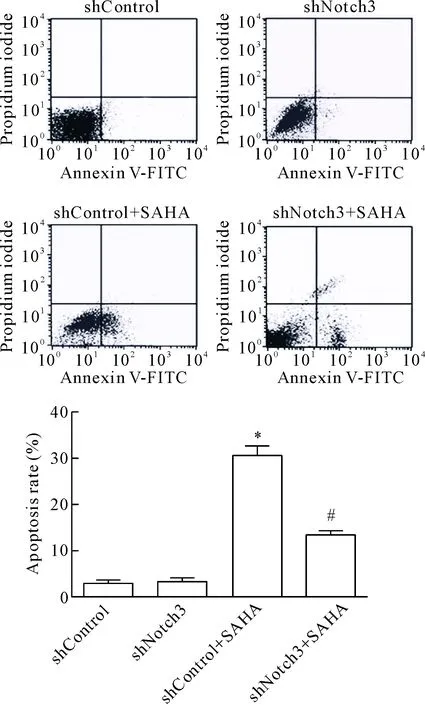
Figure 5.The effect ofNotch3 silencing on the apoptosis of H446 cells. Mean±SD.n=3.*P<0.05 vs shControl group;#P<0.05vsshControl+SAHA group.
图5 沉默Notch3对H446细胞凋亡的影响
6 N3ICD高表达对H446细胞中Puma和cleaved caspase-3蛋白水平的影响
Western blot实验的结果显示,与对照组相比,N3ICD组H446细胞中促凋亡蛋白Puma的表达水平明显升高(P<0.05);同时凋亡执行蛋白caspase-3被活化,cleaved caspase-3蛋白水平较对照组显著升高(P<0.05)。这表明Notch信号通路可通过Puma促进H446细胞凋亡,见图6。
讨 论
临床上一般按生物学行为和临床病程将肺癌分为SCLC和非小细胞肺癌(non-small-cell lung cancer,NSCLC)。SCLC患者在就诊时常常已经处于播散状态。SCLC对化疗敏感性高,一线化疗后局限期SCLC化疗有效率可达70%以上,广泛期SCLC也达60%以上。尽管SCLC的一线治疗效果明显,但大多数SCLC患者仍会复发,预后差,局限期SCLC患者的中位生存期只有14~20个月,广泛期SCLC患者更是低至9~11个月。对于早期复发的SCLC患者,由于化疗耐药目前尚缺乏有效的二线治疗药物,二线治疗的有效率不足10%[2]。因此在一线和二线治疗之间使用安全高效的化疗药物或靶向药物进行维持治疗,以延长SCLC患者的生存期,是值得探索的临床治疗模式。
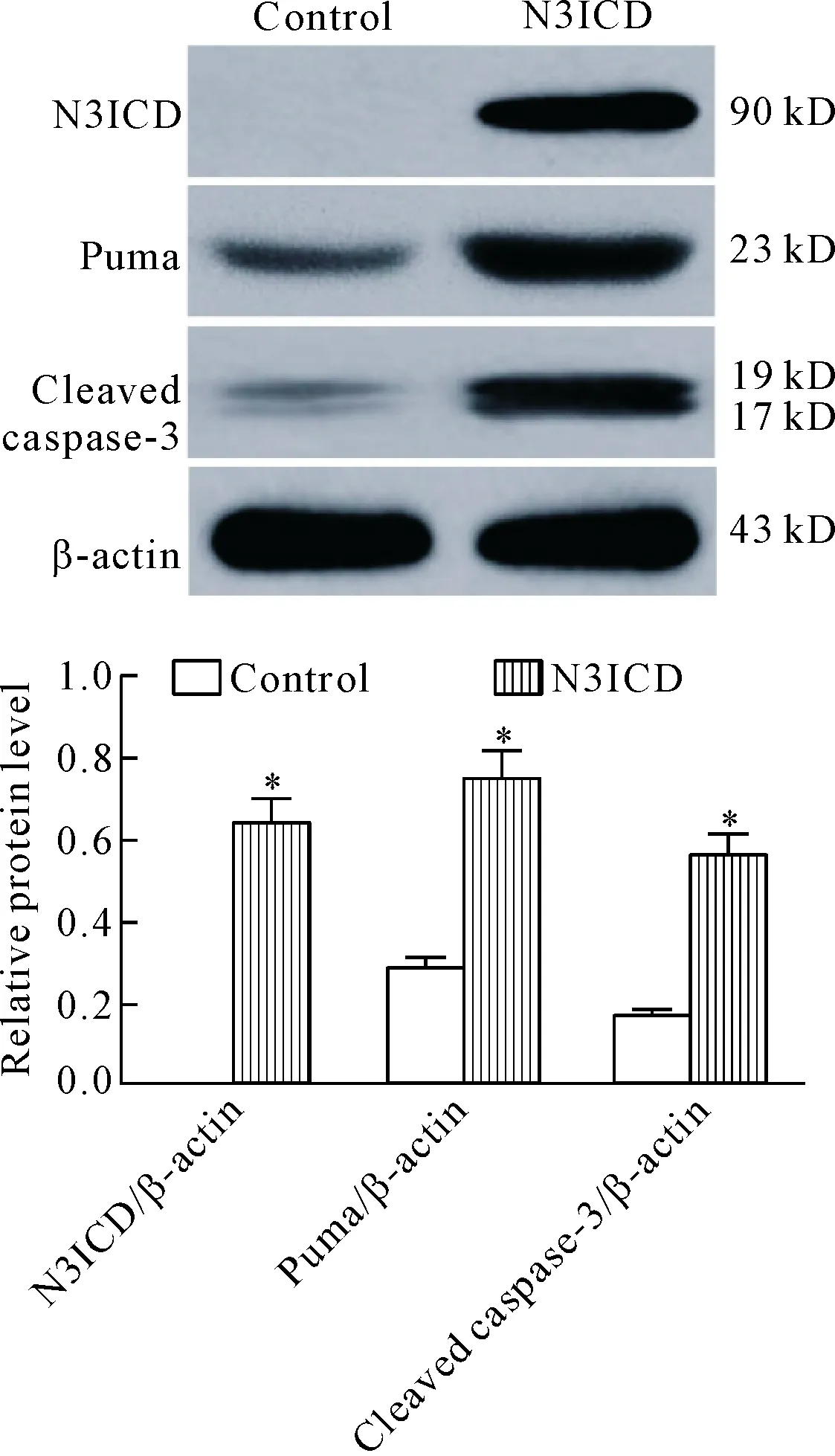
Figure 6.The effect of N3ICD on the protein levels of Puma and cleaved caspase-3 in the H446 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图6 N3ICD过表达对H446细胞Puma和cleaved caspase-3蛋白水平的影响
在本研究中,CCK-8法检测细胞活力和流式细胞术的分析结果表明,SAHA对人小细胞肺癌H446细胞具有显著的抑制作用且呈剂量依赖性。SAHA可诱导H446细胞中Notch3和N3ICD蛋白的表达以及Nocth3的mRNA表达,这表明SAHA可激活H446细胞中Notch3信号通路。为探究Notch3信号通路是否参与了SAHA所诱导的H446细胞凋亡,我们首先采用shRNA技术沉默Notch3基因,结果显示抑制Notch3表达可抑制SAHA诱导的H446细胞凋亡,随后我们又将人N3ICD真核高表达质粒转染至H446细胞,结果发现N3ICD高表达可使H446细胞中的Puma和cleaved caspase-3蛋白水平显著升高,这表明SAHA可通过激活Notch3信号通路上调Puma促进H446凋亡。本研究结果为SAHA应用于临床治疗SCLC患者提供了一定的理论依据,但由于本研究仅采用了一种人SCLC细胞系,具有一定的局限性,也未探究SAHA与其它化疗药物联用的有效性和安全性。因此SAHA对其它SCLC细胞的抑瘤作用以及SAHA与其它化疗药物的联合使用将是本研究团队下一步拟探究的问题。
SAHA在体外已证实对多种恶性肿瘤具有较好的抗肿瘤效果,包括肺癌[6-7]、乳腺癌[8]、神经母细胞瘤[9]、胆管癌[10]和口腔癌[11]。Bruzzese等[6]的研究发现,SAHA可诱导人小细胞肺癌H209和H526细胞凋亡,这可能与其提高细胞中ROS水平有关;同时还发现SAHA可使小细胞肺癌H209和H526细胞阻滞于G1期。最新的一项研究表明,SAHA可通过促进Noxa和/或Bim基因表达诱导多种SCLC细胞凋亡[7]。以上研究结果表明, SAHA对SCLC的抑制作用可能与其诱导的细胞周期阻滞和细胞凋亡有关,但具体的分子机制尚需进一步研究。
Notch3信号通路在肺癌中似乎扮演着双重角色。一些研究表明,Notch3信号通路可促进NSCLC细胞增殖、侵袭和肿瘤干细胞富积[12-14]。但也有研究发现,Notch3可抑制NSCLC细胞增殖和淋巴结转移[15]。Hassan等[16]研究发现,在受检的6个NSCLC细胞系中Notch3蛋白表达均呈阳性,28例NSCLC病理组织中Notch3蛋白阳性率接近80%;与之相反,在受检的5个SCLC细胞系中除H69AR和SBC-3以外其余3个SCLC细胞系的Notch3蛋白表达呈阴性,12例SCLC病理组织中Notch3蛋白表达均为阴性;在NSCLC细胞系A549和H2170细胞以及SCLC细胞系H69AR中沉默Notch3基因可抑制细胞增殖和侵袭并诱导细胞凋亡;与之相反,高表达N3ICD可抑制SCLC细胞系H1688细胞增殖和侵袭并诱导其凋亡。这些研究结果表明,Notch3信号通路究竟是发挥促癌作用还是抗癌作用取决于细胞类型,Notch3信号通路对SCLC的抑制作用尚需更多实验证实。
综上所述,本研究表明,SAHA在体外可激活人小细胞肺癌H446细胞Notch3信号通路,进而上调Puma蛋白表达,最终导致H446细胞凋亡。这加深了对SAHA抑瘤作用的认识,然而SAHA在体内是否也通过该机制发挥作用尚待进一步阐明。
[1] Hong QY, Wu GM, Qian GS, et al. Prevention and ma-nagement of lung cancer in China[J]. Cancer, 2015,121 (Suppl 17):3080-3088.
[2] Semenova EA, Nagel R, Berns A. Origins, genetic landscape, and emerging therapies of small cell lung cancer[J]. Genes Dev, 2015, 29(14):1447-1462.
[3] 邹 琛,周 俊,陆国平. 组蛋白去乙酰化酶抑制剂与细胞周期和凋亡关系的研究进展[J]. 中国病理生理杂志, 2007, 23(12):2487-2490.
[4] Bose P, Dai Y, Grant S. Histone deacetylase inhibitor (HDACI) mechanisms of action: emerging insights[J]. Pharmacol Ther, 2014, 143(3):323-336.
[5] Krug LM, Kindler HL, Calvert H, et al. Vorinostat in patients with advanced malignant pleural mesothelioma who have progressed on previous chemotherapy (VANTAGE-014): a phase 3, double-blind, randomised, placebo-controlled trial[J]. Lancet Oncol, 2015, 16(4):447-456.
[6] Bruzzese F, Rocco M, Castelli S, et al. Synergistic antitumor effect between vorinostat and topotecan in small cell lung cancer cells is mediated by generation of reactive oxygen species and DNA damage-induced apoptosis[J]. Mol Cancer Ther, 2009, 8(11):3075-3087.
[7] Nakajima W, Sharma K, Hicks MA, et al. Combination with vorinostat overcomes ABT-263 (navitoclax) resistance of small cell lung cancer[J]. Cancer Biol Ther, 2016, 17(1):27-35.
[8] Wang ZT, Chen ZJ, Jiang GM, et al. Histone deacetylase inhibitors suppress mutant p53 transcription via HDAC8/YY1 signals in triple negative breast cancer cells[J]. Cell Signal, 2016, 28(5):506-515.
[9] He W, Wu Y, Tang X, et al. HDAC inhibitors suppress c-Jun/Fra-1-mediated proliferation through transcriptionally downregulating MKK7 and Raf1 in neuroblastoma cells[J]. Oncotarget, 2016, 7(6):6727- 6747.
[10]Sakamoto T, Kobayashi S, Yamada D, et al. A histone deacetylase inhibitor suppresses epithelial-mesenchymal transition and attenuates chemoresistance in biliary tract cancer[J]. PLoS One, 2016, 11(1):e0145985.
[11]Jang B, Shin JA, Kim YS, et al. Growth-suppressive effect of suberoylanilide hydroxamic acid (SAHA) on human oral cancer cells[J]. Cell Oncol (Dordr), 2016, 39(1):79-87.
[12]Konishi J, Kawaguchi KS, Vo H, et al. Gamma-secretase inhibitor prevents Notch3 activation and reduces proliferation in human lung cancers[J]. Cancer Res, 2007, 67(17):8051-8057.
[13]Liu L, Chen X, Wang Y, et al. Notch3 is important for TGF-β-induced epithelial-mesenchymal transition in non-small cell lung cancer bone metastasis by regulating ZEB-1[J]. Cancer Gene Ther, 2014, 21(9):364-372.
[14]Arasada RR, Amann JM, Rahman MA, et al. EGFR blockade enriches for lung cancer stem-like cells through Notch3-dependent signaling[J]. Cancer Res, 2014, 74(19):5572-5584.
[15]Lee S, Jung C, Ko Y, et al. Expression of Notch 1 and 3 is related to inhibition of lymph node metastasis and progression in non-small lung carcinoma[J]. Basic Appl Pathol, 2008, 1(2):93-97.
[16]Hassan WA, Yoshida R, Kudoh S, et al. Evaluation of role of Notch3 signaling pathway in human lung cancer cells[J]. J Cancer Res Clin Oncol, 2016, 142(5):981-993.
(责任编辑: 陈妙玲, 罗 森)
Notch3 pathway mediates SAHA-induced apoptosis in human small-cell lung cancer H446 cells
CHEN Hong-lian, LIU Hui, YANG Xu-guang, YUAN Lei
(LuoheMedicalCollege,Luohe462002,China.E-mail:fzyx_yl@163.com)
AIM: To investigate the effect of suberoylanilide hydroxamic acid (SAHA) on the apoptosis of human small-cell lung cancer H446 cells and its possible mechanism. METHODS: H446 cells were incubated in the medium containing SAHA. CCK-8 assay was used to detect the anti-tumor effect of SAHA on the H446 cells, and IC50values of SAHA were calculated. Flow cytometry was used to analyze the apoptosis. AfterNotch3 gene was silenced, the pro-apopto-tic effect of SAHA on the H446 cells was inhibited (P<0.05). Eukaryotic expression plasmid containingN3ICDwas transfected into the H446 cells, so that N3ICD was expressed in the H446 cells. The mRNA expression of Notch3 was measured by RT-PCR. The protein levels of Notch3, N3ICD, Puma and cleaved caspase-3 were determined by Western blot. RESULTS: SAHA remarkably reduced the cell viability in a dose-dependent manner (P<0.05), and the IC50value of SAHA was 1.91 μmol/L. SAHA induced apoptosis in a dose-dependent manner (P<0.05). The expression ofNotch3 gene was negative in the H446 cells, SAHA reactivatedNotch3 gene and Notch3 pathway in a dose-dependent manner (P<0.05).Notch3 knockdown inhibited apoptosis induced by SAHA (P<0.05). Over-expression of N3ICD up-regulated the protein levels of Puma and cleaved caspase-3.CONCLUSION: SAHA induces apoptosis in human small-cell lung cancer H446 cells by activating Notch3 pathway and up-regulating the protein level of Puma.
Suberoylanilide hydroxamic acid; Small-cell lung cancer; Notch3; Apoptosis; H446 cells
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1556- 06
2016- 04- 19
2016- 06- 20
河南省科技厅科技发展计划项目(No.142102310203);漯河医学高等专科学校自然科学研究计划项目(No.2013-S-LMC04)
△通讯作者 Tel: 0395-2969424; E-mail: fzyx_yl@163.com
R734.2; R730.23
A
10.3969/j.issn.1000- 4718.2016.09.004

