醇沉分级粗茶多糖的抗氧化活性比较及变化机制
杨军国,陈 键,王丽丽,宋振硕,陈 林
(福建省农业科学院茶叶研究所,福建福安 355015)
醇沉分级粗茶多糖的抗氧化活性比较及变化机制
杨军国,陈键,王丽丽,宋振硕,陈林*
(福建省农业科学院茶叶研究所,福建福安 355015)
以粗茶多糖提取物为原料,设置50%、60%、70%、80%、90%等5个浓度梯度乙醇沉淀分级制得茶多糖样品TPs-50、TPs-60、TPs-70、TPs-80和TPs-90,探明其沉淀分级特性、抗氧化活性表达及变化机制。结果表明,TPs-50和TPs-80得率可达到9%以上,茶多糖含量变化趋势为TPs-60>TPs-50>TPs-70>TPs-90>TPs-80。TPs-80中茶多糖含量为8.06%,占总析出量的14.76%,而可溶性蛋白含量占总析出量的43.82%。抗氧化活性实验表明,DPPH自由基清除率变化趋势为TPs-50>TPs-60>TPs-70>TPs-80>TPs-90,还原力亦呈降低趋势,与茶多糖含量变化趋势不一致。检测分析茶多糖样品中抗氧化组分含量发现,茶多糖、茶多酚、儿茶素类、总黄酮、咖啡因等组分皆有析出,析出量以TPs-50中最高。除茶多糖外,其他抗氧化组分析出量TPs-60、TPs-70和TPs-80之间逐渐变大,TPs-90中骤减至最低。相关性分析表明,茶多酚、总黄酮和咖啡因与茶多糖样品抗氧化活性表达呈显著性正相关,而茶多糖亦有正相关性,却未呈显著性相关,表明其抗氧化活性的表达更多依赖于其他活性组分的协同作用。
茶多糖,乙醇,组成成分,抗氧化
茶多糖(Tea Polysaccharides,TPs)系茶叶中具有生物活性复合多糖的简称,同类茶叶中原料粗老者居多。研究证实,茶多糖具有多种保健功效,如抗氧化、降血糖、降血脂、抗血栓、抗癌、抗辐射、增强机体免疫力等[1-2],其抗氧化和降血糖功效尤为突出,成为众多学者关注的焦点。茶多糖具有抗氧化活性,能清除包括1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)在内的多种自由基[3-5]。然而针对茶多糖的抗氧化性,尚存有争议。有研究表明[6-7],纯度高的茶多糖清除自由基能力远弱于粗茶多糖,揭示茶多糖的抗氧化活性表达可能依赖于其他成分的协同作用,如茶多酚、黄酮类,这还需要进一步研究。
茶多糖是一类杂多糖复合物,构象复杂,不同工艺制得的茶多糖特性也有所不同。现阶段其加工制备仅限于实验室阶段,其中纯化分级为核心技术,常采用纤维素阴离子交换柱层析法和凝胶柱层析法[8-10],限于成本和得率,尚难以应用于工业化生产。乙醇可用于植物多糖的分级纯化,如黄花菜[11]、马齿苋[12]、香薷[13],具有广阔的发展应用前景。然而有关乙醇分级纯化茶多糖的报道较少,同时过多关注于茶多糖得率的提高、提取时间的缩短和成本的节约,而对其药理活性的保留或增强研究较少[14]。鉴于此,本实验以热水浸提法得到粗茶多糖提取物,采用乙醇分级沉淀法进行纯化制得不同级数的茶多糖产品,测定茶多糖、茶多酚、儿茶素类、咖啡因、总黄酮类以及可溶性蛋白含量,结合清除DPPH活性检测和还原力检测,从而探明乙醇分级纯化过程中茶多糖的抗氧化活性变化。
1 材料与方法
1.1材料与设备
黄旦乌龙茶购自闽东茶区;黄旦乌龙茶多糖粗提物系由大闽食品(漳州)有限公司制备完成(茶叶提取罐、碟式离心机、超滤膜、反渗透膜、冷冻干燥机);儿茶素品系及咖啡碱购自阿拉丁(试剂)上海有限公司,纯度均>98%;芦丁购自成都曼思特生物科技有限公司,纯度≥98%(UV);DPPH(纯度>97.0%)购自于东京化成工业株式会社;其余均为色谱纯或分析纯试剂。
T6新世纪紫外可见分光光度计北京普析;BioSpec-nano超微量分光光度计岛津公司;美国Agilent1260型液相色谱系统,包括四元泵(G1311C VL)、标准自动进样器(G1329B)、柱温箱(G1316A)和二极管阵列检测器(G1315D VL);色谱柱Zorbax SB-C18(4.6 mm×150 mm,5 μm,美国Agilent);ACD-0502-U实验室超纯水系统重庆颐洋;DK-8D型电热恒温水浴槽上海一恒;DHC-9246A电热恒温鼓风干燥箱上海精宏等。
1.2实验方法
1.2.1茶多糖样品制备以黄旦乌龙茶为原料,按料液比1∶15、温度90 ℃、时间25 min等参数浸提,经粗分、超滤、反渗透浓缩、冷冻干燥后制得茶多糖粗提物。称取该茶多糖粗提物10.00 g,溶解后超纯水定容至100 mL,分别依次用不同浓度的乙醇沉淀制得不同级数的茶多糖样品,具体方法见图1。茶多糖样品得率和含量计算公式为:
式中:M样品为制得的不同级数茶多糖样品质量;M原料为原料质量(粗茶多糖提取物)。
式中:M醇析为该浓度乙醇沉淀析出的总质量;TPs醇析为该浓度乙醇沉淀是茶多糖析出质量。

图1 乙醇沉淀分级茶多糖样品的制备路线Fig.1 Preparation method of different purified classification on tea polysaccharides with ethanol
1.2.2茶多糖含量的测定采用蒽酮-硫酸法,以无水葡萄糖作为标准对照。吸取蒽酮试剂8.0 mL于25 mL容量瓶中,分别滴入1.0 mL不同浓度标准葡萄糖溶液(0、25、50、100、150、200 μg/mL),边滴边摇匀,沸水加热3 min,快速冷却,于600 nm处比色测定,以吸光度值为纵坐标,以葡萄糖含量(μg/mL)为横坐标,绘制标准曲线并计算线性回归方程。吸取蒽酮试剂8.0 mL于25 mL容量瓶中,分别滴加不同级数茶多糖样品1.0 mL,摇匀后沸水加热3 min,快速冷却,600 nm处比色测定,并根据葡萄糖线性标准回归方程计算样品中多糖含量。
1.2.3可溶性蛋白含量的检测BioSpec-nano超微量分光光度计以Cy3标记蛋白,可在波长280 nm时测量蛋白质的浓度。准确移取不同级数茶多糖样品溶液4 μL于超微量分光光度计目标位置,以光程0.7 mm、波长280 nm处检测可溶性蛋白质含量。
式中:M醇析为该浓度乙醇沉淀析出的总质量;SP醇析为该浓度乙醇沉淀时可溶性蛋白析出质量。
1.2.4DPPH自由基清除率测定参阅文献[15],准确移取0.1 mmol/L的DPPH溶液3.0 mL于试管中,加入不同级数不同浓度的茶多糖样品液0.5 mL,再用无水乙醇添加至3.0 mL,静置反应30 min,于517 nm处比色测定吸光度数值。DPPH自由基清除率计算公式为:
式中:A对照为未加样品的DPPH自由基吸光度;A样品为加入样品反应后的DPPH自由基吸光度。
1.2.5还原力测定采用普鲁士蓝法,具体步骤如下:取不同级数不同浓度的茶多糖水溶液样品5.0 mL于试管中,依次加入2.0 mL磷酸盐缓冲液(0.2 mol/L,pH6.6)和2.0 mL的1%的铁氰化钾溶液,50 ℃水浴保温反应20 min,快速冷却,加入10%的三氯乙酸溶液2.0 mL,3000 r/min离心10 min,取上清液,加入0.1 mL的0.1%氯化铁溶液,混匀静置10 min,于700 nm处测定吸光度值,以重蒸水作阴性对照。
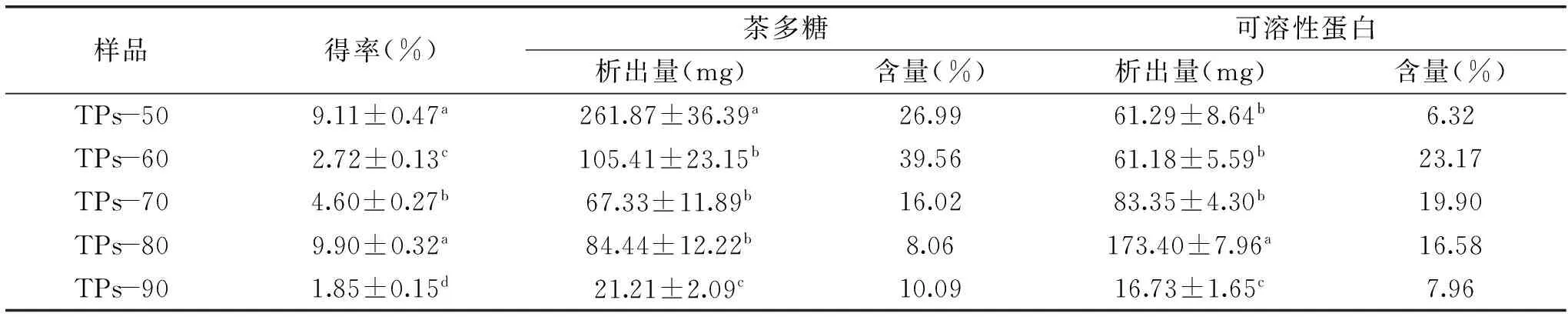
表1 乙醇对茶多糖的分级纯化特性
注:同列中标有不同字母表示差异显著(p<0.05),图3、图4、表2同。
1.2.6茶多酚含量的检测不同级数茶多糖样品TPs-50、TPs-60、TPs-70、TPs-80和 TPs-90的茶多酚含量检测采用GB/T 8313-2008 福林酚法。
1.2.7儿茶素及咖啡因的测定儿茶素及咖啡因的测定采用文献[16]HPLC法。
1.2.8总黄酮含量的检测采用三氯化铝法,分别吸取0.1 mg/mL芦丁标准液(50%乙醇配制)0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL于25 mL容量瓶中,加50%乙醇至总体积10.0 mL,依次加入1.5%的AlCl3溶液8.0 mL和醋酸-醋酸钠的缓冲液(0.1 mol/L,pH5.5)4.0 mL,并用50%乙醇水溶液定容至25 mL,摇匀,静置30 min后,于415 nm比色测定吸光度值。以吸光度值为纵坐标,以显色液中的芦丁质量(mg)为横坐标,绘制标准曲线并计算线性回归方程。准确移取不同级数茶多糖样品液1.0 mL于25 mL容量瓶中,其余步骤按照上述程序添加反应后,415 nm处比色测定。
1.3数据统计与分析
数据分析采用Origin 7.5和Spss 19.0软件。数值表示为平均值±S.E.。
2 结果与分析
2.1乙醇分级纯化茶多糖的特性
乙醇可用于提取纯化茶多糖[17-18]。本文以制备的水提茶多糖粗提物为原料,考察了不同浓度乙醇对茶多糖的沉淀分级效果,结果见表1。50%和80%浓度乙醇对茶多糖的沉淀得率最高,分别为9.11%和9.90%。茶多糖析出量TPs-50最高,为261.87 mg,而TPs-60、TPs-70和TPs-90则显著性降低;而茶多糖含量则以TPs-60最高,为39.56%,TPS-80最低至8.06%。醇沉过程中,可溶性蛋白也相应析出。结果表明,可溶性蛋白析出量与乙醇沉淀浓度相关,80%浓度乙醇分级沉淀时(TPs-80)可溶性蛋白析出量最大至173.40 mg(表1)。
为了进一步优化乙醇沉淀分级茶多糖,研究分析了不同浓度乙醇对茶多糖和可溶性蛋白的沉淀析出比(该级析出量占总析出量的百分比)。如图2所示茶多糖可再析出率依次降低,50%浓度乙醇可沉淀得到总茶多糖量(TPs-50、TPs-60、TPs-70、TPs-80和TPs-90等多糖质量之和)的44.98%,浓度60%、70%和80%时依次降低,而浓度90%时仅沉淀制得茶多糖总量的3.15%。而可溶性蛋白的沉淀析出呈相反的趋势,低浓度乙醇沉淀析出的可溶性蛋白占总量的15%~20%,而80%浓度乙醇沉淀析出可溶性蛋白量最大,为总量的43.82%。综合来看,50%、60%和70%浓度乙醇沉淀分级茶多糖后,80%浓度乙醇再沉淀析出茶多糖效率低,而可溶性蛋白再析出量却占整个析出量的将近一半,证明80%浓度乙醇的再沉淀析出物茶多糖非主要物质。因此,研究认为乙醇沉淀制备茶多糖以70%浓度为宜,茶多糖析出含量高,而可溶性蛋白可析出量较低,这更利于茶多糖后续蛋白质的脱除。
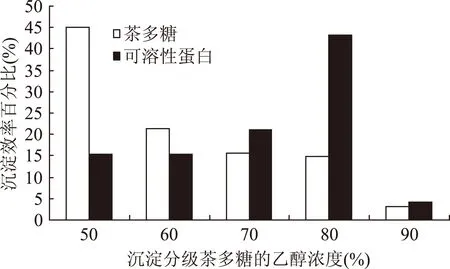
图2 乙醇沉淀茶多糖和可溶性蛋白的浓度效率Fig.2 Concentration efficiency of ethanol in the precipitation of tea polysaccharides and soluble proteins
2.2茶多糖样品的抗氧化活性比较
2.2.1DPPH自由基清除率的变化DPPH自由基因其稳定性好、灵敏度高、操作简便等优点,已广泛应用于自由基清除能力的定量分析。DPPH溶于甲醇或乙醇溶液呈深紫红色,当加入自由基清除剂后,孤对电子被配对,深紫色的DPPH自由基溶液被还原成黄色的非自由基溶液,其褪色程度与所接受的电子数量成定量关系,因而可以通过吸光度的变化反映样品对DPPH自由基的清除率。图3为不同浓度不同级数茶多糖对DPPH自由基的清除率。由图可见,剂量为10 μg/mL和20 μg/mL时,不同级数茶多糖样品DPPH自由基清除率趋势为TPs-50>TPs-60>TPs-70>TPs-80>TPs-90,TPs-50清除DPPH活性最强,TPs-90最弱。同一级数茶多糖样品清除DPPH活性比较来看,高浓度剂量20 μg/mL 高于低剂量10 μg/mL,呈浓度依赖效应。
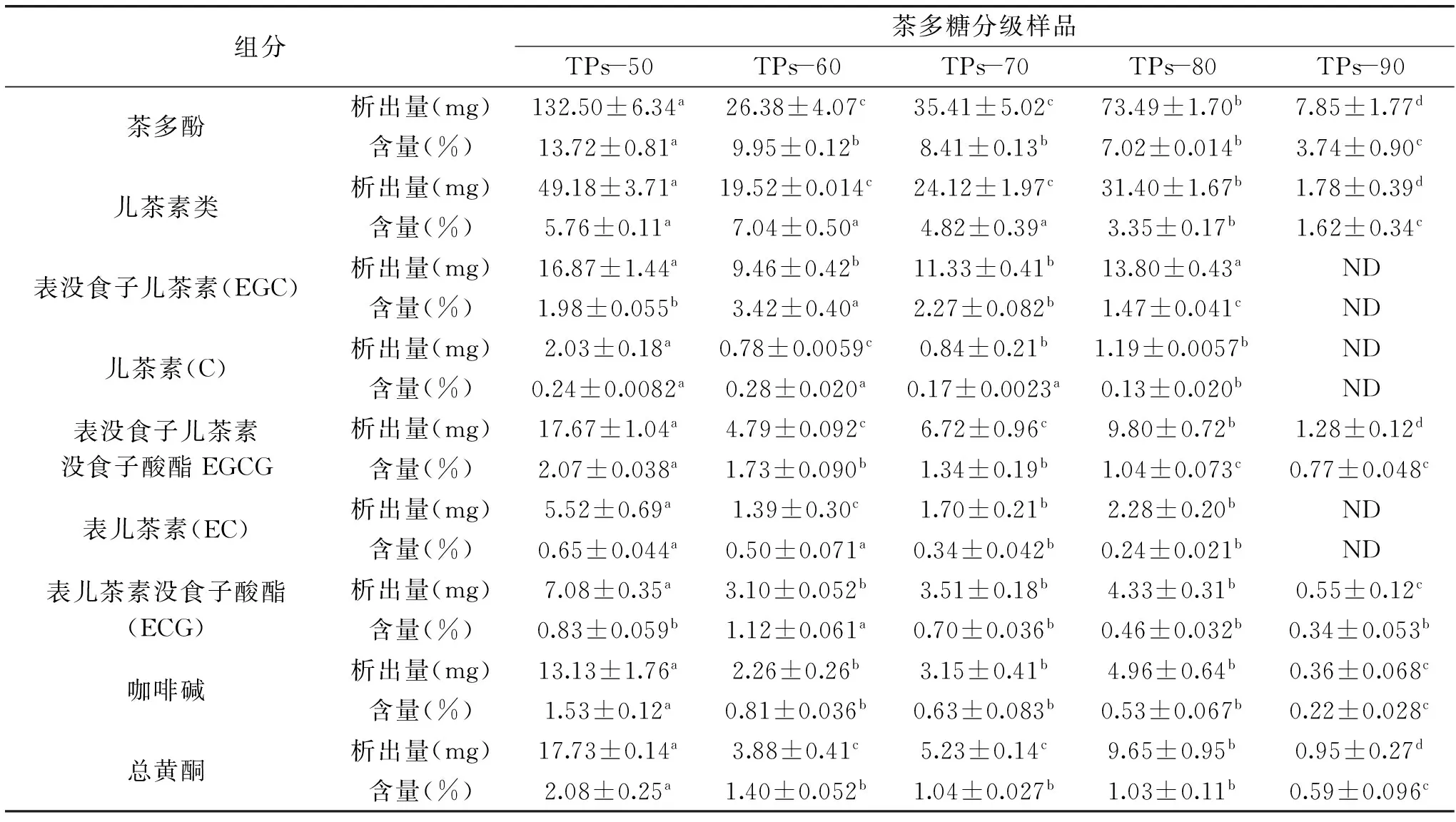
表2 乙醇沉淀分级茶多糖产品中的抗氧化组分

图3 茶多糖对DPPH自由基的清除率变化Fig.3 Effects of tea polysaccharides on the scavenging of DPPH·
注:ND:表示未检测到;儿茶素类指总量,以EGC+C+EGCG+EC+ECG计。2.2.2茶多糖样品的还原力比较抗氧化剂的还原力与其抗氧化性之间呈正相关性,还原力越强,则抗氧化性越强。多采用普鲁士蓝法检测样品的还原力,原理为铁氰化钾[K3Fe(CN)6]在抗氧化剂存在时被还原为黄血盐[K4Fe(CN)6],该盐与Fe3+发生反应生成普鲁士蓝,于700 nm处可见最大吸收峰,其吸光度数值的高低变化可用于反映样品还原力的大小。如图4所示,为不同浓度乙醇沉淀分级的茶多糖样品吸光度数值。结果可知,TPs-50的吸光度值最高,还原力最大,其抗氧化性最强。同时,不同级数的茶多糖样品,还原力呈减弱的态势(TPs-70略高于TPs-60,两者之间未有差异显著性),表明抗氧化性逐步减弱。研究还发现,同一级数的茶多糖样品呈浓度依赖效应,浓度越高,抗氧化性越强。
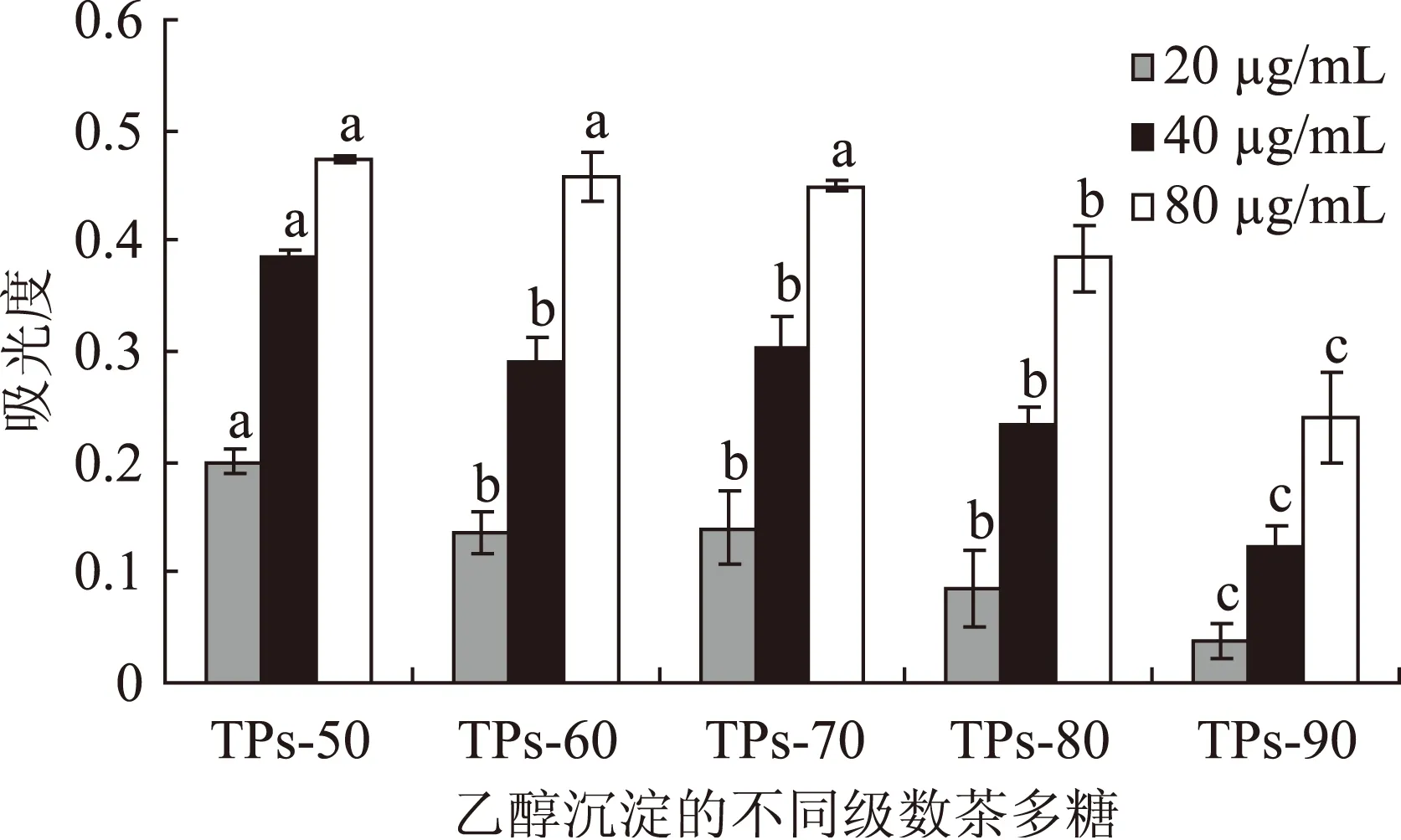
图4 茶多糖样品的还原力变化Fig.4 Reducibility of tea polysaccharides
2.3抗氧化组分分析
如表2所示为乙醇沉淀分级制得茶多糖样品中的其他抗氧化组分变化,包括茶多酚、儿茶素类及单体、总黄酮和咖啡因。结果表明,TPs-50中抗氧化组分析出量最高,与其他组别有显著性差异。比较TPs-60、TPs-70和TPs-80之间,随着乙醇浓度的升高中抗氧化组分析出量逐渐升高,而经过不同浓度乙醇沉淀分级后,TPs-90再沉淀析出抗氧化组分含量显著降低,如茶多酚仅为7.85 mg。分析认为,可能在考虑等同沉淀时间的基础上,影响沉淀析出效果的主要因素为粗茶多糖溶液浓度和乙醇浓度。起始时,50%乙醇沉淀粗茶多糖时溶液中成分处于原始浓度(相当于整个实验的最高水平),导致相应的TPs-50中抗氧化组分析出量最高。随后50%沉淀上清液再次经60%乙醇分级沉淀,依次类推70%和80%浓度的乙醇,抗氧化组分含量逐步降低,乙醇浓度发展为主要影响因素,体现为TPs-60、TPs-70和TPs-80之间抗氧化组分析出量呈递增趋势,至90%乙醇再沉淀80%上清液时,抗氧化组分含量为最低,从而析出量亦显著降低或未析出(简单儿茶素单体)。
乙醇沉淀分级制得茶多糖样品的抗氧化活性表达与其组分息息相关。为此,采用Spss软件就抗氧化组分含量和抗氧化活性表达之间做了相关性分析,结果见表3。结果表明,所有抗氧化组分与其DPPH自由基清除活性和还原力大小之间都具有正相关,不同组分之间体现出差异性。具体为茶多酚、儿茶素单体EC及EGCG、总黄酮和咖啡因呈显著性正相关,而茶多糖、儿茶素总量及其单体EGC、C和ECG则未呈显著性正相关。分析认为,乙醇沉淀分级制得的茶多糖样品抗氧化活性表达并非源于茶多糖的单独作用,而是一种茶多酚、总黄酮、咖啡因和茶多糖的协同效应,这里主要的作用成分为茶多酚(尤其儿茶素单体EC和EGCG)、总黄酮和咖啡因。
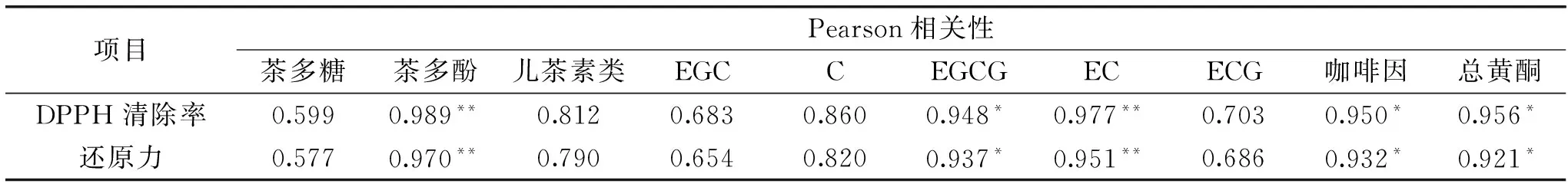
表3 抗氧化组分的相关性分析
注:“*”显著相关,**极显著相关。
3 结论与讨论
茶多糖具有多种保健功效,极具开发应用前景。然而,限于其提取纯化工艺繁杂及生物学活性不一,犹待进一步研究。目前,茶多糖提取纯化技术多采用实验室可行的高效液相色谱法和柱层析法实现其纯化分级,难以用于工业化生产,而利用廉价的乙醇有效提取纯化多糖技术更易实现规模化生产。本文以粗茶多糖提取物为原料,采用不同浓度乙醇进一步分级沉淀纯化,制得不同级数的茶多糖样品TPs-50、TPs-60、TPs-70、TPs-80和TPs-90。如表1所示,TPs-80得率最高,然而茶多糖含量最低且可溶性蛋白析出量最大,进一步分析认为70%浓度乙醇沉淀纯化茶多糖更为适宜。这与学者[17-18]给出的乙醇沉淀茶多糖最佳浓度为80%有所不同,原因在于评价指标的不同,本文在评价产品得率的基础上,注重了茶多糖含量和可溶性蛋白含量的考察,从而更便于茶多糖的后续纯化工作,尤其是茶多糖中蛋白质的脱除。
茶多糖糖链庞大,构象繁杂,生物学活性表现不一。比如,针对其抗氧化性尚存有争议。茶多糖纯度越高,清除自由基能力表现越弱[6-7]。Wang YL等[6]分析比较了粗茶青多糖和纯化茶多糖片段(NTPS、ATPS1、ATPS2和ATPS3)的抗氧化能力,研究表明,25~400 μg/mL浓度范围内粗茶多糖对DPPH自由基清除率为36.58%~86.88%,且呈浓度依赖效应;而同样浓度范围内的纯茶多糖片段DPPH自由基清除率极低,且基本无变化。即使最高剂量400μg/mL处理下NTPS、ATPS1、ATPS2和ATPS3相应的DPPH清除率,也仅为25.51%、23.93%、22.28%和30.60%。从对羟基自由基作用效果来看,亦表明了同样的趋势,纯化茶多糖ATPS1清除羟基自由基能力远弱于粗茶多糖(和维生素C相当)。进一步研究揭示,EGCG可协同增强纯茶多糖的抗氧化能力,400 μg/mL的纯化茶多糖NTPS、ATPS1、ATPS2和ATPS3添加1.51%EGCG后,DPPH自由基清除率提高至76.68%、78.16%、72.13%和74.32%。本文研究结果表明,适宜浓度剂量范围内,不同级数茶多糖抗氧化性表达趋势为逐级降低(图3和图4),这与茶多糖纯度趋势不一致。茶叶富含多种生物学活性成分,诸如茶多酚、黄酮类和咖啡因都具有清除自由基活性[19-20]。本文结果表明,不同浓度的乙醇沉淀分级的茶多糖样品仍为粗茶多糖,含量最高为TPs-60,达39.56%(表1)。茶多糖样品中,其他抗氧化活性成分如茶多酚、儿茶素类、总黄酮和咖啡碱皆有析出,以TPs-50中析出量和含量最高(表2)。相关性分析表明(表3),各抗氧化组分与茶多糖样品抗氧化活性表达之间Pearson系数呈正相关性,变化趋势为茶多酚>总黄酮和咖啡因>茶多糖,显著性正相关的抗氧化组分为茶多酚(尤其是儿茶素单体EC和EGCG)、总黄酮和咖啡因,揭示该类粗茶多糖样品中抗氧化活性表达,茶多糖作用效果弱于其他抗氧化组分,这也证实了Wang YL等[6]人的研究结果。通过相关性分析还表明,茶多酚与茶多糖样品的抗氧化活性表达之间呈极显著正相关(p<0.01),而儿茶素类作为茶多酚的主体活性成分,却未体现出显著性正相关。进一步分析主要儿茶素类单体发现,EGCG和EC呈显著正相关性,揭示不同儿茶素类单体作用效果不同。结合Wang YL等[6]人揭示EGCG可协同增强纯茶多糖的抗氧化能力,是否不同儿茶素类单体都存在不同的协同增强效果,如EC作用效果如何,还犹待进一步研究证实。
综上所述,不同浓度乙醇分级沉淀的茶多糖样品抗氧化性表达趋势为TPs-50>TPs-60>TPs-70>TPs-80>TPs-90,逐级降低,其抗氧化性表达源于茶多糖、茶多酚/儿茶素类和黄酮类的协同作用。从茶多糖和可溶性蛋白含量分析,70%浓度乙醇更适宜于沉淀制备茶多糖,可溶性蛋白等大分子物质含量低且抗氧化性强。
[1]Nie S P,Xie M Y. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids, 2011,25(2):144-149.
[2]Cao H. Polysaccharides from Chinese tea:recent advance on bioactivity and function[J]. International Journal of Biological Macromolecules, 2013,62:76-79.
[3]聂少平,谢明勇,罗珍. 用清除有机自由基DPPH法评价茶叶多糖的抗氧化活性[J]. 食品科学,2006,27(3):34-36.
[4]Chen H X,Qu Z S,Fu L L,et al. Physicochemical properties and antioxidant capacity of 3 polysaccharides from green tea,oolong tea and black tea[J]. Journal of Food Science,2009,74(6):C469-474.
[5]Chen H X,Wang Z S,Qu Z S,et al. Physicochemical characterization and antioxidant activity of a polysaccharideisolated from oolong tea[J]. European Food Research and Technology,2009,229(4):629-635.
[6]Wang Y L,Zhao Y,Marobela K A,et al. Tea polysaccharides as food antioxidants:an old women’s tale?[J]. Food Chemistry,2013,138(2-3):1923-1927.
[7]王黎明,夏文水. 茶多糖降血糖机制的体外研究[J]. 食品与生物技术学报,2010,3:354-358.
[8]倪德江,陈玉琼,谢笔钧,等. 乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究[J]. 高等学校化学学报,2004,25(12):2263-2268.
[9]江和源,陈小强,寇小红,等. 茶多糖的分级纯化及组成分析[J]. 茶叶科学,2007,27(3):248-252.
[10]Cai W R,Xie L L,Chen Y,et al. Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J]. Carbohydrate Polymers,2013,92(2):1086-1090.
[11]张宁,武永福. 黄花菜粗多糖梯度乙醇提取工艺及其抗氧化活性研究[J]. 中国食物与营养,2014,20(11):60-62.
[12]姚秋萍,姚芝荣. 马齿苋多糖的乙醇分级纯化及抗氧化研究[J]. 安徽农业科学,2013,41(8):3656-3658.
[13]李卷梅,聂少平,李景恩,等. 香薷多糖的乙醇分级纯化及其性质[J]. 食品科学,2010,31(19):182-185.
[14]王忠雷,杨丽燕,曾祥伟,等. 新技术在中药多糖提取工艺中的单独及协同应用[J]. 世界科学技术-中医药现代化,2013,15(6):1441-1446.
[15]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J]. 食品科学,2014,35(9):317-322.
[16]王丽丽,陈键,宋振硕,等. 茶叶中没食子酸、儿茶素类和生物碱的HPLC检测方法研究[J]. 福建农业学报,2014,29(10):987-994.
[17]任健,杨志宏,刘钟栋. 醇沉法提取茶多糖的研究[J]. 山东食品发酵,2004,132(1):33-35.
[18]李碧婵,马森. 武夷岩茶中茶多糖的提取研究[J]. 南平师专学报,2007,26(2):40-42.
[19]Frei B,Higdon J V. Antioxidant activity of tea polyphenolsinvivo:evidence from animal studies[J]. The Journal of Nutrition,2003,133(10):3275S-3284S.
[20]Cotelle N,Bernier J L,Catteau J P,et al. Antioxidant properties of hydroxyl-flavones[J]. Free Radical Biology and Medicine,1996,20(1):35-43.
Comparison of the antioxidant activity of tea polysaccharide samples by precipitation fractionation with ethanol and the related mechanism analysis
YANG Jun-guo,CHEN Jian,WANG Li-li,SONG Zhen-shuo,CHEN Lin*
(Tea Research Institute,Fujian Academy of Agricultural Science,Fu’an 355015,China)
Setting five different concentrations of ethanol(50%,60%,70%,80% and 90%)to obtain the precipitation fractionation of crude tea polysaccharide(TPs)extracts,namely TPs-50,TPs-60,TPs-70,TPs-80 and TPs-90,then the characteristics of precipitation fractionation with ethanol for tea polysaccharides and the expression of antioxidant activity were investigated. The results showed that the yields of TPs-50 and TPs-80 were higher than 9%,and TPs content trend was TPs-60>TPs-50>TPs-70>TPs-90>TPs-80. In TPs-80,TPs content was 8.06%,14.76% of all TPs precipitation. Furthermore,TPs-80 contained the soluble protein 43.82% of all precipitation. Antioxidant activity results showed the order of DPPH· scavenging ability were TPs-50>TPs-60>TPs-70>TPs-80>TPs-90 and so was the reducing power,which were different from the results of TPs content. Antioxidant components,including TPs,tea polyphenols,catechins,total flavone and caffeine,were precipitated in TPs samples,and highest in TPs-50. Besides TPs,the precipitation of other antioxidant components were increased gradually among TPs-60,TPs-70 and TPs-80,and lowest in TPs-90. The correlation to the antioxidant activity of tea polyphenols,total flavone and caffeine were significantly positive,and stronger than TPs,which indicated the synergy effects of TPs and other antioxidant compositions in TPs samples.
tea polysaccharides;ethanol;components;antioxidation
2016-02-26
杨军国(1980-),男,博士,主要从事茶叶生物化学与综合利用,E-mail:95711139@qq.com。
陈林(1975-),男,博士,副研究员,主要从事茶叶加工、茶叶生物化学与综合利用,E-mail:82785676@qq.com。
福建省农业科学院科技创新团队项目(CXTD-1-1302);福建省自然科学基金项目(2015J05057);福建省农业科学院“青年科技英才百人计划”项目(YC2015-8);福建省农业科学院茶叶研究所重点项目(2014-cys-03)。
TS272.4
A
1002-0306(2016)17-0096-06
10.13386/j.issn1002-0306.2016.17.010

