新疆家蚕抗菌肽在酿酒酵母中表达的实时监测及活性分析
刘东亮,刘 军,张富春
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆乌鲁木齐 830046)
新疆家蚕抗菌肽在酿酒酵母中表达的实时监测及活性分析
刘东亮,刘军,张富春*
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆乌鲁木齐 830046)
本研究对新疆家蚕抗菌肽在酿酒酵母INVSc1菌株中分泌表达过程进行了实时监测及活性测定。结果表明,选择培养基中酵母表现为典型的S型生长曲线;诱导培养基中酵母表现为波浪式缓慢上升的曲线,上升的时间和速度与酵母的初始接菌密度有关。诱导过程补加少量20%半乳糖诱导剂可以明显抑制酵母的生长,同时,酵母细胞平板计数结果也表明补加半乳糖使酿酒酵母出芽增殖减缓,菌落计数减少。研究发现诱导过程补加半乳糖不仅可以使发酵液中总蛋白的含量提高约50%,还可以使酵母分泌蛋白的时间提前。抗菌实验表明,抗菌肽对大肠杆菌抑菌效果较好,发酵液上清对大肠杆菌的最大抑菌圈直径为52 mm;对金黄色葡萄球菌的抑菌活性较弱,最大抑菌圈直径为20 mm。
新疆家蚕抗菌肽,酿酒酵母,蛋白表达,抑菌活性
抗菌肽(Antimicrobial peptides,AMPs)是生物体内经诱导产生的一类具有生物活性的小分子多肽,作为抵御病原体入侵的第一道防线,是生物体天然免疫系统的重要组成部分[1-4]。通常所说的抗菌肽一般为阳离子抗菌肽(Cationic antimicrobial peptides,CAMPs),由12~50个氨基酸组成,带有2个以上的正电荷以及50%左右的疏水氨基酸组分[5]。家蚕抗菌肽是世界上第一个被分离鉴定的抗菌肽,1980年由Hultmark等[6-7]从惜古比天蚕的蚕蛹中分离得到,并将其命名为cecropin。截至2016年5月,国际权威抗菌肽数据库APD(http://aps.unmc.edu/AP/main.php)共收录了世界范围内2706条抗菌肽,它们大多具有抗细菌、抗真菌、抗病毒、抗肿瘤、抗寄生虫等多种生物活性[8-9]。
新疆家蚕抗菌肽(CecropinXJ),属于cecropin B家族,是一种典型的两亲性α-螺旋阳离子抗菌肽,其分子量约为4080 u,由37个氨基酸残基组成[10]。新疆家蚕抗菌肽基因cecropinXJ首先由李金耀等[11]从新疆家蚕品种新蚕三号组织中经反转录PCR(RT-PCR)的方法获得,并构建到原核表达载体,在大肠杆菌BL21细胞中成功表达。此外cecropinXJ基因被刘忠渊[12-13]、夏丽洁[14]等构建到真核表达载体并分别在毕赤酵母和酿酒酵母中高效表达,表达产物具有较好的抗细菌、耐高温、耐高盐、耐酸碱,以及低溶血等生物活性。
酵母系统表达抗菌肽的优势在于其不仅可以使抗菌肽进行分泌表达,利于后期的分离纯化,还可以在抗菌肽表达后对其进行翻译后加工、糖链合成[13]以及羧基端酰胺化[15]等修饰工作,最大程度保留了抗菌肽自身的理化特性。本研究利用酿酒酵母INVSc1菌株分泌表达CecropinXJ,探讨了发酵种子接种密度以及发酵过程增补诱导剂对抗菌肽发酵以及酵母自身生长的影响,为新疆家蚕抗菌肽发酵条件的优化和工业生产提供参考资料。
1 材料与方法
1.1材料与仪器
pYES2/CT/αFactor-cecropinXJ家蚕抗菌肽重组表达质粒以及含有该重组质粒的酿酒酵母INVSc1株由本实验室构建保藏[14];大肠杆菌EscherichiacoliDH5α和金黄色葡萄球菌Staphylococcusaureus测试菌株本实验室保藏。SD选择培养基(尿嘧啶缺陷型,Ura-),诱导培养基(Ura-)培养基均购自Clontech公司;BCA Protein Assay Kit购自TIANGEN公司;96微孔ELISA板购自JET BIOFIL公司;其他生化试剂均为国产分析纯。
牛津杯(6 cm×8 cm×10 mm)东台市吉泰不锈钢制品厂;Benchmark Plus微孔板分光光度计BIO-RAD公司;SORVALL LYNX 6000高速离心机Thermo Scientific公司;ZHWY-111C恒温培养振荡器上海智城分析仪器制造有限公司;GNP-9050型隔水式恒温培养箱上海精宏实验设备有限公司;-80 ℃超低温冰箱SANYO公司。
1.2实验方法
1.2.1酵母培养根据invitrogen公司酵母实验手册进行酵母的培养及诱导[16]。取-80 ℃保存的含有pYES2/CT/αFactor-cecropinXJ重组质粒的酿酒酵母INVSc1菌种在固体选择培养基(Ura-)上划线,30 ℃恒温培养箱培养48 h。挑取酵母单克隆接种于15 mL液体选择培养基中(Ura-),30 ℃恒温振荡培养30 h。将酵母培养物接种于50 mL的诱导培养基中(Ura-),30 ℃恒温振荡过夜培养,1500×g离心10 min,弃上清。将收集的酵母细胞重悬于100 mL新鲜的诱导培养基中(Ura-),并调整酵母细胞在培养基中的光密度值(OD600)为0.4和0.8各2瓶,30 ℃恒温培养振荡器培养136 h。培养至36 h时,分别在1#和3#酵母培养体系中补加少量20%无菌半乳糖溶液;培养至92 h时,1#,2#,3#,4#酵母培养体系均补充加入少量的20%无菌半乳糖溶液。
1.2.2酵母生长曲线的测定采用紫外分光光度计法测定酵母悬液OD值并绘制酵母的生长曲线[17]。取酵母单克隆接种于液体选择培养基(Ura-),30 ℃恒温振荡培养30 h,每隔3 h取酵母培养物测定OD600光密度值,绘制酵母生长曲线。将酵母培养物接种于诱导培养基,为了研究起始接菌密度对酵母又到表达时间的影响,调整酵母细胞在培养基中的光密度值(OD600)分别为0.4和0.8[16],30 ℃恒温振荡培养进行诱导表达,分别收集0,2,4,8,12,16,20,24,28,32 h酵母培养物测定OD600光密度值,绘制抗菌肽诱导阶段的酵母生长曲线。
1.2.3酵母计数采用倍比稀释法进行平板菌落计数[18-19]。取诱导时间为0,4,12,24,36,44,68 h的酵母培养物,分别用诱导培养基(Ura-)稀释10-3,10-4和10-5不同倍数,取10 μL稀释液滴加到固体选择培养基(Ura-)上,置于30 ℃恒温培养箱培养48 h后进行菌落计数,每个稀释梯度计数3次。
1.2.4发酵液蛋白质含量的测定分别取诱导时间为0,2,4,8,12,16,20,24,28,32,36,40,44,52,68,76,84,92,100,112,124,136 h的酵母发酵液1 mL,1500×g离心10 min,收集上清。用BCA法[20]测定不同诱导时间发酵液中总蛋白在562 nm处吸光度。
1.2.5发酵液抑菌活性的测定分别取诱导时间为0,4,12,36,52,76 h的酵母发酵液1 mL,1500×g离心10 min,收集上清,用0.22 μm的无菌滤膜进行过滤。采用牛津杯抑菌圈法[21]检测不同发酵时期发酵液中抗菌肽对E.coliDH5α和S.aureus细菌的抑制效果,每个牛津杯中加入100 μL滤出液。
1.2.6数据分析实验数据以Mean±SD表示(n=4),采用单因素方差分析,所有统计计算均采用GraphPad Prism 6(version 6.01)统计学软件进行分析,p<0.05认为具有统计学意义。
2 结果与分析
2.1诱导前后酵母细胞生长情况的监测
挑取4个酿酒酵母单克隆,分别在15 mL选择培养基中振荡培养30 h,对酵母不同生长阶段的菌体密度进行分光光度计测定,并绘制了酵母的生长曲线图,实验结果见图1。由图1可知,0~6 h为延滞期,6~27 h为对数生长期,27 h时培养物在600 nm处的吸光值达到最大,OD600为1.1。尽管酿酒酵母的生殖方式属于出芽生殖,不同于细菌的二分裂繁殖,但本研究中检测到的酿酒酵母INVSc1菌株的生长曲线类似于细菌典型的S2型曲线。
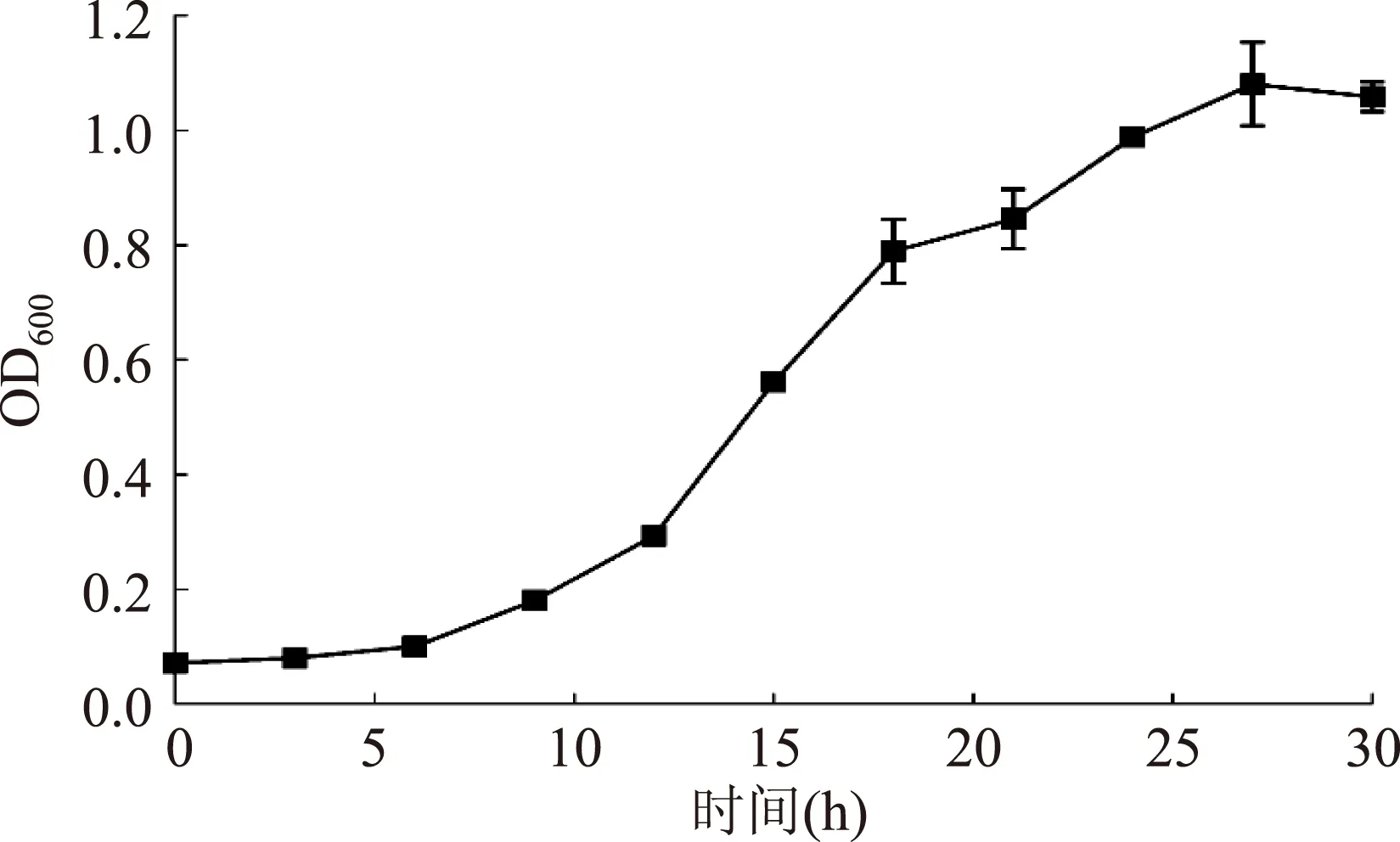
图1 酿酒酵母在选择培养基中的生长情况(n=4)Fig. 1 The growth curve of Saccharomyces cerevisiae INVSc1 strain in selective medium(n=4)
将选择培养基中生长的酿酒酵母接种于诱导培养基。酵母细胞在诱导培养基中的初始浓度OD600分别设定为0.4和0.8两个水平,比较诱导过程初始菌体浓度对抗菌肽发酵的影响。选取0,2,4,8,12,16,20,24,28,32,36,40,44,52,68,76,84,92,100,112,124,136 h时间点,对酿酒酵母在诱导培养基中的生长情况进行了监测,结果见图2。由图2可知,酿酒酵母在诱导过程中菌体密度增大。当初始光密度值为0.8时,3#和4#酵母培养物24 h后菌体密度开始明显增加;当OD600为0.4时,1#和2#酵母培养物培养52 h后菌体密度才开始缓慢增加。整体而言,酵母光密度值增加水平不如在选择培养基中增加明显,为了说明诱导过程是否影响了酵母的增殖,分别在1#和3#单克隆菌株培养至36 h时补充加入少量20%无菌半乳糖溶液,结果发现,与加入等量无菌水的2#和4#单克隆菌株相比,半乳糖的加入明显降低了酵母的吸光值。当培养至92 h时,1#,2#,3#,4#酵母培养体系均补充加入少量的20%无菌半乳糖溶液,随后4个培养体系中的酵母光密度值均发生了明显降低。这些结果表明诱导过程影响了酵母细胞的增殖。

图2 酿酒酵母在诱导培养基中的生长情况Fig.2 The growth curve of Saccharomyces cerevisiae INVSc1 strain in induction medium注:1#,2#,3#,4# 代表来源于不同的酵母单克隆。
2.2发酵液中酵母细胞数目的监测
为了直观反映诱导培养基中酵母生长情况的变化,对不同诱导时间的发酵液稀释不同倍数,在四分区的培养板上进行酵母细胞计数。选择对1#和4#培养体系中的细胞分别进行计数,酵母在平板上的生长情况见图3和图4,菌落计数数据见图5。

图3 1#酿酒酵母在不同诱导时间的菌落计数Fig.3 The colony counting of Saccharomyces cerevisiae 1# at different induction periods注:0,4,12,24,36,44,68代表不同诱导时间(h);10-3,10-4,10-5代表稀释倍数,图4同。

图4 4#酿酒酵母在不同诱导时间的菌落计数Fig.4 The colony counting of Saccharomyces cerevisiae 4# at different induction periods
如图3和图4所示,当稀释度为10-3时,仍可以看到固体培养基生长了大量的酵母单克隆,不利于细胞计数;当稀释度为10-4和10-5,可以清晰地分辨固体培养基生长的酵母单克隆,利于酵母细胞计数。分别对1#和4#培养体系稀释度为10-4和10-5的酵母发酵液进行平板计数(表1所示),并绘制了不同诱导时间的菌落数变化曲线图,结果见图5。图5显示,当稀释度为10-4时,诱导4 h,1#培养体系中酵母细胞的数目增多,4#培养体系中酵母细胞的数目明显减少;4~68 h内的计数结果显示,1#培养体系中酵母细胞的数目先减少,后维持大致一致,4#培养体系中酵母细胞的数目呈现缓慢增加的趋势,这与图2中相同时间段内反映的结果一致。

图5 酿酒酵母在不同诱导时间的菌落数变化折线图Fig.5 The counting curve of Saccharomyces cerevisiae at different induction periods注:1#,4#代表来源于不同的酵母单克隆;10-4,10-5代表稀释倍数。
2.3发酵液中总蛋白含量的监测
与非诱导培养相比,诱导过程中酵母细胞生长受限,数目缓慢增加,表明其细胞内的代谢过程发生了微妙的变化。诱导过程中,蛋白质的表达是酵母细胞的主要生命活动。因此,本研究用BCA法分别对1#,2#,3#,4#酵母培养体系的总蛋白含量进行了连续监测绘成曲线,如图6所示,2#培养体系中总蛋白的含量在52 h之后才出现明显增加;4#培养体系总蛋白含量在36 h后就出现明显增加,这可能与两种培养体系中初始酵母光密度值不同有关。尽管1#和3#两种培养体系的初始酵母光密度值也不同,但二者总蛋白的含量在36 h之后都发生了非常显著增加,表明半乳糖的补充使酵母分泌蛋白的时间提前。40 h时,1#和3#两种培养体系总蛋白在562 nm的吸光值几乎比36 h时增加了50%,这种增加趋势一直持续到70 h左右才出现降低,这与1#和3#培养体系在36 h补充加入少量半乳糖诱导剂有关。同时注意到,补充诱导剂的效应远大于初始酵母光密度值差异的效应。所以尽管1#和3#培养体系初始酵母光密度值存在差异,但在同时补充半乳糖后,二者总蛋白含量被提升到了同样高的水平。类似地,在92 h第二次补加半乳糖以后,四个培养体系中总蛋白质的含量又出现了反弹上升。
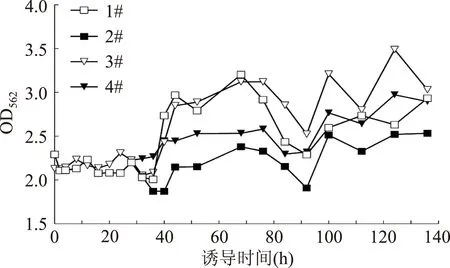
图6 酵母诱导过程中发酵液总蛋白含量变化情况Fig.6 Evaluation of the protein content in medium during induction periods注:1#,2#,3#,4# 代表来源于不同的酵母单克隆。
2.4发酵液抗菌活性的监测
本研究对新疆家蚕抗菌肽酵母发酵液的抗细菌活性进行了测定,测试菌株为常见的革兰氏阴性菌E.coli和革兰氏阳性菌S.aureus。结果如图7所示,不同诱导时间的抗菌肽发酵液对E.coli均具有明显的抑菌活性,0,4,36,44,68、76 h的抑菌圈较大,其中0 h抑菌圈可能与抗菌肽本底表达有关;抗菌肽发酵液对S.aureus的抑菌活性没有对E.coli的抑菌活性高,仅44,68、76 h的诱导发酵液显示出较大的抑菌圈,这可能与发酵液中抗菌肽的有效浓度以及S.aureus对抗菌肽的敏感度有关。抑菌圈直径大小见图8。

图7 酵母发酵液上清对不同细菌抑菌效果的评价Fig.7 The antimicrobial effects of fermentation liquor on E.coli and S.aureus注:0,4,12,24,36,44,68,76代表不同诱导时间发酵液(h)。
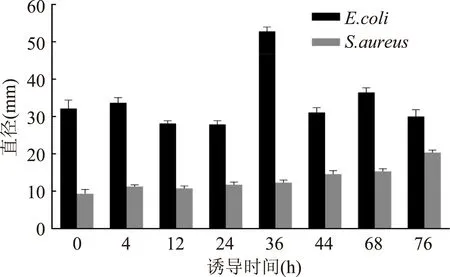
图8 不同诱导时间酵母发酵液上清的抑菌圈柱形图Fig.8 The inhibitory zone of fermentation liquor on E.coli and S.aureus
3 结论
微生物的生长、发酵及代谢产物的积累受到培养基类型、诱导剂、温度、通气量、培养时间等诸多非生物因素的影响[22]。前期研究,夏丽洁等[14]对酿酒酵母系统表达Cecropin XJ进行了优化及摇瓶培养,本研究在此基础上进一步讨论了酵母初始接种量以及诱导过程中补加诱导剂对酵母生长和抗菌肽发酵的影响,以期为酵母培养和Cecropin XJ的发酵生产提供参考。
首先对酿酒酵母生产菌株INVSc1在不同培养基中的生长情况进行了实时监测,初步掌握了酵母在不同生产阶段的增殖情况;然后对发酵阶段不同时期的酵母数目进行了平板菌落计数。酵母在发酵过程中,细胞机能常会出现退化、增殖力下降、自溶等现象,造成酵母数量的减少[23];另一方面抗菌肽表达并分泌到培养基中,随着时间的延长以及抗菌肽的积累很可能对酵母细胞也产生一定的毒害作用,因此造成发酵阶段酵母细胞的生长过程受到抑制[24]。另外,发酵液中总蛋白的含量并不是在诱导一开始就快速增加,而是在经过一段调整期之后才开始增加,本研究发现初期酵母接菌量的多少直接影响到调整期的长短,初始接种密度为0.8比接种密度0.4的调整期缩短近16 h(图6)。诱导期间随着时间的延长,诱导剂被不断消耗,抗菌肽的发酵也会受到影响。因此,本研究讨论了诱导过程补加诱导剂的作用,我们发现补加诱导剂不仅可以缩短调整期,还可以有效促进酵母细胞的蛋白表达和分泌,补加诱导剂后可以使抗菌肽的高效表达维持30 h(图6)左右,所以诱导过程中补加一定量的半乳糖诱导剂十分必要,如果发酵时间较长,建议30 h补加一次半乳糖。
[1]Zasloff M. Antibiotic peptides as mediators of innate immunity[J]. Current Opinion in Immunology,1992,4(1):3-7.
[2]Andreu D,Rivas L. Animal antimicrobial peptides:an overview[J]. Biopolymers,1998,47(6):415-433.
[3]Hancock REW,Sahl HG. Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies[J]. Nature Biotechnology,2006,24(12):1551-1557.
[4]Yeung ATY,Gellatly SL,Hancock REW. Multifunctional cationic host defence peptides and their clinical applications[J]. Cellular and Molecular Life Sciences,2011,68(13):2161-2176.
[5]Hancock REW,Scott MG. The role of antimicrobial peptides in animal defenses[J]. Proceedings of the National Academy of Sciences,2000,97(16):8856-8861.
[6]Hultmark D,Steiner H,Rasmuson T,et al. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalophoracecropia[J]. European Journal of Biochemistry,1980,106(1):7-16.
[7]Steiner H,Hultmark D,Engström A,et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature,1981,292(5820):246-248.
[8]Wang Z,Wang G. APD:the antimicrobial peptide database[J]. Nucleic Acids Research,2004,32(suppl 1):D590-D592.
[9]Wang G,Li X,Wang Z. APD2:the updated antimicrobial peptide database and its application in peptide design[J]. Nucleic Acids Research,2009,37(suppl 1):D933-D937.
[10]Xia LJ,Zhang FC,Liu ZY,et al. Expression and characterization of cecropinXJ,a bioactive antimicrobial peptide fromBombyxmori(Bombycidae,Lepidoptera)inEscherichiacoli[J]. Experimental and Therapeutic Medicine,2013,5(6):1745-1751.
[11]李金耀,张富春,马正海. 家蚕天蚕素cDNA原核表达及抗菌活性检测[J]. 昆虫学报,2004,47(3):407-411.
[12]刘忠渊,张富春,蔡伦,等. 酵母菌中表达的新疆家蚕抗菌肽(Cecropin-XJ)的特性研究[J]. 微生物学报,2003,43(5):635-641.
[13]刘忠渊,张富春,赵干,等. 新疆家蚕抗菌肽(Cecropin-XJ)在Pichiapastoris中的表达[J]. 新疆大学学报:自然科学版,2003,20(4):418-421.
[14]Xia LJ,Liu ZY,Ma J,et al. Expression,purification and characterization of cecropin antibacterial peptide fromBombyxmoriinSaccharomycescerevisiae[J]. Protein Expression and Purification,2013,90(1):47-54.
[15]Callaway JE,Lai J,Haselbeck B,et al. Modification of the C terminus of cecropin is essential for broad-spectrum antimicrobial activity[J]. Antimicrobial Agents and Chemotherapy,1993,37(8):1614-1619.
[16]Invitrogen. pYES2/CT,pYES3/CT,and pYC2/CT. Yeast expression vectors with C-terminal tags and auxotrophic selection markers. 2003,Invitrogen. http://tools.thermofisher.com/content/sfs/manuals/pyes2ctpyes3ctpyc2ct_man.pdf.
[17]马勇,季祥,蔡禄. 2种测定产油酵母菌生长曲线方法的比较[J]. 安徽农业科学,2011,39(14):8202-8203.
[18]李坡,谷守芹,杨阳,等. 拟南芥MPK3、MPK4、MPK6在酵母hog1Δ中的渗透调节作用[J]. 中国农业学报,2012,45(7):1418-1424.
[19]冯金荣. 白念珠菌CaPTC2,CaPPH3和CaPTC5基因的鉴定和功能研究[D]. 天津:天津大学,2010:23.
[20]彭智,安云庆. pPICZα-LL37-Fcγ1重组质粒的构建及其在毕赤酵母GS115中的表达[J]. 细胞与分子免疫学杂志,2007,23(10):969-972.
[21]Vesterdal J. Studies on the inhibition zones observed in the agar cup method for penicillin assay[J]. Acta Pathologica et Microbiologica Scandinavica,1946,24(3-4):272-282.
[22]沈娟,陆兆新,别小妹,等.Bacillussp. fmbJ224发酵产新型抗菌肽发酵条件的优化研究[J]. 食品与发酵工业,2010,36(2):123-127.
[23]杨丽华. 改善酵母的生存环境,减少酵母死亡及自溶[J]. 酿酒,2008,35(3):58-59.
[24]徐进署,张双全,闫晓梅,等. 抗菌肽CM4对酿酒酵母原生质体再生抑制作用的研究[J]. 微生物学通报,2001,28(3):56-59.
Real-time monitoring the Cecropin XJ expression inSaccharomycescerevisiaeand evaluation of antibacterial activity
LIU Dong-liang,LIU Jun,ZHANG Fu-chun*
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046,China)
In the present study,the expression process of Cecropin XJ in INVSc1 strain ofSaccharomycescerevisiaewas real-timely monitored. Firstly,the growth states of yeast in SD selective medium(Ura-)and induction medium were measured,respectively. The result showed that a sigmoid growth curve and a wave-like rising curve were respectively observed in selective medium and induction medium. During the induction process,the rising rate of growth curve was related to the cell density at the beginning of induction. Furthermore,the growth of yeast was obviously suppressed after refilling some 20% galactose in induction culture. Similarly,the plate colony-counting assay indicated that galactose supplement lead to the decrease of yeast proliferation and colony numbers during the induction phase. Additionally,galactose supplement not only increased the protein content by 50% in the culture,but accelerated the protein secretion from yeast. The antibacterial assay revealed that the expression product exerted a significantly bactericidal ability againstE.coliwith the biggest inhibitory zone diameter of 52 mm,and a weak ability againstS.aureuswith a inhibitory zone diameter of 20 mm.
Cecropin XJ;Saccharomycescerevisiae;protein expression;antimicrobial activity
2016-03-01
刘东亮(1984-),男,博士研究生,研究方向:新疆家蚕抗菌肽,E-mail:biove1986@126.com。
张富春(1962-),男,博士,教授,研究方向:新疆生物资源的开发及利用,E-mail:zfcxju@qq.com。
新疆维吾尔族自治区高新技术研究和发展项目(201110101);新疆生物资源基因工程重点实验室开放基金(XJDX0201-2014-02)。
TS201.1
A
1002-0306(2016)17-0129-05
10.13386/j.issn1002-0306.2016.17.016

