干酪可食性涂膜保鲜剂配比的研究
刘 敏,赵 浩,范贵生
(内蒙古农业大学,内蒙古呼和浩特 010018)
干酪可食性涂膜保鲜剂配比的研究
刘敏,赵浩,范贵生*
(内蒙古农业大学,内蒙古呼和浩特 010018)
为研究开发可食用干酪保鲜剂,以酪蛋白酸钠为基材,添加天然抑菌材料构成基液,在此基础上分别对单一添加纳他霉素和溶菌酶的基液进行了抑菌效果的对比,供试菌为大肠杆菌、金黄色葡萄球菌、假单胞菌、酵母菌和霉菌。同时对混合添加纳他霉素和溶菌酶的基液的抑菌效果进行了研究并对其配比进行优化。结果表明:单一添加纳他霉素的抑菌保鲜液对霉菌和酵母菌的抑菌性随其用量增加而增强,而且不同用量之间均存在显著差异(p<0.05),对金黄色葡萄球菌、假单胞菌的抑菌效果呈先增加后减小,而对大肠杆菌的抑菌作用在不同用量之间不存在显著差异(p>0.05);单一添加溶菌酶的抑菌保鲜液对酵母菌的抑制作用较强(p<0.05),对其它菌种抑菌圈小于12 mm。运用响应面优化法以吸光值增量为指标对壳聚糖、那他霉素、溶菌酶混合添加的的配比进行优化,结果表明:那他霉素0.07 g/100 mL基液、溶菌酶1.0 g/100 mL基液,所得吸光值增量达到最小值为1.225,且壳聚糖与那他霉素和壳聚糖与溶菌酶之间存在显著的交互作用(p<0.05),那他霉素和溶菌酶交互作用不显著(p>0.05),并在此配比下的抑菌圈直径分别是大肠杆菌13.67 mm,金黄色葡萄球菌14.33 mm,假单胞菌15.66 mm,酵母菌18.00 mm和霉菌17.76 mm。
可食性,复合保鲜剂,抑菌效果,响应面
契达干酪的消费市场很大,深受我国消费者青睐,目前全球的干酪生产总量近2000万吨[1]。契达干酪属于硬质干酪,其结构紧密,质地柔软,水分含量较大,因此极不容易储藏,在后成熟过程中容易被微生物污染,造成干酪腐败变质甚至影响消费者的健康[2]。一些病原菌例如单增李斯特菌、沙门氏菌、大肠杆菌等还会导致严重疾病和死亡[3-4]。还有一些微生物如假单胞菌、酵母菌、霉菌还会对干酪的风味,质地,感官等性状造成影响而降低其经济价值[5]。随着干酪消费市场的逐渐扩大,提高防腐措施迫在眉睫,目前利用单一或复合保鲜液涂覆或浸渍处理干酪是国外研究较多的方法,在我国干酪保鲜剂抑菌包装市场的研究比较鲜见。
本文就针对干酪易被微生物污染问题研制一种可食性抑菌保鲜液,实验是以酪蛋白酸钠、壳聚糖为基材,甘油为增塑剂,纳他霉素和溶菌酶为抑菌剂,在单因素的基础上测定纳他霉素、溶菌酶分别对大肠杆菌、金黄色葡萄球菌、假单胞菌、酵母菌和霉菌的抑菌性,并通过响应曲面法优化对干酪保鲜效果较好的2种保鲜剂的配比,分析壳聚糖、纳他霉素、溶菌酶之间的协同作用和拮抗作用,为干酪保鲜提供参考。
1 材料与方法
1.1材料与仪器
契达干酪实验室自制,真空包装成熟两个月以上。
酪蛋白酸钠东京化成工业株式会社;壳聚糖食品级,脱乙酰度≥90%,干燥质量损失率≤8.0%;甘油河南滨海实业有限责任公司;冰乙酸北京金辉通业化工公司;纳他霉素内蒙古泽生试剂有限公司;溶菌酶内蒙古园艺兴试剂有限公司;大肠杆菌、金黄色葡萄球菌、假单胞菌、酵母菌和霉菌内蒙古农业大学职业技术学院食品系保存。
TWCL-D调温磁力搅拌器巩义市予华仪器有限责任公司;13 cm×13 cm方皿;鼓风干燥箱上海乐傲实验仪器有限公司;超净台北京王堂蓝翼科技有限公司;高压灭菌锅上海俊晟生物科技有限公司;恒温恒湿箱天津市泰斯特仪器有限公司;酶标仪美国伯腾仪器有限公司。
1.2实验方法
1.2.1菌悬液的制备将大肠杆菌、金黄色葡萄球菌、假单胞菌分别接种于灭菌后的PCA培养基上,37 ℃下培养24 h,活化三次,将第三代菌种采用平板计数法,用灭菌后的生理盐水稀释成1×108CFU/mL的菌悬液备用。酵母菌、青霉菌分别接种于灭菌后的PDA培养基上,28 ℃下培养3 d,活化三次,将第三代菌种采用平板计数法,用灭菌后的生理盐水稀释成1×106CFU/mL的菌悬液备用。
1.2.2抑菌保鲜液的制备称取5 g酪蛋白酸钠用100 mL蒸馏水磁力搅拌至溶解,2 g壳聚糖用100 mL体积分数为1%的冰乙酸水溶液磁力搅拌至溶解,两者的溶液各取50 mL混合并用调温磁力搅拌器搅拌,搅拌过程中加入2%甘油,再加入0.01、0.03、0.05、0.07、0.09 g的纳他霉素制成浓度为0.01%、0.03%、0.05%、0.07%、0.09%纳他霉素保鲜液。同理制备含有0.5%、1.0%、1.5%、2.0%、2.5%溶菌酶的保鲜液。
1.2.3不同保鲜剂对不同菌种的抑制效果取100 μL大肠杆菌、金黄色葡萄球菌、假单胞菌菌悬液接种于已灭菌并冷却的PCA培养基上并用涂布棒涂均匀备用,酵母菌、霉菌菌悬液接种于PDA培养基上涂布均匀备用,将牛津杯(已灭菌)放入含有不同菌的培养基中,加入200 μL不同浓度的不同保鲜液,以只含有2%壳聚糖保鲜液做对照,每个浓度做三个平行。大肠杆菌、金黄色葡萄球菌、假单胞菌置于恒温培养箱中37 ℃培养24 h,酵母菌、霉菌置于真菌培养箱中28 ℃培养3 d。用测微尺测量抑菌圈直径,比较不同浓度的不同保鲜剂的抑菌效果,由于牛津杯直径为7 mm左右,所以抑菌圈直径d<8 mm(文中“-”也表示无抑菌性)为无抑菌性,8 mm
1.2.4干酪样品的处理取至少成熟2个月以上的契达干酪,用无菌刀片将干酪切成5 g大小,并置于不同保鲜剂里浸渍1 min,取出吹干,再浸渍1 min,再吹干,反复3次,确保保鲜液完全复合在干酪上,待其完全干后置于盘中并用保鲜膜封住,置于8 ℃冰箱里放置7 d,同时以第 0 d做空白对照。
1.2.5干酪中菌落总数增量的测定为了更好的了解保鲜剂在干酪中的实际抑菌性能,所以在以测量抑菌圈直径为指标的单因素实验基础上,采用响应面设计,将保鲜液应用于实际干酪中,以测量干酪中的菌落总数为指标研究其抑菌性能,测量干酪中菌落总数的具体方法是:将第0 d的干酪取出置于烧杯中,加入95 mL水,采用高速搅拌机搅碎混匀,用移液枪吸取200 μL于96孔板里,平行做四个,用酶标仪在610 nm下测其吸光值,同理放置7 d的干酪样品测法同上,第7 d的吸光值与第0 d的吸光值的差值,为干酪菌落总数的增量(增量越小,保鲜剂抑菌效果越好)即吸光值增量,A610 nm增量=A610 nm 7 d-A610 nm 0 d。
1.2.6最佳保鲜剂配比的确定根据单因素实验结果,采用响应面设计,运用Box-Behnken中心组合实验设计原理[6-7]做3因素3水平响应面分析实验,实验因素与水平设计见表1。

表1 响应面分析因素水平表
注:壳聚糖在本文没有做单因素抑菌实验,因为在干酪可食性包装膜的制备及性能研究[8]中,将壳聚糖当做成膜剂已优化了其成膜配比,又因为壳聚糖具有抑菌性,所以文中没有将壳聚糖固定成一种浓度主要是想利用3因素3水平进行响应面实验,并通过响应面分析法了解壳聚糖和其他两种抑菌剂之间的交互作用。
1.2.7数据分析采用Design-Expert软件进行响应面实验设计,采用SPSS 13.0软件进行数据分析及差异显著性检验,所有数值均为3次重复的平均值。
2 结果与分析
2.1单因素实验
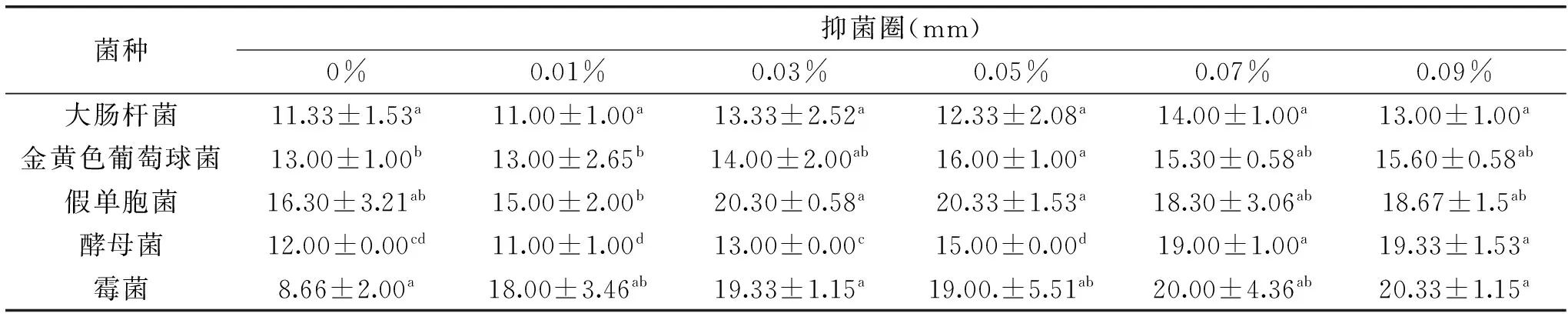
表2 那他霉素对不同菌种的抑菌效果
注:每一行中具有不相同字母的数值之间差异显著(p<0.05),表2同。
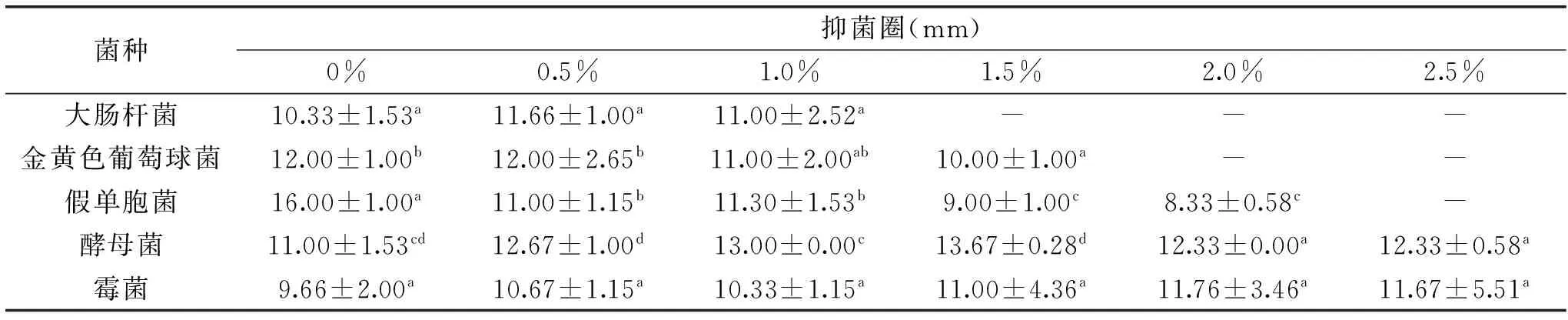
表3 溶菌酶对不同菌种的抑菌效果
2.1.1那他霉素的添加量对不同菌种的抑菌效果由表2可知,那他霉素对霉菌的抑菌效果最优,且抑菌性随着纳他霉素浓度增加而增大,差异达到显著水平(p<0.05);酵母菌的抑菌性随着那他霉素用量的增加而逐渐增大,从0.03%开始增大明显,并且不同用量之间存在显著差异(p<0.05);虽然那他霉素是一种广谱真菌抑制剂[9],但是它对大肠杆菌也起到了一定的抑制作用,当纳他霉素浓度达到0.07%时大肠杆菌的抑菌圈直径出现最大值为14.00 mm;当纳他霉素浓度达到0.05%时,金黄色葡萄球菌和假单胞菌的抑菌圈达到最大分别为16.00 mm和20.33 mm;综合考虑,那他霉素用量确定为0.03%~0.07%范围。
2.1.2溶菌酶的添加量对不同菌种的抑菌效果由表3可以看出,与对照组相比,溶菌酶的加入对大肠杆菌、金黄色葡萄球菌和假单胞菌的抑菌效果不明显,当溶菌酶浓度在0%~1.0%之间时,溶菌酶对大肠杆菌发挥了一定的抑菌作用,当溶菌酶浓度大于1.0%时对大肠杆菌已经没有抑制性;溶菌酶是一种对革兰氏阳性菌有强烈抑制性的抑菌剂,但是本文将壳聚糖与溶菌酶复合使用却没有充分发挥溶菌酶对金黄色葡萄球菌的抑制性,甚至在溶菌酶浓度大于等于1.5%时没有任何抑菌性,究其原因很有可能是溶菌酶与壳聚糖交互使用出现了拮抗作用;酵母菌的抑菌圈随着溶菌酶的浓度增加呈先增加后减小的趋势,并且在0%~2%之间存在显著差异(p<0.05);溶菌酶对霉菌的抑菌性在不同用量之间没有显著性差异(p>0.05);综合考虑,溶菌酶用量确定为0.5%~1.5%范围。
2.1.3保鲜剂配比的响应曲面实验结果与优化根据表4方案进行响应面实验,在17个实验中其中有12组是析因实验,5组是中心实验,用来估计实验误差。响应面分析实验结果见表4,回归方程方差分析见表5。经回归拟合后,实验因子对响应值的影响可用回归方程表示为:
Y=1.35-0.19X1-0.11X2-0.031X3-0059X1X2+0.078X1X3+0.038X2X3+0.056X12+0.11X22+0.09X32

表4 响应面分析实验结果
由表5可以看出,建立的模型p<0.0001,说明模型极显著,失拟项p=0.08>0.05,表明差异不显著,说明残差均由随机误差引起的,模型的相关系数R2=0.9743,说明响应值的变化有97.43%来源于所选变量,因此该模型拟合程度良好,实验误差小,可以用此模型来分析预测干酪天然复合保鲜剂的配比[10]。

表5 回归方程的方差分析
2.1.4因素间的交互作用根据回归方程利用Design-Expert 软件做不同因素的响应面分析图1~图3。等高线的形状可以反映出交互效应的强弱大小,圆形表示交互作用不显著,椭圆形表示两者交互作用显著[11]。
从图1看出壳聚糖和那他霉素的交互作用显著,在实验水平范围内,干酪吸光值增量随着壳聚糖含量和那他霉素含量的增加而呈现出逐渐减小的趋势,在高水平区两者的交互作用使吸光值增量达到了最低点,且沿壳聚糖用量方向等高线密度变化相对较高,说明壳聚糖用量对吸光值增量的影响大于那他霉素用量。

图1 壳聚糖、那他霉素用量与吸光值增量的响应面Fig.1 Response surface for absorbance value increment as a function of the amount of chitosan and natamycin
图2显示了那他霉素取中心水平时,壳聚糖和溶菌酶对吸光值增量的交互作用。从等高线图可以看出壳聚糖与溶菌酶的交互作用显著,在实验水平范围内,吸光值增量随着壳聚糖用量呈现逐渐减小的趋势,当在壳聚糖用量高水平区时,随着溶菌酶用量的增加吸光值增量逐渐增加。沿壳聚糖用量方向等高线密度变化相对较高,说明壳聚糖用量对吸光值增量的影响大于溶菌酶用量。

图2 壳聚糖、溶菌酶用量与吸光值增量的响应面Fig.2 Response surface for absorbance value increment as a function of the amount of chitosan and lysozyme
图3显示了壳聚糖取中心水平时,那他霉素和溶菌酶对吸光值增量的交互作用。从等高线图接近圆形可知,那他霉素与溶菌酶的交互作用不显著,那他霉素用量影响显著,在实验水平范围内,沿那他霉素用量方向等高线密度变化相对较高,说明那他霉素用量对干酪吸光值增量的影响大于溶菌酶用量。
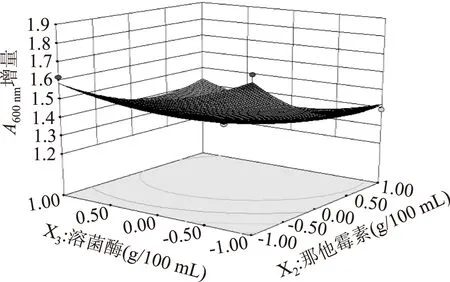
图3 那他霉素、溶菌酶用量与吸光值增量的响应面Fig.3 Response surface for absorbance value increment as a function of the amount of natamycin and lysozyme
综上,3因素对干酪吸光值增量影响的大小顺序依次是壳聚糖用量>那他霉素用量>溶菌酶用量,这也与通过表5中F值判断的结果相一致。
2.1.5复合保鲜剂最佳配比的确定通过响应曲面法所得的回归方程,得出了最优复合保鲜剂的配比:壳聚糖用量2.0 g/100 mL、那他霉素用量0.07 g/100 mL、溶菌酶用量1.0 g/100 mL,此时干酪的吸光值增量达到最小值。为了检验结果的可靠性,用此最佳条件进行3次平行验证实验得到干酪吸光值增量为1.225,与理论预测值1.221非常接近,表明基于响应曲面法所得的优化复合保鲜剂配比准确可靠,具有实用价值,但又考虑到用吸光值增量评价抑菌效果不具有普遍性,因此在该配比下又以大肠杆菌、金黄色葡萄球菌、假单胞菌、酵母菌和霉菌为供试菌种做了抑菌圈实验,得到抑菌圈直径分别为大肠杆菌13.67 mm,金黄色葡萄球菌14.33 mm,假单胞菌15.66 mm,酵母菌18.00 mm和霉菌17.76 mm。
3 结论
本文在单因素实验的基础上通过测量抑菌圈直径研究了天然保鲜剂那他霉素、溶菌酶对大肠杆菌、金黄色葡萄球菌、假单胞菌、酵母菌和霉菌的抑菌作用,结果表明:综合纳他霉素分别对5种菌种的抑制效果,初步确定纳他霉素的浓度范围为0.03%~0.07%,溶菌酶的浓度范围初步确定为0.5%~1.5%,然后利用实验设计软件Design-Expert,采用响应曲面法建立了复合保鲜剂配比的二次多项式数学模型,对各因子与响应值的影响进行了分析,结果表明:模型拟合程度高,实验误差小。得到复合保鲜剂最佳配比为:壳聚糖用量2.0 g/100 mL、那他霉素用量0.07 g/100 mL、溶菌酶用量1.0 g/100 mL,此条件下干酪吸光值增量为1.225,对供试菌种的抑菌圈直径分别为大肠杆菌13.67 mm,金黄色葡萄球菌14.33 mm,假单胞菌15.66 mm,酵母菌18.00 mm和霉菌17.76 mm。利用该方法可以更好的为天然复合保鲜剂的开发提供实验基础。
[1]杨续金,范贵生. 奶酪的市场发展趋势[J].农产品加工,2006(11):57-58.
[2]Spano G,Goffredo E,Beneduce L,et al.Fare ofEscherichiacoilO157∶H7 during the manufacture of Mozzarella cheese.Lett Appl Microbiol,2003,36:73-76.
[3]KasrazadehM,Genigeorgis C.Potential growth and control of Salmonella in Hispanic type soft cheese[J].Int J Food Microbiol,1994,22:127-140.
[4]SuizerG,Busse M.Growth inhibition of Listeria spp. On Camembert cheese by bacterial producting inhibitory substances[J]. Int J Food microbiol,1991,14:287-96.
[5]Eliot SC,Vuillemard J-C,Emond J-P.Stability of shredded Mozzarella cheese under modified atmospheres[J]..J Food Sci,1998,63:1075-80.
[6]李红,赵征,敖海英,等.响应面法在植脂稀奶油搅打特征优化中的应用[J].中国乳品工业,2003,31(2):12-14.
[7]Box G E P,Hunter W G.Statistics for experments:An introduction to design,data analysis and model building[M].New York:JohnWiley&Sons Inc,1978.
[8]赵浩,刘敏,范贵生.干酪可食性包装膜的制备及性能研究[J].包装工程,2016,37(5):73-77.
[9]陈晓丽,吕振岳.新型天然食品防腐剂那他霉素的研究进展[J].食品研究与开发,2002,23(4):23-25.
[10]赵先民.实验设计方法[M].北京:科学出版社,2006:8.
[11]王允祥,吕凤霞,陆兆新.杯伞发酵培养基的响应曲面法优化研究[J].南京农业大学学报,2004,27(3):89-94.
Study on presciption of coating edible preservative for cheese
LIU Min,ZHAO Hao,FAN Gui-sheng*
(Inner Mongolia Agricultural University,Hohhot 010018,Chnia)
To study and develop an edible preservation film,the antibacterial property of the base liquid mixture adding the inhibiting components of natamycin and lysozyme were tested. The base liquid was composed of caseinate sodium,and chitosan and glycerol. The test bacteria wereE.coli,Staphylococcusaureus,Pseudomonasfluorescens,yeast and mold. The result showed that the antibacterial effect of natamycin on mold and yeast was enhanced with the increase of its dosage,and there were significant differences between different dosage(p<0.05).Inihibiting effect of natamycin onStaphylococcusaureus,Pseudomonasfluorescenswas first increased and then decreased and the effect onE.colishowed no significant difference among different amount(p>0.05).The inhibitory effect of lysozyme had a significant effect on yeast(p<0.05),but the inhibition zone of other bacteria were less than 12 mm. Response surface analysis was employed to optimize parameters of the prescription of the base liquid with blend of natamycin and lysozyme.The evaluating index was the increment of absorbance. The results revealed that the optimum additive amount of natamycin and lysozyme was 0.07 g/100 mL base liquid and 1 g/100 mL base liquid. At this dose,the absorbance increment of the base liquid reached a minimum value.The result also showed that there were significant interaction effects between chitosan and natamycin,as well as between chitosan and lysozyme(p<0.05),wheras the interaction effects between natamycin and lysozyme was not significant(p>0.05),and the diameter of the inhibition zone ofE.coli,Staphylococcusaureus,Pseudomonas,yeast and mold were 13.67,14.33,15.66,18.00,17.76 mm in this ratio respectively.
edibility;complex preservative;antibactria effect;response surface
2016-03-01
刘敏(1975-),女,硕士,副教授,研究方向:农畜产品加工与贮藏,E-mail:Minliu0000@163.com。
范贵生(1957-),男,博士,教授,研究方向:食品包装与储运,E-mail:spfgsh@imau.edu.cn。
国家自然科学基金(31260382);内蒙古自然科学基金(2015MS0316)。
TS202
A
1002-0306(2016)17-0257-05
10.13386/j.issn1002-0306.2016.17.042

