不同生长时期罗汉果果实转录因子的转录组分析及酵母单杂交文库的构建△
张凯伦,罗祖良,郭玉华,石宏武,马小军,2*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100)
·基础研究·
不同生长时期罗汉果果实转录因子的转录组分析及酵母单杂交文库的构建△
张凯伦1,罗祖良1,郭玉华1,石宏武1,马小军1,2*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100)
目的研究罗汉果果实中的转录因子(transcription factors,TFs)。方法在授粉后3、50、70 d(days after flowering,DAF)的罗汉果果实转录组中查询注释为转录因子的所有非重复Unigene,并在表达谱中查找其表达情况;应用Matchmaker Yeast One-Hybrid Library Construction系统构建酵母单杂交cDNA文库。结果罗汉果表达谱数据中共有38个家族的119个转录因子Unigene具有表达差异,其中以70 DAF/3 DAF和50 DAF/3 DAF组中具有差异表达的转录因子数目较多,且上调和下调的转录因子Unigene数目相近。此外,初步筛选到4个可能参与罗汉果甜苷合成调控的bHLH(basic helix-loop-helix,bHLH)转录因子Unigene(bHLH014、bHLH025、bHLH093、bHLH096)及8个可能参与黄酮类化合物合成调控的MYB转录因子Unigene;成功构建了酵母单杂交文库pGADT7-Rec2-Lib,其库容量为2.3×106 cfu,插入片段的平均长度约为1.5 kbp。结论转录组数据分析和酵母单杂交实验有助于筛选罗汉果果实中具有调控作用的转录因子。
罗汉果;转录因子;转录组;酵母单杂交文库
罗汉果是多年生藤本植物葫芦科(Cucurbitaceae)罗汉果属(Siraitia)罗汉果Siraitiagrosvenorii的果实,主要分布于中国广西壮族自治区,其主要化学成分为葫芦烷型三萜皂苷罗汉果甜苷。作为药食同源植物,罗汉果一方面长期作为传统中药具有镇咳平喘、抗氧化、调节免疫等疗效[1];另一方面由于其成熟果实提取物的高甜度(比蔗糖还要甜300倍)[2],在作为食品添加剂及糖尿病患者的非糖甜味剂方面具有广阔的应用前景。
转录因子(transcription factors,TFs)即反式作用分子,在细胞核内能够特异性识别并结合基因启动子上的顺式作用元件(cis-acting element),调控基因的时空表达。它们与植物的生长发育[3]、次生代谢[4]和抗逆反应[5]有着密切的关系。典型的植物转录因子是由核定位信号区(nuclear localization signal,NLS)、DNA结合区(DNA binding domain,DBD)、转录调控区(transcription regulation domain,TRD)和寡聚化位点(oligomerization site,OS)组成。根据其中DNA结合区氨基酸序列的不同,可分为具有不同结构域的转录因子家族,如MYB、bHLH、WRKY、bZIP、AP2/EREBP等。常用的分离转录因子的方法为酵母单杂交法(yeast one-hybrid,Y1H),它是在体外分析DNA(目的基因顺式作用元件)与蛋白质(转录因子)相互作用的有效方法,主要通过构建诱饵载体和酵母单杂交文库,对阳性克隆进行测序从而筛选出与基因启动子区结合的转录因子。现已用酵母单杂交技术克隆到多种植物中的转录因子,如豌豆[6]、长春花[7]、中国红豆杉等[8]。
2011年,Tang等[9]应用Solexa高通量测序技术对授粉后3、50、70 d(days after flowering,DAF)的罗汉果果实进行转录组测序和表达谱分析,开启了关于罗汉果分子生物学的研究。现已从转录组数据中鉴定了罗汉果甜苷骨架生物合成途径中的所有酶基因,同时发现了多个家族转录因子的存在。本研究主要通过分析转录组和表达谱数据中的转录因子及建立酵母单杂交cDNA文库,旨在为罗汉果果实中转录因子的筛选及其调控机制的研究奠定基础。
1 材料与仪器
1.1 材料
实验材料为于30 DAF经500 μmol·L-1茉莉酸甲酯(methyl jasmonate,MeJA)诱导后24 h的罗汉果果实及已提取的果实cDNA(均保存于-80 ℃),3、50、70 DAF的罗汉果果实转录组和表达谱数据[9]。
1.2 试剂
Trizol Reagent(Invitrogen)、荧光定量试剂盒SYBR Premix Ex TaqTMⅡ(TliRNaseH Plus)(TaKaRa,Dalian,China)、酵母单杂交系统MatchmakerTMOne-Hybrid Library Construction & Screening Kit(Catalog No.630304,Clontech)、酵母质粒提取试剂盒(D1160-100,Solarbio)。DNA合成由生工生物工程股份有限公司完成;各种酶制剂及大肠杆菌感受态购自Takara公司(大连)。
1.3 仪器
NanoDrop 2000 spectrophotometer (Thermo Scientific,USA)、AB 7500 Fast Real-Time PCR System (Applied Biosystem,USA)、电转化仪(Bio-Rad)、PCR仪(Bio-Rad)。
2 方法
2.1 转录组数据中转录因子的分析
对罗汉果3、50、70 DAF转录组数据中注释为转录因子的Unigene进行整理,然后在表达谱中查找包括50 DAF/3 DAF、70 DAF/3 DAF和70 DAF/50 DAF组中所有表达有差异的转录因子Unigene并进行分类。
2.2 荧光定量PCR筛选可能参与甜苷合成的bHLH转录因子
由于罗汉果甜苷V的含量在罗汉果果实生长发育的后期才开始激增(50~70 DAF),有表达差异的转录因子Unigene中bHLH转录因子家族数目最多,因此选择在70 DAF/3 DAF和50 DAF/3 DAF组中均有表达差异的bHLH转录因子Unigene作为研究对象,用经验证施加MeJA后甜苷含量和合成酶基因表达量均增加的罗汉果果实cDNA作为实验材料,应用荧光定量PCR检测表达谱中表达差异较大(2个组的基因表达量log2值均大于2)的6个候选bHLH转录因子Unigene在MeJA诱导下的表达情况,选择UBQ5为内参基因,引物见表1。

表1 用于荧光定量PCR实验的引物
2.3 总RNA的提取及mRNA的分离
选用前期实验室已验证经MeJA处理后,甜苷含量及合成酶基因表达量有明显提高的罗汉果果肉,用改良Trizol法[10]提取样品中的总RNA。使用Oligotex mRNA Kits(Qiagen)分离纯化样品的mRNA。
2.4 cDNA的合成与纯化
将分离得到的样品mRNA转移到RNase free离心管1中,加入7 μL mRNA、1 μL 3′RTPrimer(30 pmol)和1 μL dNTPs(10 mmol·L-1),65 ℃处理5 min,立即置于冰上。在一个新的RNase free 离心管2中加入4 μL 5×RT Buffer、2 μL 0.1 mol·L-1DTT、5 μL RT 酶,并置于冰上待用。待管1降至45 ℃后,维持在45 ℃2 min,再加入管2中的混匀液,继续在50 ℃条件下孵育1 h合成第一链cDNA。
继续在反应管中加入92 μL DEPC-treated water、30 μL 5×Second Strand Buffer、3 μL 10 mmol·L-1(each) dNTPs、1 μLE.coliDNA Ligase(10 U·μL-1)、4 μLE.coliDNA Polymerase I和1 μLE.coliRNaseH(2 U·μL-1),在16 ℃孵育2 h。然后加入2 μLT4DNA Polymerase,于16 ℃孵育5 min,加入10 μL 0.5 mol·L-1EDTA(pH8.0)及160 μL酚-三氯甲烷-异戊醇(25∶24∶1)溶液,充分混匀30 s,在室温条件下,于14 000 r·min-1离心5 min,小心将上清液倒入新的离心管中,用乙醇沉淀,最后溶于105 μL DEPC水中。
在新的反应管中加入34 μL cDNA、5 μL 10×T4 ligase Buffer、10 μL 5′ Adapter(1 μg·μL-1)和1 μL T4 DNA Ligase(40 U·μL-1,NEB)。混匀后,在16 ℃放置16~24 h。使用低熔点琼脂糖电泳cDNA,切胶回收1000 bp以上的条带,乙醇沉淀后溶于14 μL水中,并进行电泳检测。
2.5 cDNA与载体的连接
在1.5 mL离心管中加入14 μL cDNA、2 μL pGADT7(300 ng·μL-1)和4 μL 5×Infusion enzyme mix,混匀后置于50 ℃孵育30 min,然后向重组反应体系中加入2 μL的ProteinaseK,在37 ℃孵育15 min,继续在75 ℃孵育10 min,补水到100 μL。
然后向反应体系中依次加入1 μL Glycogen(20 μg·μL-1)、50 μL 7.5 mol·L-1NH4OAc和375 μL 100% ethanol,混合均匀后置于-80 ℃ 1 h,于4 ℃、16 000 r·min-1离心30 min;小心去上清液,加入150 μL的70%乙醇,于4 ℃、16 000 r·min-1离心3 min;重复上述步骤1次,去尽上清液,在室温下将cDNA晾干5~10 min;用10 μL的DEPC水重悬cDNA沉淀,用移液枪吹吸30~40次。瞬时离心2 s收集cDNA,立即放置于冰上。
2.6 酵母单杂交文库的构建及质量鉴定
将2 μL的重组产物转化50 μL大肠杆菌感受态细胞,取转化后的细菌原液10 μL稀释100倍,从中取出10 μL涂布LB平板(含氨苄抗性),第二天计数,计算公式为:总克隆数=平板上克隆数×稀释倍数×菌液体积。挑取平板上的单克隆,进行PCR扩增,并用凝胶电泳检测PCR产物大小。使用Qiagen大抽试剂盒提取质粒,保存于-80 ℃冰箱内。
3 结果与分析
3.1 罗汉果转录组与表达谱数据中转录因子的分析
3.1.1 转录组数据分析 在罗汉果转录组数据中发现已注释家族的转录因子共468个,其中数目最多的3个转录因子家族为bHLH、WRKY和MYB转录因子,它们的数量分别为79、57、50个。此外,转录组数据中还有其他类型的转录因子,包括19个HSF、16个TCP、9个HB、6个MYB-related和5个bZIP等转录因子家族。
3.1.2 表达谱数据分析 对3、50、70 DAF的罗汉果果实表达谱数据进行分析,以任意一个组有差异变化为标准,发现了共38个家族的119个转录因子Unigene(占总转录因子数目的25.4%)具有表达差异,其中数目最多的3个转录因子家族为bHLH、WRKY和MYB转录因子,它们的数量分别为22、14、14个。在70 DAF/3 DAF、50 DAF/3 DAF和70 DAF/50 DAF 3个组中具有表达差异的Unigene数目分别为86、91和40个,且在70 DAF/3 DAF、50 DAF/3 DAF组中上调和下调的转录因子Unigene数目相近,在70 DAF/50 DAF组中上调的转录因子Unigene数目比下调的数目多(见图1)。对3个组进行比较,发现在3个组中均有表达差异的转录因子Unigene个数为10;对2个组分别进行比较,发现在70 DAF/3 DAF和50 DAF/3 DAF组中均有表达差异的转录因子Unigene共58个,在70 DAF/3 DAF和70 DAF/50 DAF组中均有表达差异的转录因子Unigene共18个,在50 DAF/3 DAF和70 DAF/50 DAF组中均有表达差异的转录因子Unigene共27个。
由于罗汉果甜苷V的含量在果实生长后期50~70 DAF激增,因此为了筛选可能参与甜苷合成的转录因子,选择在70 DAF/3 DAF和50 DAF/3 DAF组中均上调表达的共16个家族的33个转录因子Unigene进行分析,它们的表达变化范围为1.03~13.89。其中包括12个bHLH转录因子,其他家族还包括TCP、MYB、WRKY、GRAS等,数量均≤3(见表2)。
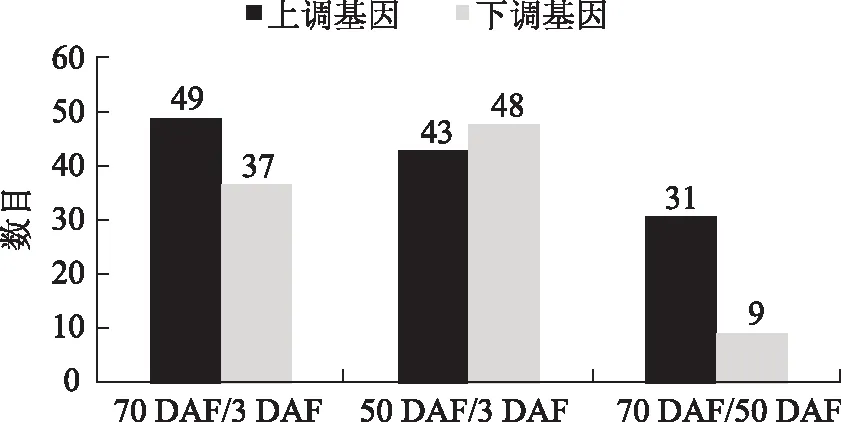
图1 罗汉果表达谱中具有表达差异的转录因子
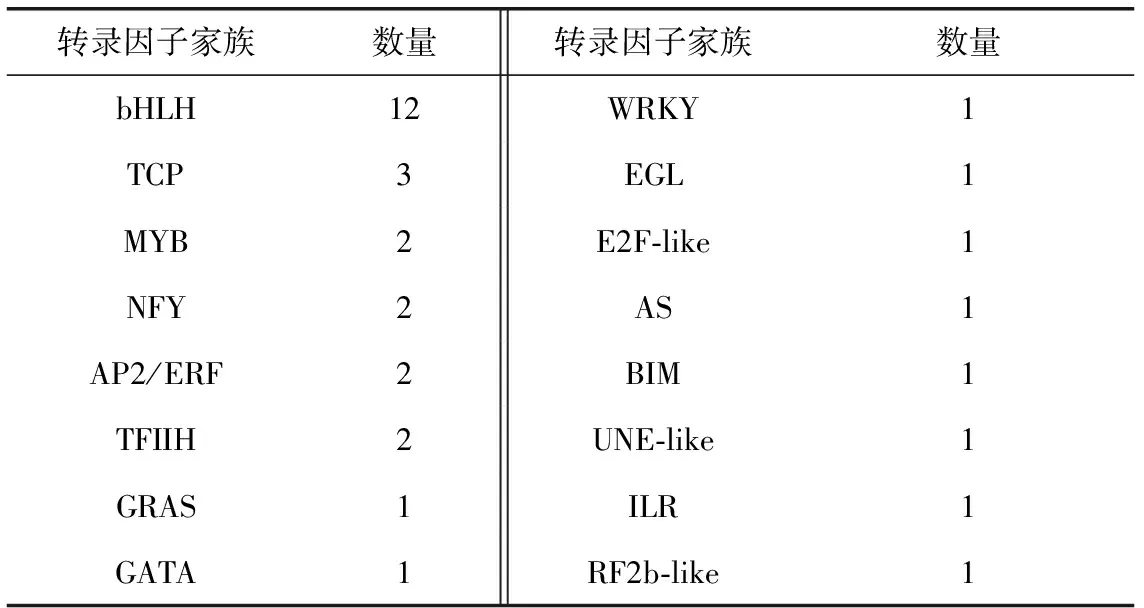
表2 70 DAF/3 DAF和50 DAF/3 DAF组中均上调表达的转录因子Unigene
3.1.3 参与调控罗汉果甜苷合成途径的bHLH转录因子的筛选 选择在70 DAF/3 DAF和50 DAF/3 DAF组中表达差异较大的6个注释为bHLH转录因子的Unigene(bHLH014、bHLH025、bHLH061、bHLH071、bHLH093、bHLH096),以经MeJA诱导后的罗汉果果实作为实验材料,应用qRT-PCR筛选与甜苷合成关键酶基因协同表达的bHLH转录因子。结果显示除了bHLH061和bHLH071基因外(结果未显示),其他4个bHLH基因bHLH014、bHLH025、bHLH093、bHLH096的表达量均被不同程度地上调(见图2),表明它们可能参与甜苷合成的调控。其中,bHLH093和bHLH096基因在6 h的表达量较0 h相比,增加了9~10倍;bHLH025在6 h则增加了1.8倍。bHLH014基因的表达量在2 h达到最大值,为0 h的2.5倍。
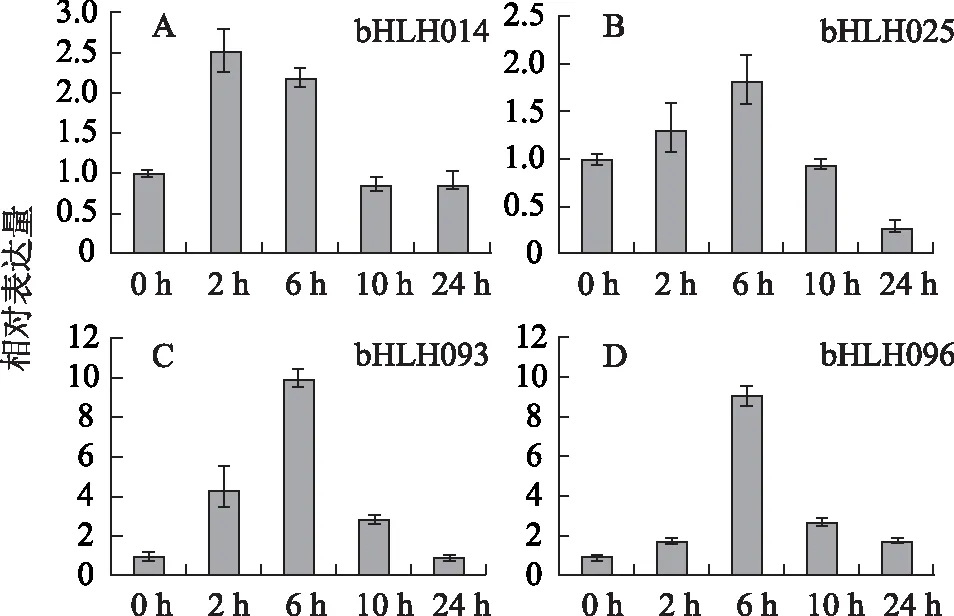
注:A.bHLH014;B.bHLH025;C.bHLH093;D.bHLH096。图2 4个bHLH转录因子的荧光定量PCR测定结果
3.1.4 参与调控果实中黄酮类化合物合成途径的MYB转录因子的初步筛选 已报道罗汉果果实中含有少量的黄酮类化合物,且总黄酮的含量随着果实的生长发育先逐渐增长,在50 DAF时达到含量的峰值,然后下降[11]。MYB类转录因子是调控植物中黄酮类化合物生物合成的主要转录因子家族[12]。因此,在表达谱50 DAF/3 DAF组数据中找到了8个MYB类转录因子Unigene,可能参与罗汉果果实中黄酮类化合物的生物合成,结果见表3。
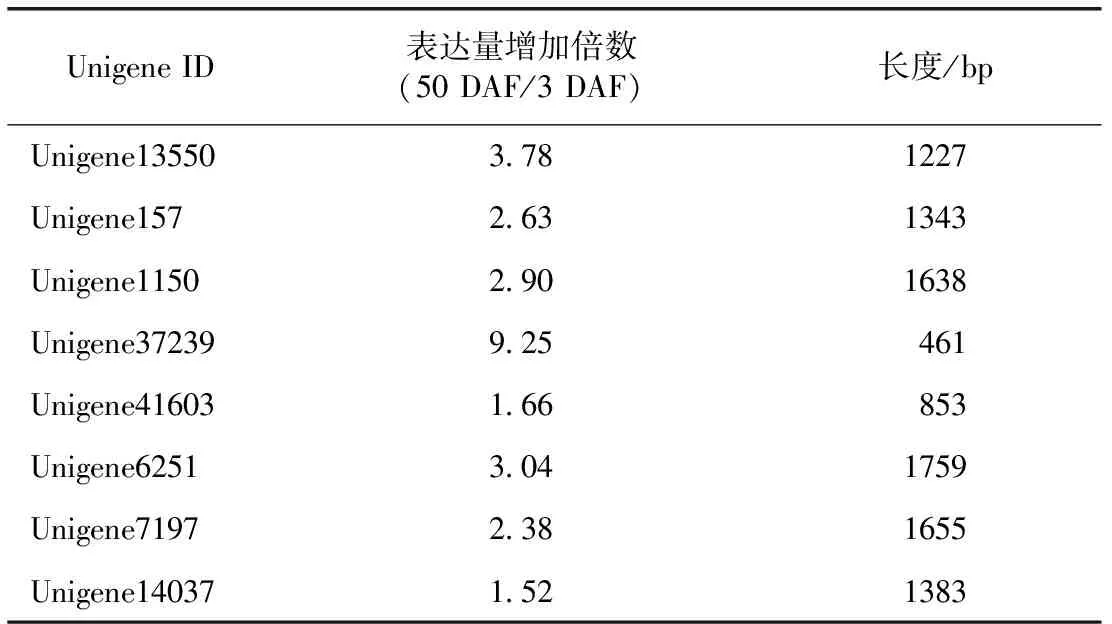
表3 8个可能参与罗汉果果实中黄酮类化合物生物合成的MYB转录因子Unigene
3.2 酵母单杂交的构建
3.2.1 总RNA与ds cDNA的质量检测 采用trizol试剂提取罗汉果果实中的总RNA,凝胶电泳结果见图3。从图中可看到两条清晰的主带28S和18S,且28S条带的亮度大于18S的亮度,表明所提取的RNA无降解现象,质量良好。核酸定量检测结果显示总RNA的A260/A280值为1.98,符合要求,浓度为830 ng·μL-1。
注:M.1 kbplus DNAladder;1、2.提取的总RNA。图3 罗汉果果实中提取的总RNA电泳分析
将纯化的ds cDNA进行琼脂糖凝胶电泳分析,见图4。从图4中可看到ds cDNA呈明亮的弥散状条带,符合文库的构建要求。

注:M.1kb plus DNA ladder;1.纯化的ds cDNA。图4 罗汉果果实中纯化后的ds cDNA电泳分析
3.2.2 酵母单杂交文库的质量检测 将10 μL原始电转化菌稀释100倍后,取10 μL涂板,在平板上共长了约230个克隆子,共计5 mL的转化后原始菌液,因此总库容量为:5×230/10×100×1000=2.3×106cfu。插入片段的凝胶电泳图见图5,结果显示插入片段的平均长度约1.5 kbp。

注:M.1kb plus DNA ladder;1~24.插入片段。图5 酵母单杂交文库插入片段电泳分析
4 讨论
随着生物技术的发展,转录组学已经逐渐成为研究者探索生物体生理生化过程机制的有效手段。本研究利用不同时期罗汉果果实的转录组数据分析果实中的转录因子,筛选到4个与甜苷含量及合成酶基因表达变化协同一致的bHLH转录因子Unigene,提示它们可能参与调控罗汉果甜苷的合成。接下来可以对它们进行克隆表达,利用酵母单杂交、凝胶迁移实验(electrophoretic mobility shift assay,EMSA)等方法分析它们与甜苷合成酶基因启动子区的结合能力;或对它们进行RNA干扰及过表达以确认它们的功能。
在罗汉果转录组数据中同时找到了50个MYB转录因子,MYB转录因子能够调控高等植物中黄酮类成分的积累和相关基因的表达。在罗汉果果实中除了含有三萜皂苷外,还含有黄酮类化合物,主要成分为罗汉果素(grosvenorine)和槲皮素苷及它们的苷元山柰酚和槲皮素[13]。对不同时期罗汉果果实中总黄酮的含量进行测定,发现其含量先逐渐增长,在50 DAF达到最大值,然后在60 DAF迅速下降至20 DAF水平[11]。因此本研究利用表达谱数据筛选了在50 DAF/3 DAF组中表达量上调的8个MYB转录因子Unigene,它们可能参与调控罗汉果果实中黄酮类化合物的生物合成。接下来,可以通过克隆已鉴定的罗汉果查尔酮合成酶基因SgCHS的启动子序列[14],检测这8个MYB转录因子Unigene与SgCHS基因启动子区的结合情况。
在罗汉果的同属植物黄瓜中,发现了与氧化鲨烯环化酶基因Bi(登陆号:KM655855.1)基因启动子区E-box结合的bHLH转录因子[15],Bi与罗汉果甜苷合成关键酶基因CS(登录号:HQ128567.1)有86%的同源性,且CS基因启动子区也含有E-box,提示罗汉果中可能也存在能够与CS基因启动子区结合的bHLH类转录因子。然而,本课题组通过CS基因启动子区E-box构建的诱饵载体及已成功建立的cDNA文库,利用酵母单杂交实验进行转录因子的筛选时,在52个阳性克隆中未发现bHLH转录因子,这可能与所选取的E-box与bHLH转录因子结合能力较弱有关:已知能被bHLH蛋白识别的核心序列为E-box(5′-CANNTG-3′),中间两个核苷酸的不确定性使E-box有不同的种类,其中80%以上的序列为G-box(5′-CACGTG-3′)[16]。CS基因启动子区不含有G-box,而含有不同类型的E-box,有文献对这些E-box与bHLH蛋白的结合能力进行了检测,发现与G-box相比它们的结合能力下降了50%以上[17]。
本研究成功构建了酵母单杂交文库,有助于通过建立诱饵载体进行酵母单杂交实验,筛选与诱饵DNA序列结合的转录因子,为寻找罗汉果果实中具有调控作用的转录因子,阐明罗汉果中相关活动的基因调控网络及分子机制奠定基础。
[1] LI C,LIN L M,SUI F,et al.Chemistry and pharmacology ofSiraitiagrosvenorii:a review[J].Chin J Nat Med,2014,12(2):89-102.
[2] Kasai R,Nie R L,Nashi K,et al.Sweet Cucurbitane Glycosides from Fruits ofSiraitiasiamensis(chi-zi luo-han-guo),a Chinese Folk Medicine[J].Agric BiolChem,1989,53(12):3347-3349.
[3] Kosugi S,Ohashi Y.PCF1 and PCF2 Specifically Bind tocisElements in the Rice Proliferating Cell Nuclear Antigen Gene[J].Plant Cell,1997,9(9):1607-1619.
[4] Zhang H B,Bokowiec M T,Rushton P J,et al.Tobacco Transcription Factors NtMYC2a and NtMYC2b Form Nuclear Complexes with the NtJAZ1 Repressor and Regulate Multiple Jasmonate-Inducible Steps in Nicotine Biosynthesis[J].Mol Plant,2012,5(1):73-84.
[5] Zarka D G,Vogel J T,Cook D,et al.Cold Induction of ArabidopsisCBFGenes Involves Multiple ICE (Inducer ofCBFExpression) Promoter Elements and a Cold-Regulatory Circuit That Is Desensitized by Low Temperature[J].Plant Physiol,2003,133(2):910-918.
[6] Qian W Q,Tan G H,Liu H X,et al.Identification of a bHLH-type G-box binding factor and its regulation activity with G-box and Box I elements of thePsCHS1 promoter[J].Plant Cell Rep,2007,26(1):85-93.
[7] Chatel G,Montiel G,Pre M,et al.CrMYC1,aCatharanthusroseuselicitor-and jasmonate-responsive bHLH transcription factor that binds the G-box element of the strictosidine synthase gene promoter[J].J Exp Bot,2003,54(392):2587-2588.
[8] 李书涛.调控紫杉醇合成转录因子TcMYC和TcWRKY1的克隆及功能研究[D].武汉:华中科技大学,2012.
[9] Tang Q,Ma X J,Mo C M,et al.An efficient approach to findingSiraitiagrosvenoriitriterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J].BMC Genomics,2011,12:343.
[10] 唐其.罗汉果转录组、表达谱的高通量测序及甜苷V生物合成关键酶的克隆[D].北京:北京协和医学院,2010.
[11] 陈全斌,义祥辉,余丽娟,等.不同生长周期的罗汉果鲜果中甜甙V和总黄酮含量变化规律研究[J].广西植物,2005,25(3):274-277.
[12] Liu J Y,Osbourn A,Ma P D.MYB Transcription Factors as Regulators of Phenylpropanoid Metabolism in Plants[J].Mol Plant,2015,8(5):689-708.
[13] 斯建勇,陈迪华,常琪,等.鲜罗汉果中黄酮甙的分离及结构测定[J].药学学报,1994,29(2):158-160.
[14] 王志强,蒙姣荣,邹承武,等.罗汉果查尔酮合成酶基因的生物信息学分析[J].基因组学与应用生物学,2010,29(3):577-583.
[15] Shang Y,Ma Y S,Zhou Y,et al.Plant science.Biosynthesis,regulation,and domestication of bitterness in cucumber[J].Science,2014,346(6213):1084-1088.
[16] 张鑫,宋经元,胡鸢雷,等.bHLH转录因子调控植物活性成分生物合成的研究进展[J].药学学报,2014,49(4):435-442.
[17] Donmbrecht B,Xue G P,Sprague S J,et al.MYC2 differentially modulates diverse jasmonate-dependent functions inArabidopsis[J].Plant Cell,2007,19(7):2225-2245.
TranscriptomeAnalysisonTranscriptionFactorsofSiraitiagrosvenoriiFruitsatDifferentGrowingStagesandConstructionofYeastOne-HybridLibrary
ZHANG Kailun1,LUOZuliang1,GUOYuhua1,SHIHongwu1,MAXiaojun1,2*
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China;2.YunnanBranchofInstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,Jinghong666100,China)
Objective:To study transcription factors (TFs)in the fruits ofSiraitiagrosvenorii.MethodsNon repeating TFs unigenes were selected in transcriptome ofS.grosvenoriifruits at 3,50 and 70 DAF and their expressions were investigated in gene expression profiles;Matchmaker Yeast One-Hybrid Library Construction system was applied to construct yeast one-hybrid cDNA library.Results119 differentially expressed TFs unigenes which belong to 38 TFs families were found out.The numbers of TFs unigenes in 70 DAF/3 DAF and 50 DAF/3 DAF groups were greater and the numbers of the up-regulated and down-regulated TFs unigenes were similar.What’s more,4 bHLH (basic helix-loop-helix,bHLH) TFs unigenes (bHLH014、bHLH025、bHLH093、bHLH096) which might involve in the regulation of mogrosides synthesis and 8 MYB TFs unigenes which might involve in the regulation of flavonoids synthesis were screened.The yeast one-hybrid library pGADT7-Rec2-Lib was successfully constructed with 2.3×106cfu storage capacity.And the inserted PCR fragments sizes are about 1.5 kbp.ConclusionTranscriptome analysis and yeast one-hybrid system are able to help the selection of transcription factors with regulatory effect inS.grosvenoriifruits.
Siraitiagrosvenorii;transcription factor;transcriptome;yeast one-hybrid library
2016-05-04)
国家自然科学基金(81373914,81573521)
*
马小军,研究员,研究方向:分子生物学;E-mail:mayixuan10@163.com
10.13313/j.issn.1673-4890.2016.8.001

