硅胶柱色谱结合高速逆流色谱法分离制备白首乌根皮中的苯乙酮类成分△
李怀志,徐凌川,王晓,李佳*,杨鹏,杨炳田
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;3.济南三峰生物制药有限公司,山东 济南 250014)
硅胶柱色谱结合高速逆流色谱法分离制备白首乌根皮中的苯乙酮类成分△
李怀志1,2,徐凌川1,王晓2,李佳1*,杨鹏3,杨炳田3
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;3.济南三峰生物制药有限公司,山东 济南 250014)
目的创建硅胶柱色谱结合高速逆流色谱法制备分离泰山白首乌根皮中苯乙酮类成分的方法。方法白首乌根皮粗提物先经过硅胶柱色谱进行初步分离,得到含有苯乙酮类成分的A和B两个组分,分别采用石油醚-乙酸乙酯-甲醇-水(4∶6∶4.5∶5.5,V/V)和石油醚-乙酸乙酯-甲醇-水(4∶6∶3∶7,V/V)的两相溶剂体系进行制备并分离。结果从260 mg 组分A中分离制备得到对苯二酚3.9 mg (1)、 4-羟基苯乙酮17.1 mg (2)、2,5-二羟基苯乙酮13.3 mg (3)和2,4-二羟基苯乙酮21.0 mg (4);从300 mg 组分B中分离得到白首乌二苯酮136 mg (5)。经高效液相色谱分析,其纯度分别为97.0%、96.6%、99.2%、99.7%、99.5%。结论该法简便、快速、高效,可用于白首乌根皮中苯乙酮类成分的快速分离制备,有较好的实用价值,为白首乌根皮的开发利用提供了参考依据。
硅胶柱色谱;高速逆流色谱;苯乙酮类成分;白首乌根皮
泰山白首乌CynanchumbungeiDecne为萝藦科植物戟叶牛皮消的块根,是泰山的“四大名药”之一,其味甘、苦,性微温,具有补肝肾、益精血、乌须发、止心痛、壮筋骨和延年益寿之功效[1]。白首乌块根中的化学成分复杂,主要含有C21甾体酯苷类、磷脂类、苯乙酮类等,具有抗氧化、抗肿瘤、抗缺氧、调节免疫功能、降血脂等多种药理活性[2-3]。据报道,其中苯乙酮类成分能够保护肝细胞以及具有抗氧化活性[3-4],目前对这类成分的研究还不够深入,并且没有对其根皮进行分离的报道。本文对泰山白首乌根皮粗提物中的苯乙酮类成分进行分离制备,建立了白首乌中苯乙酮类成分的高效分离制备方法,对白首乌药材及产品的开发利用以及苯乙酮类成分的药理研究都具有重要意义。
高速逆流色谱(HSCCC)是不需要固态载体的液-液分配色谱技术,相比传统色谱法克服了固相载体对样品造成的吸附损失、变性、耗时长、溶剂消耗量大、分离效率低等缺点,该法操作简便、快速、高效,已被广泛应用于天然产物的分离纯化[5-9]。本研究采用硅胶柱色谱法对白首乌根皮粗提物进行初步纯化,然后对所得组分分别采用HSCCC进行分离制备,实现了对白首乌中苯乙酮类化合物的快速、有效的分离,为白首乌根皮的开发利用提供了参考依据。
1 仪器与材料
TBE300A型高速逆流色谱仪(上海同田生物技术有限公司)、多层聚四氟乙烯螺旋管(直径1.6 mm,分离体积300 mL,β值为0.47~0.73)、TBP泵(上海同田生物技术有限公司)、8823B-紫外检测器(北京宾达英创科技有限司)、3057-11记录仪(重庆川仪总厂有限公司);Waters 600-996高效液相色谱系统[配有光电二极管阵列检测器(PDA),美国Waters公司];Varian INOVA-600核磁共振波谱仪(Varian公司,美国);硅胶柱直径2.5 cm。
高效液相色谱所用乙腈为色谱纯 (美国天地公司),水为娃哈哈纯净水;硅胶柱色谱和HSCCC分离用溶剂均为分析纯(济南巨业化学试剂有限公司),所用水为过滤蒸馏水;硅胶(200~300目) 及GF254硅胶板(青岛海洋化工厂)。白首乌药材来自泰山白首乌种植基地(泰安),经山东中医药大学徐凌川教授鉴定为萝藦科泰山白首乌CynanchumbungeiDecne的根皮。
2 方法与结果
2.1 白首乌根皮粗提物的制备
称取干燥的泰山白首乌根皮100 g,粉碎并过20目筛,加入95%乙醇800 mL,加热回流提取3次,每次2 h,过滤,合并滤液,减压回收乙醇至无醇味。加蒸馏水稀释至150 mL,先用等体积的石油醚脱脂3次,再用等体积的乙酸乙酯萃取3次,合并乙酸乙酯萃取液,减压蒸干,得到粗提物8.7 g,用于进一步的分离制备,其HPLC色谱图如图1所示。
2.2 硅胶柱色谱初步分离
白首乌粗提物中的各成分含量差别较大,尤其是化合物5的含量较多,直接以白首乌粗提物进行HSCCC分离时,化合物5会干扰其他组分的纯度,所以本实验考虑通过硅胶柱色谱将目标成分进行初步纯化,再分别进行HSCCC分离制备。
取2.5 g粗提物经硅胶柱色谱初步分离。先用500 mL石油醚-乙酸乙酯(95∶5)冲洗,再用石油醚-乙酸乙酯(75∶25)洗脱,并收集该部分的洗脱液,减压蒸干得组分A 320 mg。当洗脱液接近无色时,换用100%乙酸乙酯冲洗,所收集的洗脱液减压蒸干得组分B 660 mg,4 ℃冰箱中保存备用。组分A和B的HPLC色谱图如图1所示。
2.3 HSCCC溶剂体系的选择
在高速逆流色谱中,合适的溶剂体系是获得理想分离的关键。一般而言,对HSCCC最合适的分配系数KD值的范围是0.5~2。若KD小于0.5,则出峰时间太快,组分峰之间的分离较差。若KD大于2.0,则出峰时间较长,峰形变宽[10]。本实验根据所分离化合物的理化性质,考察了石油醚-乙酸乙酯-甲醇-水两相溶剂体系,调整溶剂体积比并测定各目标化合物的KD值,结果见表1。发现石油醚-乙酸乙酯-甲醇-水(4∶6∶4.5∶5.5)体系比较适合分离,以白首乌粗提物作为样品进行HSCCC分离,所得的各成分经HPLC分析,纯度不高,且主要受化合物5影响。故运用硅胶柱进行初步分离,将粗提物分成组分A、B两部分,适度调整HSCCC溶剂体系,最终确定组分A的溶剂体系为石油醚-乙酸乙酯-甲醇-水(4∶6∶4.5∶5.5,V/V),组分B的溶剂体系为石油醚-乙酸乙酯-甲醇-水(4∶6∶3∶7,V/V)。
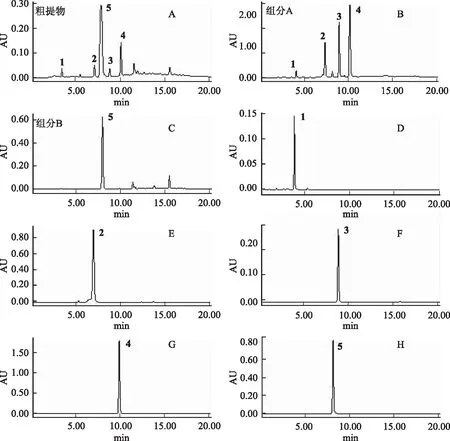
注:A.粗提物;B.组分A;C.组分B;D.化合物1;E.化合物2;F.化合物3;G.化合物4;H.化合物5。图1 白首乌根皮粗提物及提取的化合物HPLC图

表1 5个化合物在不同配比体系中的分配系数
2.4 HSCCC分离制备
在分液漏斗中配制石油醚-乙酸乙酯-甲醇-水(4∶6∶4.5∶5.5,V/V)两相溶剂体系,约2000 mL,充分振摇后静置分层,将上相和下相分离后,超声脱气15 min,备用。准确称取组分A 260 mg,用上下相各5 mL振荡溶解,以备HSCCC分离。
在分液漏斗中配制石油醚-乙酸乙酯-甲醇-水(4∶6∶3∶7,V/V)两相溶剂体系,约1800 mL,并剧烈振荡,静置分层,将上相和下相分离后,超声脱气15 min,备用。准确称取组分B 300 mg,用上下相各6 mL振荡溶解,以备HSCCC分离。
首先将脱气的上相(固定相)以15 mL·min-1的速度泵入HSCCC分离管,待固定相充满整个分离管后,调节主机转速至850 r·min-1,同时以2.0 mL·min-1的速度泵入下相(流动相),待有流动相从分离柱出口流出时,表明两相溶剂在分离管中已达到动态平衡,此时,由进样阀注入样品溶液,并打开检测器和记录仪,检测波长调为254 nm,根据色谱图手动接收目标成分,分离结果如图2所示。从260 mg组分A中分离制备得到对苯二酚3.9 mg (1)、4-羟基苯乙酮17.1 mg (2)、2,5-二羟基苯乙酮13.3 mg (3)和2,4-二羟基苯乙酮21.0 mg (4);从300 mg组分B分离得到白首乌二苯酮136 mg (5)。

注:A.组分A;B.组分B;1.对二苯酚;2.4-羟基苯乙酮;3.2,5-二羟基苯乙酮;4.2,4-二羟基苯乙酮;5.白首乌二苯酮。图2 组分A和组分B的高速逆流色谱图
2.5 HPLC检测分析
HPLC条件:Warters Symmetry RP18柱(250 mm×4.6 mm,5 μm)。流动相为乙腈(A)-水(B),线性梯度洗脱程序:0~20 min,30~100% A;20~30 min,100% A。流速:1.0 mL·min-1,DAD检测波长范围:200~400 nm。
采用上述的色谱条件,对分得的各成分进行HPLC分析,结果如图1所示。用峰面积归一化法测得化合物1~5的纯度分别为97.0%、96.6%、99.2%、99.7%和99.5%。
2.6 结构鉴定
化合物1:白色结晶(CH3OH);1H-NMR (DMSO-d6,600 MHz)δ:6.63(2H,s);13C-NMR (DMSO-d6,150 MHz)δ:149.7,115.6。以上波谱数据与文献[11]的数据基本一致,故鉴定该化合物为对苯二酚。
化合物2:无色针晶(CH3OH);1H-NMR (DMSO-d6,600 MHz)δ:2.54 (3H,s),6.8 (2H,d,J=8.7 Hz,H-3,5),7.91 (2H,d,J=8.7 Hz,H-2,6);13C-NMR (DMSO-d6,150 MHz)δ:26.3 (COCH3),115.7 (C-3,5),128.0 (C-1),131.1 (C-2,6),162.6 (C-4),198.9 (C=O)。以上数据与文献[12]的数据基本一致,所以确定化合物2为4-羟基苯乙酮。
化合物3:黄色针晶(CH3OH);1H-NMR (DMSO-d6,600 MHz)δ:6.79 (1H,d,J=8.9 Hz,H-3),7.03 (1H,dd,J=8.8 Hz,2.8 Hz,H-4),7.23 (1H,d,J=2.7 Hz,H-6),2.60 (3H,s);13C-NMR (DMSO-d6,150 MHz)δ:26.2 (COCH3),115.7 (C-3),121.7 (C-4),126.1 (C-1),151.0 (C-5),152.5 (C-2),199.9 (C=O)。以上数据与文献[12]报道数据基本一致,确定化合物3为2,5-二羟基苯乙酮。
化合物4:淡黄色针晶(CH3OH);1H-NMR (DMSO-d6,600 MHz)δ:2.53 (3H,s),7.72 (1H,d,J=8.6 Hz,H-6),6.26 (1H,d,J=2.3 Hz,H-3),6.39 (1H,dd,J=8.7 Hz,2.,H-5);13C-NMR(DMSO-d6,150 MHz)δ:26.6(COCH3),105.0(C-3),108.9(C-5),112.0 (C-1),132.1(C-6),164.3(C-4),166.0(C-2),202.0(C=O)。该化合物数据与文献[13]的数据基本一致,所以确定化合物4为2,4-二羟基苯乙酮。
化合物5:淡黄色针晶(CH3OH);1H-NMR (DMSO-d6,600 MHz)δ:2.20 (3H,s),2.57 (3H,s,COCH3),6.50 (1H,d,J=8.9 Hz),6.81 (1H,d,J=8.7 Hz),6.94 (1H,d,J=8.7 Hz),7.78 (1H,d,J=8.9 Hz);13C-NMR (DMSO-d6,150 MHz)δ:26.3 (C-5),30.9 (C-10),107.8 (C-5),111.6 (C-1),112.7 (C-1),117.8 (C-1′),116.1 (C-3′),118.4 (C-4′),130.2 (C-6′),132.4 (C-4),147.3 (C-2′),148.3 (C-5′),162.1 (C-6),162.6 (C-2),203.3 (C-8),203.1 (C-7)。上述数据与文献报道[13]的白首乌二苯酮数据基本一致,确定化合物5为白首乌二苯酮。
3 结论
实验采用硅胶柱联合HSCCC的方法从白首乌根皮中分离制备得到5个化合物,其纯度均在95%以上。结果表明,这两种技术的结合能有效地分离制备苯乙酮类化合物,为苯乙酮类物质的进一步研究开发奠定了基础。本方法简便、高效、快速,为其他天然产物的分离制备提供了参考。
[1] 中国医学科学院药物研究所.中药志II[M].北京:人民卫生出版社,1982:238-336.
[2] 彭蕴茹,丁永芳,李友宾,等.白首乌研究现状[J].中草药,2013,44(3):370-378.
[3] 印敏,冯煦,董云发,等.白首乌化学成分与药理活性研究进展[J].中国野生植物资源,2004,23(2):8-11.
[4] 徐凌川,张华,许昌盛.白首乌化学成分与药理现代研究述评[J].中华中医药学刊,2003,21(11):1893-1895.
[5] 张天佑,王晓.高速逆流色谱技术[M].北京:化学工业出版社,2011.
[6] 章能胜,王金彬,汪小艳,等.高速逆流色谱法从蝙蝠蛾拟青霉中快速分离制备麦角甾醇纯品[J].色谱,2010,28(1):68-72.
[7] 彭爱一,曲学伟,李慧,等.高速逆流色谱分离纯化九里香中的黄酮类化合物[J].色谱,2010,28(4):383-387.
[8] 蓝天凤,于宗渊,王岱杰,等.硅胶柱色谱结合高速逆流色谱法分离纯化丹参中丹参酮[J].中草药,2011,42(3):466-469.
[9] Liu Z B,Sun Y S,Wang J H.Preparative isolation and purification of acetophenones from the Chinese medicinal plantCynanchumbungeiDecne.by high-speed counter-current chromatography[J].Separation and Purification Technology,2008,64:247-252.
[10] Ito Y.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-currentchromatography[J].J Chromatogr A,2005,1065:145-158.
[11] 胡琳,丁智慧,刘吉开.灰黑拟牛肝菌的化学成分[J].云南植物研究,2002,24(5):670.
[12] 林爱群.泰山白首乌化学成分的提取、分离与鉴定[D].济南:山东中医药大学,2005.
[13] 龚树生,刘成娣,刘锁兰,等.白首乌化学成分的研究[J].药学学报,1988,23(4):276-280.
SeparationandPurificationofAcetophenonesfromCynanchumbengeiDecneRootBarkbyCombinationofSilicaGelandHigh-speedCounter-currentChromatography
LIHuaizhi1,2,XULingchuan1,WANGXiao2,LIJia1*,YANGPeng3,YANGBingtian3
( 1.ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;2.ShandongAnalysisandTestCenter,Jinan250014,China;3.SanfengBiologicalEngineeringTechnologyCo.Ltd.,Jinan250014,China)
Objective:To develop a method for separation and purification of acetophenones fromCynanchumbengeiDecne root bark by combination of silica gel and high-speed counter-current chromatography (HSCCC).MethodsThe crude extract ofC.bengeiwas separated by silica gel chromatography and part A and B were obtained.Then,part A and B were separated by HSCCC with a two-phase solvent system composed of petroleum ether-ethyl acetate-methanol-water (4∶6∶4.5∶5.5,V/V) and (4∶6∶3∶7,V/V),respectively.ResultsFrom 260 mg of part A,four compounds with p-dihydroxybenzene 3.9 mg (1),4-hydroxyacetophenone 17.1 mg (2),2,5-di-hydroxyacetophenone 13.3 mg (3) and 2,4-dihydroxyaceto-phenone 21.0 mg (4) were obtained.And from 300 mg of part B,baishouwubenzoph-enone 136 mg (5) were obtained.The compounds purity determined by HPLC were 97.0%,96.6%,99.2%,99.7%,99.5%,respectively.ConclusionThe established method is simple and efficient.It can be used for separation of acetophenones fromC.bengei.The results provide a reference basis forC.bengeiroot bark development and utilization.
Silica gel chromatography;high-speed counter-current chromatography (HSCCC);acetophenones;CynanchumbungeiDecne root bark
2015-08-31)
国家自然科学基金(81373941);山东省自然科学基金(ZR2012HM047);山东省科技发展计划(2014G2X219003);公益性行业科研专项(201407002)
*
李佳,教授,研究方向:中药质量控制与资源研究;E-mail:ljytl7172@163.com
10.13313/j.issn.1673-4890.2016.8.003

