转PRL基因小鼠遗传性状分析
任艳萍,谢亮亮,李海艳,石德顺*,李湘萍*
(1.广西大学亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 2.遵义医学院基础医学院,遵义 563003)
转PRL基因小鼠遗传性状分析
任艳萍1,2,谢亮亮1,李海艳1,石德顺1*,李湘萍1*
(1.广西大学亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 2.遵义医学院基础医学院,遵义 563003)
本研究以原核注射法生产的乳腺特异性表达PRL基因小鼠为模型,从外源基因遗传完整性、拷贝数和插入位点3方面对其进行遗传性状分析,为今后大型转基因动物的选育提供基础。采用基因组DNA PCR方法筛选发生外源基因片段部分缺失的小鼠,并进行Southern blot验证,以检测外源基因的遗传完整性;用绝对荧光定量PCR方法测定外源基因拷贝数,用Genome walking方法分析外源基因整合位点。结果显示,外源基因片段部分缺失率为1.91%;整合十几个拷贝外源基因的小鼠在便携UV灯下可见绿色荧光,整合2个拷贝的小鼠无绿色荧光;在NW_001073945.1序列的2 025~2 026 bp和NW_001030574.1序列的10 760 020~10 760 021 bp处插入的外源基因可正常表达。以上结果说明,外源PRL基因在原核注射法生产的转基因小鼠中可稳定遗传;在一定范围内,外源基因的表达量与拷贝数呈正相关;附近无其他基因的外源基因插入位点有利于外源基因的表达。
转基因动物;遗传性状;原核注射;外源基因插入位点;拷贝数
转基因动物技术在基础生物学、医学、发育生物学、药物开发及繁殖育种等领域中应用较广泛,常用的转基因动物方法包括原核注射法[1]、体细胞核移植法[2]、精子载体法[3]、逆转录病毒感染法[4]等。原核注射法由于可导入大基因片段、无体细胞核移植中的重编程不彻底[5]、无精子载体法中重复性差[5]、亦无逆转录病毒感染法中存在病毒DNA序列整合等问题,其在转基因动物,特别是转基因小鼠生产中得到了广泛的应用。
原核注射法所生产的转基因动物,外源基因的整合位点存在随机性,因此外源基因在转基因动物体内是否表达以及表达水平的高低受遗传完整性[6-8]、外源基因拷贝数[9-10]和外源基因插入位点[11]等诸多遗传性状的影响。因此,在转基因动物后代的选育中,有必要对其遗传性状进行分析。但大型转基因动物存在选育周期长,费用高等问题。为此,本研究以原核注射转基因小鼠为模型,从外源基因遗传完整性、外源基因拷贝数以及外源基因插入位点3方面,对已建立的乳腺特异性表达PRL基因小鼠模型的遗传性状进行了分析。为今后转基因水牛等大型转基因动物后代的选育奠定基础。
1 材料与方法
1.1转基因小鼠的扩繁
挑选经基因组DNA PCR鉴定的转PRL基因小鼠,定为F0代。将F0代转基因小鼠与野生型同种FVB小鼠杂交得到F1代,并在出生后3 d用便携式长波UV灯观测子代小鼠绿色荧光表达情况。
1.2转基因小鼠PCR鉴定
将出生21 d的小鼠用4%苦味酸进行编号,用酚/酚仿/氯仿依次抽提法,提取小鼠尾尖组织的基因组DNA。分别以T-PRL和CMV 为引物扩增外源PRL基因和cmv启动子;mACTB为引物扩增内参基因β-actin片段(表1)。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,60.5 ℃退火30 s,72 ℃延伸55 s,35个循环;72 ℃延伸6 min;4 ℃保存。
表1转基因小鼠检测引物
Table 1Primers used in the transgenic mice detection
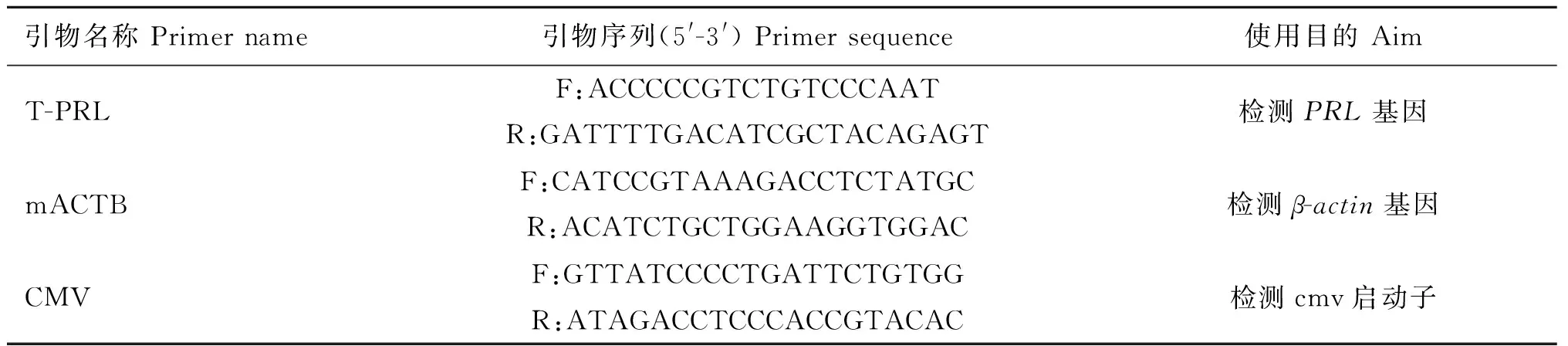
引物名称Primername引物序列(5'-3')Primersequence使用目的AimT-PRLF:ACCCCCGTCTGTCCCAATR:GATTTTGACATCGCTACAGAGT检测PRL基因mACTBF:CATCCGTAAAGACCTCTATGCR:ACATCTGCTGGAAGGTGGAC检测β-actin基因CMVF:GTTATCCCCTGATTCTGTGGR:ATAGACCTCCCACCGTACAC检测cmv启动子
1.3Southern blot分析
利用Roche公司DIG High Prime DNA Labeling and Detection Starter Kit对转基因小鼠基因组DNA进行Southern blot鉴定。首先,用BamH I和KpnI酶切pPRL质粒,胶回收纯化PRL片段,地高辛标记后作为探针贮存在-20 ℃备用。用BamH I酶切20 μL小鼠基因组DNA,乙醇沉淀后按试剂盒中所述步骤进行Southern blot操作。
1.4外源基因拷贝数分析

表2外源基因拷贝数分析引物
Table 2Primers used in detecting the copy number of exogenous gene
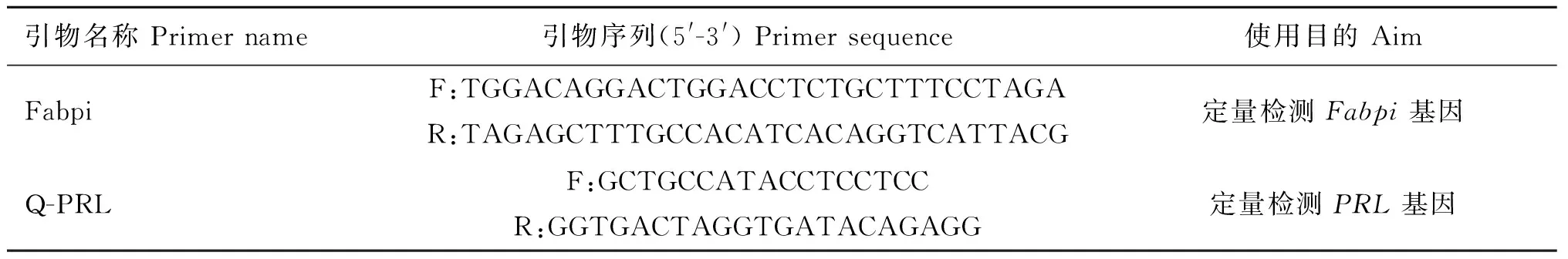
引物名称Primername引物序列(5'-3')Primersequence使用目的AimFabpiF:TGGACAGGACTGGACCTCTGCTTTCCTAGAR:TAGAGCTTTGCCACATCACAGGTCATTACG定量检测Fabpi基因Q-PRLF:GCTGCCATACCTCCTCCR:GGTGACTAGGTGATACAGAGG定量检测PRL基因
1.5外源基因整合位点分析
用Genome walking方法分析外源基因整合位点。首先在距转基因载体5′端约500 bp处,由内向外依次设计3条退火温度为65 ℃的下游引物(表3)。按照Genome walking试剂盒说明书步骤(图1),以小鼠基因组DNA作为模板,用cmvSp1、cmvSp2、cmvSp3引物与随机引物进行3次曹氏PCR扩增并将扩增产物经胶回收纯化后、TA克隆到pMD-18T载体中测序。所得序列先与转基因载体行同源性比对,并将未对比上的序列与小鼠基因组序列进行Blast比对,以确定外源基因的整合位点。

图1 Genome walking方法及引物示意图Fig.1 Sketch map of Genome walking method and primers
表3外源基因整合位点分析引物
Table 3Primers used in Genome Walking analysis

引物名称Primername引物序列(5'-3')Primersequence使用目的AimcmvSp1CGTGAGTCAAACCGCTATCCcmv端引物cmvSp2ACCGCATCACCATGGTAATAGcmv端引物cmvSp3CCTATTGGCGTTACTATGGGAAcmv端引物
2 结 果
2.1外源基因在F1代转基因小鼠中的遗传完整性分析
将F0代转PRL基因小鼠与野生型FVB小鼠杂交得到F1代小鼠。以野生型小鼠DNA为阴性对照,ddH2O为空白对照,基因组PCR分别扩增目的基因PRL以及标记基因启动子cmv片段。结果显示,2、3、4和5号样品可扩增得到 752 bp的PRL片段;2、3、4、5和7号样品可扩增得到599 bp的cmv片段(图2A)。其中7号小鼠基因组外源PRL片段缺失,仅有cmv片段。为验证PCR结果的准确性,以PRL基因为探针,通过Southern blot方法检测这几只小鼠。结果显示,2、3、4和5号小鼠有外源PRL片段整合(图2B),与基因组PCR结果一致,表明基因组PCR的结果准确可信。对16窝共157只F1代小鼠基因组进行基因组PCR分析,共发现3只小鼠基因组中存在外源基因片段部分缺失,且缺失片段均为PRL,缺失发生率为1.91%(表4)。以上结果表明,外源基因在遗传过程中有一定的概率发生片段缺失,但概率较低;多数情况下,外源基因可完整地遗传给后代。
2.2转PRL基因小鼠外源基因拷贝数分析
比对转基因小鼠的荧光检测结果与基因组PCR结果发现,部分携带外源基因的小鼠在便携UV灯下无绿色荧光,推测这可能与外源基因的拷贝数有关。为此,选择3只经鉴定携带外源基因的小鼠,UV灯下1号和2号有明显的绿色荧光,3号无绿色荧光。采用绝对定量荧光PCR法分析外源PRL基因的整合数。分别对pPRL和pFabpi的标准品做回归曲线,R2分别为0.995和0.998,扩增效率分别为105.154%和105.191%(图3),表明本次荧光定量PCR结果可信。定量分析结果显示,1号和2号小鼠的外源基因拷贝数较高,分别为14.0和12.1个,3号小鼠的外源基因拷贝数较低,为1.9个拷贝(表5)。结果表明,外源基因的表达情况与外源基因拷贝数呈正相关。
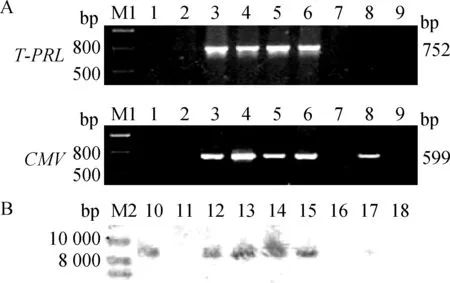
A.基因组PCR结果;B.Southern blot结果;M1.DNA相对分子质量标准;M2.DNA相对分子质量标准;1、18.野生型小鼠;2、11.F1代1号小鼠;3、12.F1代2号小鼠;4、13.F1代3号小鼠;5、14.F1代4号小鼠;6、15.F1代5号小鼠;7、16:F1代6号小鼠;8、17:F1代7号小鼠;9.空白对照;10.阳性对照A.PCR results of the genome DNA;B.Results of Southern blot detection;M1.DNA Marker III;M2.1 kb DNA Ladder;1,18.The wild-type mouse;2,11.The mouse No.1 in the F1 generation;3,12.The mouse No.2 in the F1 generation;4,13.The mouse No.3 in the F1 generation;5,14.The mouse No.4 in the F1 generation;6,15.The mouse No.5 in the F1 generation;7,16.The mouse No.6 in the F1 generation;8,17.The mouse No.7 in the F1 generation;9.The blank control;10.The positive control图2 外源基因遗传稳定性分析Fig.2 The genetic stability analysis of exogenous gene
2.3转PRL基因小鼠外源基因整合位点分析
选择2只在便携UV灯下有明显绿色荧光的转基因小鼠,以其基因组DNA为模板,用Genome walking法分析外源基因整合位点。电泳结果显示,经过3次PCR,2个小鼠基因组均可扩增出一条2 000~3 000 bp的特异性片段(图4A为1号小鼠,2号小鼠图片未给出)。回收纯化该片段(1号小鼠如图4B,2号小鼠图片未给出)并TA克隆到pMD-18T载体中,得到5 026~6 133 bp的pMD-18T-cmvSp3质粒(1号小鼠如图4C,2号小鼠图片未给出)。经测序,将得到的序列分别与转基因载体5′端cmv序列进行比对,发现1号和2号小鼠的序列中有210 bp的cmv同源序列,同源率100%(1号小鼠如图4D,2号小鼠的图片未给出)。去除cmv同源序列,将剩余未知序列与小鼠基因组进行Blast对比,结果发现1号和2号小鼠分别与小鼠基因组中的NW_001073945.1和NW_001030574.1序列同源性较高,分别为99%和84%(1号小鼠如图4E,2号小鼠的图片未给出)。其中,NW_001073945.1序列全长2 464 bp,尚未定位到染色体中,未发现该段序列中存在基因编码,外源基因于2 025~2 026 bp处反向插入;NW_001030574.1位于15号染色体中,外源基因于10 760 020~10 760 021 bp处反向插入,该位点上下游20 kb内无基因编码。以上结果说明,这2只表达外源基因的转基因小鼠,外源基因插入位点附近均无其他基因编码。
表4外源基因部分片段缺失率
Table 4The losing rate of exogenous gene fragment

代数Generation窝数Nest总只数Number片段缺失只数Thenumberoflosingfragment缺失率/%ThelosingrateF16615731.91
表5外源基因整合数分析结果
Table 5The copy number of exogenous gene in transgenic mice genome

编号Number基因Gene平均Ct值TheCtaveragevalue拷贝数Thecopynumber整合数Theintegrationnumber1PRLFapbi16.61920.537221945115818514.02PRLFapbi17.45021.24712213289497112.13PRLFapbi19.32720.5113168741612181.9

图3 外源基因整合数分析的标准曲线Fig.3 The standard curve for the copy number analysis of exogenous gene in transgenic mice genome
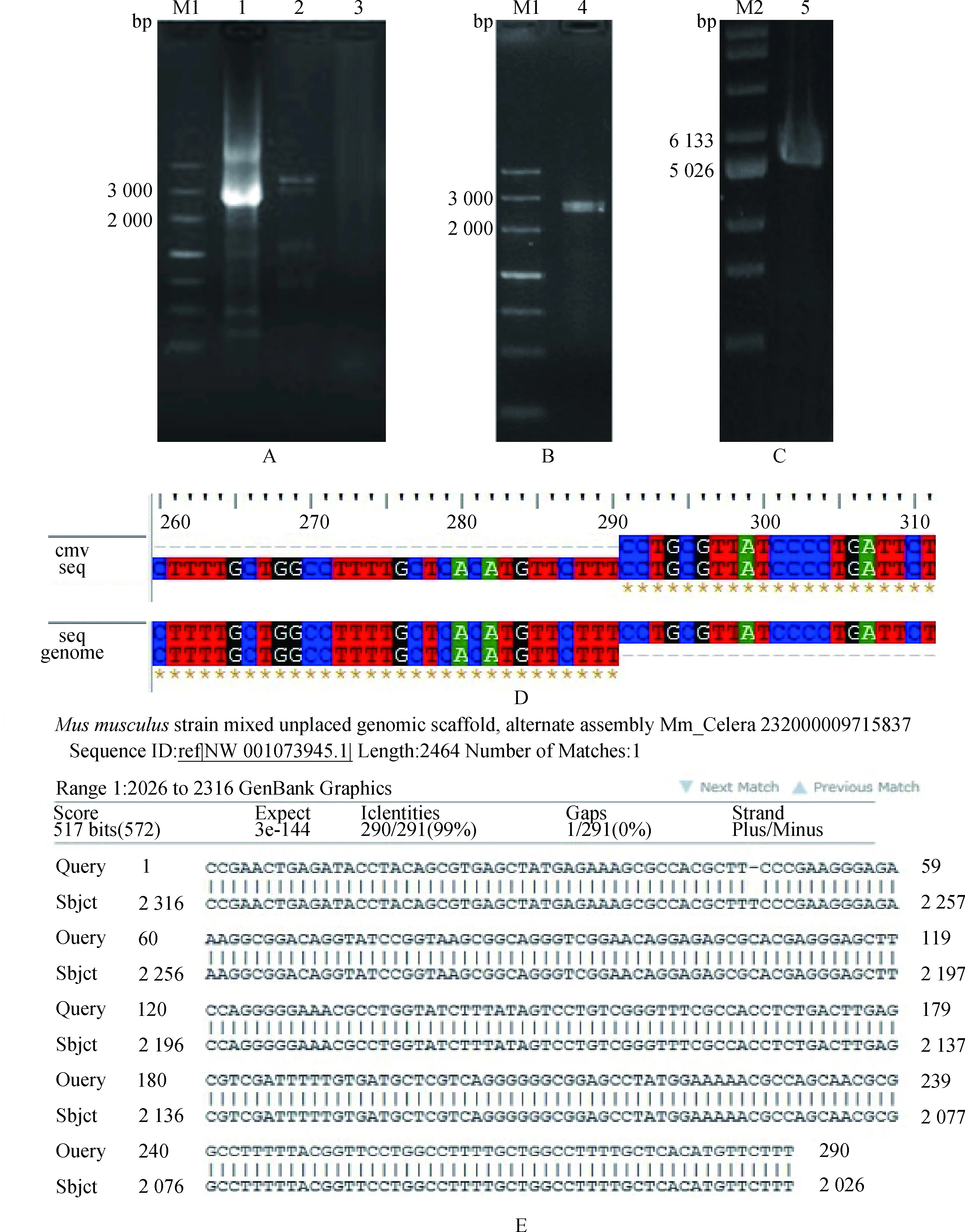
A.Genome walking PCR;B.第三次PCR产物胶回收;C.质粒pMD-18T-cmvSp3;D.同源性分析;E.NCBI Blast结果;M1.DNA相对分子质量标准;M2.DNA相对分子质量标准;1.cmvSp3引物PCR产物;2.cmvSp2引物PCR产物;3.cmvSp1引物PCR产物;4.cmvSp3片段;5.质粒pMD-18T-cmvSp3A.Genome walking PCR;B.The third PCR fragment after purification;C.The pMD-18T-cmvSp3 vector;D.Homology analysis;E.Blast analysis with mouse genome from NCBI;M1.DNA Marker III;M2.Supercoiled DNA Ladder Marker;1.The third PCR results with cmvSp3 primer;2.The second PCR results with cmvSp2 primer;3.The first PCR results with cmvSp1 primer;4.cmvSp3 fragment;5.pMD-18T-cmvSp3 vector图4 外源基因整合位点分析结果Fig.4 The results of exogenous gene integration site in transgenic mice
3 讨 论
原核注射法生产的转基因动物中,外源基因随机插入基因组[12]。与外源基因插入位点相对应的同源染色体上对应序列,在同源染色体配对时,插入位点附近可能发生重组或修复,出现外源基因片段全部或部分丢失的现象。A.R.Migliaccio等在细胞水平上研究发现,仅有少数几个特定位点上的外源基因能够稳定遗传,绝大多数整合位点上的外源基因会在传代过程中发生丢失[13]。在转基因动物的研究中,外源基因可以稳定地遗传给后代[6-7]。颜景斌等利用多对引物PCR检测F0至F4代转基因小鼠,未发现外源基因片段丢失[8]。B.Aigner等研究发现,即使拷贝数高达73的转基因小鼠在与野生型小鼠杂交也未发现拷贝数丢失;但在插入位点不同转基因小鼠间杂交时,高拷贝转基因位点存在较低概率的拷贝数丢失的问题[14]。本研究对157只PRL转基因小鼠进行了外源基因完整性分析,发现 1.91%的位于转基因载体6.9 kb后的PRL片段缺失,表明外源基因在很大程度上可以稳定遗传给后代,但也存在一定的丢失概率,其丢失率可能受外源基因长度的影响。
已有研究发现,外源基因表达情况受插入位点附近基因的干扰,即转录干扰[11]。当一定空间内存在两个基因时,这两个基因表达量均显著低于仅有一个基因时的表达量[15]。转录干扰的强弱与两个基因的转录方向有关,相向型高,背离型最弱,顺势串联型居中[15]。本研究分析转基因小鼠的外源基因插入位点时发现,有明显绿色荧光蛋白表达的小鼠,其外源基因的插入位点附近上下20 kb无其他基因,不存在转录干扰问题,而本研究所验证的这两个基因插入位点NW_001073945.1序列的2 025~2 026 bp处和NW_001030574.1序列的10 760 020~10 760 021 bp处,可作为今后外源基因定点插入的候选插入位点。
外源基因表达水平除会受到其遗传稳定性和插入位点的影响外,还受外源基因拷贝数的影响。原核注射法生产的转基因动物,外源基因在同一个位点往往存在多个拷贝[16]。在一定范围内,外源基因的表达水平与其拷贝数成正比[10],但拷贝数过高时,外源基因的表达会被抑制甚至沉默。B.Aigner等发现转基因小鼠中外源基因的拷贝数与基因表达量在一定程度内呈正相关[9]。D.Garrick等研究表明,高拷贝致使外源基因甲基化程度增加,基因表达水平下降[17]。本试验用双酶切对转基因载体进行线性化,粘性末端不互补,所得转基因小鼠外源基因的拷贝数为2~14个,未发现高拷贝数转基因小鼠,外源标记基因的表达水平与拷贝数呈正相关,该结果与上述文献报道结果一致。
4 结 论
综上,本研究从外源基因的遗传稳定性、插入位点和拷贝数3个方面分析了转PRL基因小鼠的遗传性状。结果显示,在遗传稳定性上,存在较低的外源基因片段丢失率,在绝大多数情况下,外源基因可以稳定遗传给后代;在外源基因插入位点上,附近无其他基因存在的外源基因插入位点有利于外源基因的正常表达,而本研究所验证的两个插入位点可作为今后外源基因定点插入的候选位点;在一定的拷贝数范围内,外源标记基因的表达水平与拷贝数呈正相关,10个拷贝数以上的转基因小鼠方可用便携UV灯检测绿色荧光蛋白的表达。以上结果可为今后大型转基因动物的选育奠定基础。
[1]GORDON J W,SCANGOS G A,PLOTKIN D J,et al.Genetic transformation of mouse embryos by microinjection of purified DNA[J].ProcNatlAcadSciUSA,1980,77(12):7380-7384.
[2]WILMUT I,SCHNIEKE A E,MCWHIR J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385(6619):810-813.
[3]LAVITRANO M,CAMAIONI A,FAZIO V M,et al.Sperm cells as vectors for introducing foreign DNA into eggs:genetic transformation of mice[J].Cell,1989,57(5):717-723.
[4]JAENISCH R,MINTZ B.Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA[J].ProcNatlAcadSciUSA,1974,71(4):1250-1254.
[5]BRINSTER R L,SANDGREN E P,BEHRINGER R R,et al.No simple solution for making transgenic mice[J].Cell,1989,59(2):239.
[6]AIGNER A,JAGER M,PASTERNACK R,et al.Purification and characterization of cysteine-S-conjugate N-acetyltransferase from pig kidney[J].BiochemJ,1996,317(pt 1)(3):213-218.
[7]WANG Y,TAO S Y,LIU Q,et al.Quantitative analysis of lentiviral transgene expression in mice over seven generations[J].TransgenicRes,2010,19(5):775-784.
[8]颜景斌,肖艳萍,方彧聃,等.转基因小鼠中外源基因遗传及表达稳定性的研究[J].生物工程学报,2004,18(6):758-760.
YAN J B,XIAO Y P,FANG Y D,et al.The study on the stable inheritance and expression of foreign fene in transgenic mice[J].ChineseJournalofBiotechnology,2004,18(6):758-760.(in Chinese)
[9]AIGNER B,BREM G.Tyrosinase gene as a marker gene for studying transmission and expression of transgenes in mice[J].Transgenics,1994,1(994):417-429.
[10]BEERMANN F,RUPPERT S,HUMMLER E,et al.Rescue of the albino phenotype by introduction of a functional tyrosinase gene into mice[J].EMBOJ,1990,9(9):2819-2826.
[11]WALL R J.New gene transfer methods[J].Theriogenology,2002.57(1):189-201.
[12]PERRY A C,WAKAYAMA T,KISHIKAWA H,et al.Mammalian transgenesis by intracytoplasmic sperm injection[J].Science,1999,284(10):1180-1183.
[13]MIGLIACCIO A R,BENGRA C,LING J,et al.Stable and unstable transgene integration sites in the human genome:extinction of the Green Fluorescent Protein transgene in K562 cells[J].Gene,2000,256(1-2):197-214.
[14]AIGNER B,FLEISCHMANN M,MULLER M,et al.Stable long-term germ-line transmission of transgene integration sites in mice[J].TransgenicRes,1999,8(1):1-8.
[15]ESZTERHAS S K,BOUHASSIRA E E,MARTIN D I,et al.Transcriptional interference by independently regulated genes occurs in any relative arrangement of the genes and is influenced by chromosomal integration position[J].MolCellBiol,2002,22(2):469-479.
[16]LOIS C,HONG E J,PEASE S,et al.Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors[J].Science,2002,295(5556):868-872.
[17]GARRICK D,FIERING S,MARTIN D I,et al.Repeat-induced gene silencing in mammals[J].NatGenet,1998,18(1):56-59.
(编辑郭云雁)
The Genetic Traits Analysis ofPRLTransgenic Mice
REN Yan-ping1,2,XIE Liang-liang1,LI Hai-yan1,SHI De-shun1*,LI Xiang-ping1*
(1.StateKeyLaboratoryofSubtropicalBioresourceConservationandUtilization,GuangxiUniversity,Nanning530004,China;2.SchoolofBasicMedicalSciences,ZunyiMedicalUniversity,Zunyi563003,China)
In order to provide the foundation for breeding large transgenic animals in futher,in this study,the genetic traits of mammary gland-specificPRLtransgenic mice produced by pronuclear microinjection,were analyzed from the genetic integrity,the copy number and the inserting site of exogenous gene.The transgenic mice deleted partially exogenous gene were screened by genomic DNA PCR method,and were verified by Southern blot to detect the genetic stability of exogenous gene.The copy number of exogenous gene in transgenic mice was detected by absolute real-time fluorescence quantitative PCR method.The inserting site of exogenous gene in transgenic mice was analyzed by Genome walking method.The results showed that the losing rate of exogenous gene fragment was 1.91%.The green fluorescence signal was observed under the long-wave UV lamp in the transgenic mice integrated higher copies of exogenous gene,while not observed in the transgenic mice integrated 2 copies of exogenous genes.The exogenous gene expressed normally in the 2 025-2 026 bp site of NW_001073945.1 gene and the 10 760 020-10 760 021 bp site of NW_001030574.1 gene.The result indicated that the exogenous gene could be inherited stablely in the transgenic mice produced by pronuclear microinjection,the expression level was positively correlated with the copy number of exogenous gene in certain range,and it was beneficial for the exogenous gene expression while there was no other genes nearby the inserting site.
transgenic animal;genetic traits;pronuclear microinjection;the inserting site of exogenous gene;copy number
10.11843/j.issn.0366-6964.2016.09.015
2015-12-17
国家转基因重大专项(2014ZX08007-001);国家自然科学基金(31560632);广西自然科学基金项目(2014GXNSFAA118084)
任艳萍(1986-),女,河南人,博士,主要从事胚胎工程研究,E-mail:ypren@foxmail.com
石德顺,博士,研究员,主要从事胚胎工程研究,E-mail:ardsshi@gxu.edu.cn;李湘萍,博士,研究员,主要从事胚胎工程研究,E-mail:xiangpingli@163.com
S865.13
A
0366-6964(2016)09-1861-07

