功夫菊酯与镉复合污染对土壤微生物和镉生物可利用性的影响
李 洁,张思凡,肖 琳
(南京大学环境学院/ 污染控制与资源化国家重点实验室,江苏 南京 210023)
功夫菊酯与镉复合污染对土壤微生物和镉生物可利用性的影响
李 洁,张思凡,肖 琳①
(南京大学环境学院/ 污染控制与资源化国家重点实验室,江苏 南京 210023)
为探讨菊酯类农药和镉复合污染对土壤微生物功能和镉生物有效性的影响,分析了功夫菊酯和镉单一及复合作用下土壤微生物碳、呼吸率和酶活性的变化;同时采用同位素标记和薄膜扩散梯度(diffusive gradients in thin-films,DGT)技术分析了土壤微生物群落抗性和镉的生物有效性。结果表明,镉在复合污染中起主导作用,但功夫菊酯与低浓度镉的复合作用可协同促进微生物活性;功夫菊酯能促进微生物群落对镉的抗性,提高镉的生物可利用性,并可能提高镉在植物中的累积。
镉;功夫菊酯;复合污染;土壤微生物;生物有效性
我国土壤w(镉)的平均污染值为0.27 mg·kg-1,最高甚至达152.95 mg·kg-1。中华人民共和国环境保护部和中华人民共和国国土资源部发布的《全国土壤污染状况调查公报2014》显示,我国土壤镉的点位超标率为7%,位列5大重点监控重金属元素之首。镉容易被农作物吸收并在作物可食用部位累积,并通过食物链危害人体健康。除重金属外,为保障作物产量而大量施用的杀虫剂等农药残留也是土壤污染物之一。其中,菊酯类农药因对人畜的毒副作用小,对害虫的杀灭率高而在过去30 a 被广泛采用,占据了全球约1/4的杀虫剂市场[1]。但菊酯类农药具有对光、热稳定的特点,很难在自然条件下快速降解,且疏水性高,容易吸附在土壤颗粒上而在土壤中长期留存[2]。镉和菊酯类农药残留共存于土壤中而形成复合污染,不仅影响其在土壤中的化学形态、迁移转化和生物可利用性[3-4],也会对土壤生态系统产生影响。
微生物对土壤有机质的降解和营养元素的释放有重要意义,如果微生物群落和数量发生了变化,土壤C、N、P的转化也会受到影响,进而影响到土壤功能、质量和产出,最终影响农作物的产量和质量[5]。目前对镉和菊酯类农药的复合作用的研究尚较少。了解镉和菊酯类农药复合污染对土壤微生物、对镉的生物有效性的影响以及对植物修复和食品安全都具有重要意义。
1 材料与方法
1.1 材料和试剂
试验用土采自南京市紫金山,其理化性质如下:w(有机质)为9.15 g·kg-1,pH 值为7.69,阳离子交换量(CEC)为11.50 mol·kg-1,w(镉)为 0.18 mg·kg-1。土样经充分混匀后,移除石块、大的植物残体和土壤动物。
3H亮氨酸(3H-leucine)为中国原子能科学研究院产品(放射性比活度均为28 Ci·mmol-1)。功夫菊酯(cyhalothrin,CHT)购自高淳农药厂。其余试剂均为国产分析纯。
1.2 试验设计
GB 15618—1995《土壤环境质量标准》中镉的二级标准为1 mg·kg-1(pH值>7.5),因此选择w(镉)为0、2、10 mg·kg-1分别代表土壤中未受镉污染、低浓度镉污染和较高浓度镉污染。土壤中菊酯类农药(CHT)残留通常为10 mg·kg-1[6],因此选择50和150 mg·kg-1这2种CHT污染浓度进行研究。
取100 g土样(总土样质量的1/4),将CHT 用丙酮溶解后添加至其中。将CdCl2用去离子水配制成溶液,并添加到CHT染毒土壤中。待丙酮挥发后,将染毒土样与剩余的3/4土样充分研磨混合。使w(CHT)的最终值分别为0(C0)、50(C1)和150 mg·kg-1(C2);w(镉)的最终值分别为0(M0)、2(M1)和10 mg·kg-1(M2),将所有处理的土壤用蒸馏水调节至w为60%的最大田间持水量,25 °C条件下黑暗培养,分别于第0、30和 60天取样分析。
1.3 土壤微生物生物碳和基础呼吸测定[7]
土壤生物量碳采用氯仿熏蒸-0.5 mol·L-1K2SO4提取法,提取液中C浓度用TOC分析仪(Shimadzu TOC 500)测定。土壤基础呼吸率采用直接吸收法(密闭法)测定。
1.4 土壤酶活测试
过氧化氢酶活性测定参考关松荫等[8]的方法。脲酶和碱性磷酸酶活性测定参照TABATABAI[9]的方法。过氧化氢酶活性以1 g干土20 min内消耗的0.02 mol·L-1K2MnO4溶液体积表示;脲酶活性以1 kg干土24 h内分解尿素所释放的铵态氮质量表示;碱性磷酸酶活性以酶促反应在1 h内生成1 mg酚所需的酶量表示。
1.5 土壤微生物群落抗性分析(PICT)[10]
取10 g新鲜土壤,加入100 mL纯水后250 r·min-1振荡15 min,然后以2 115 r·min-1转速离心10 min(离心半径为20 cm),取上清液(土壤微生物悬液),添加6.4 mmol·L-1MOPS缓冲液至最终浓度为0.2 mmol·L-1,分装在离心管中,每管1.5 mL。22 ℃预培养30 min后,加入不同浓度CdCl2,然后加入50 μL 3H-亮氨酸溶液,使其最终浓度为10-6mL-1(以Ci计);CK组添加相应量的蒸馏水。培养3 h后加入160 μLw为50%的三氯乙酸(TCA)以终止反应。经离心洗涤后用液闪计数器测试放射性物质含量。细菌群落抗性用IC50来表示。
1.6 镉的生物可利用性分析(DGT)[11]
取50 g 土样,加纯水调节至90%~100%最大持水量,培养24 h后,将DGT 单元(0.82 mm 开孔扩散凝胶,0.40 mm Chelex胶,接触面积3.14 cm2)插入泥浆中24 h后取出,取出Chelex胶放在1.5 mL离心管中,用1 mol·L-1的HNO3(BV-Ⅲ级)浸泡24 h,镉通过电感耦合等离子体质谱仪(ICP-MS; Elan 9000,Perkin-Elmer)测定。提取液中金属质量(M)被转化为单位时间内土壤-扩散凝胶界面的金属浓度(CDGT),使用下列公式计算:
M=Ce(VHNO3+Vgel)/fe,
(1)
CDGT=M×Δg/(D×t×A)。
(2)
式(1)~(2)中,M为HNO3提取出Chelex胶中的金属质量,ng;Ce为1 mol·L-1HNO3提取液中金属浓度,ng·mL-1;VHNO3为HNO3体积,mL;Vgel为Chelex胶体积,mL;fe为HNO3对Chelex胶中重金属的提取系数,通常取0.8;Δg为扩散层厚度,cm;D为重金属在扩散项的扩散系数,cm2·s-1;t为DGT 装置浸在沉积物中的时间,h;A为凝胶层面积,cm2。
1.7 统计分析
采用SPSS 17.0软件进行LSD 检验和相关性分析。
2 结果与讨论
2.1 土壤生物量碳和基础呼吸率
土壤微生物量碳(Cmic)贡献了50%以上的总可提取态溶解性有机质,约45% 的腐殖酸类物质和80%以上的土壤氮含量[12],对土壤中的物质循环和维持生态系统稳定具有重要意义,也是土壤质量和微生物变化的敏感标志物。如图1所示,各组Cmic随时间增长均有所下降,60 d时除CK组外,其余处理Cmic的量降至初始值的一半以下,可能是由于在封闭环境中微生物可利用的碳源物质越来越少所致。30 d内,M1C0、M2C0处理Cmic与CK处理相比无显著差异,说明在10 mg·kg-1高浓度镉条件下,镉对微生物的生长也没有显著抑制作用。M0C1和M0C2处理Cmic随CHT添加量的增加而增加,表现出促进作用。在添加150 mg·kg-1CHT的土壤中,在30 d时M1C2处理Cmic显著高于M0C2和M2C2处理,这表明低浓度镉与CHT对微生物生长具有协同促进作用,高浓度镉与CHT则具有协同抑制作用。
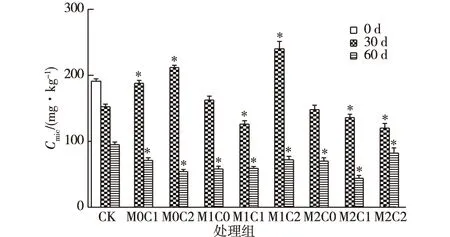
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间微生物量碳差异显著(P<0.05)。
如图2所示,在30 d时,M1各处理组呼吸率较CK处理均有所增加,M2处理组呼吸率却显著降低,表明高浓度镉对微生物的呼吸有抑制作用。土壤呼吸率的增加一般源于易利用碳源所产生底物的促进作用,或者污染物所产生的胁迫作用。在低浓度镉作用下,微生物需要更多的能量去抵御不利环境,致使大部分碳源被用于产能,并以CO2形式排出。另外,镉的毒性会提高土壤微生物死亡率,死亡的微生物作为底物又被分解利用,促进了CO2的产生[13]。当镉浓度继续增加,毒性超过了微生物能够耐受的范围,就会造成微生物的死亡和代谢活性下降。仅添加CHT处理组土壤呼吸率无显著影响,与CHT对生物量的促进不同,CHT的添加并未促进呼吸率的增加。这可能是因为CHT易被微生物降解,其半衰期只有6.7 ~11 d[14],在30 d时,所添加的CHT已被降解,不再增加呼吸率。史婕等[15]在紫色土联苯菊酯对微生物数量和活性的影响研究中也发现了类似规律,土壤细菌数在第6天达到峰值后逐渐降低,并在16 d后基本恢复至对照水平。
CHT的添加促进了M1C1和M1C2处理土壤的呼吸,这与Cmic的结果类似,也表明低浓度Cd与CHT的复合对一些微生物生理活动有较强的协同促进作用。这与前人对原油和重金属复合污染的研究类似[16],说明CHT能促进低浓度镉对土壤微生物活性的激活作用,加快有机质的分解转化速率,但这种协同促进作用不利于土壤中有机质的累积。CHT与高浓度镉(10 mg·kg-1)的复合(M2C1和M2C2处理)则对呼吸率具有协同抑制作用,这可能是由于CHT与镉形成复合物后,提高了镉的生物可利用性,促进了镉的跨膜运输[17],造成镉的毒性增强,从而抑制了微生物的代谢活性。在60 d时,M2各处理组呼吸率有所回升,其中M2C2组甚至高于CK组,可能是由于经过较长时间,某些微生物已经适应了重金属污染环境,活性得到恢复,在有CHT作为碳源的情况下,呼吸作用出现回升。
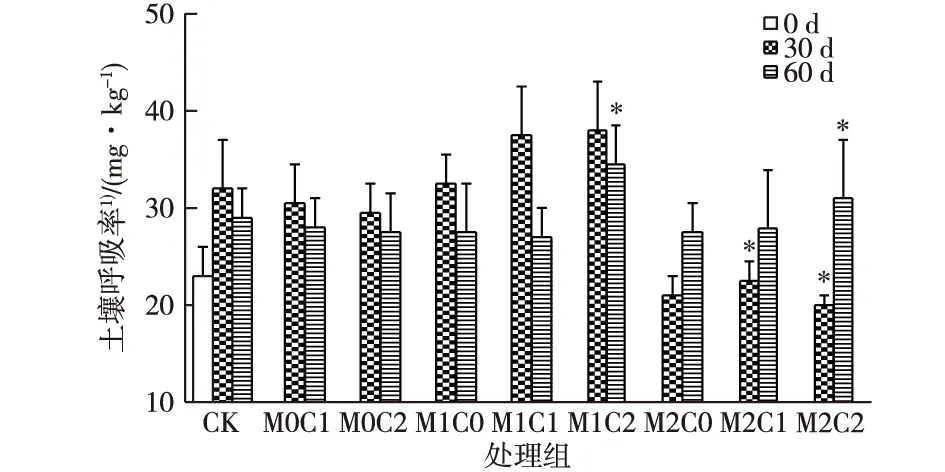
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间土壤呼吸率差异显著(P<0.05)。1)以CO2计。
2.2 土壤酶活性
过氧化氢酶因为存在于所有的活细胞中而经常被用于指示土壤微生物生理状态[18]和是否受到氧化胁迫。在所有处理中,过氧化氢酶活性随着CHT和镉添加量的不同而波动。如图3所示,30 d时无镉和低浓度镉处理组(M0和M1)过氧化氢酶活性高于60 d时;而高浓度镉处理组(M2)在2个时间点的酶活性均无显著差异。在不同镉浓度条件下,CHT的添加对过氧化氢酶活性均无显著影响。
过氧化氢酶对镉和CHT不敏感证明了这2种污染物在单一和复合情况下均不会对微生物造成氧化胁迫。研究表明菊酯类农药和铜的复合作用显著抑制了过氧化氢酶活性[19],但在该研究中过氧化氢酶对CHT和镉并不敏感,这可能是因为所使用的镉浓度较低,不足以对土壤微生物造成氧化胁迫,或影响酶的活性中心。此外,过氧化氢酶对Cu的响应比较敏感可能还因为Cu2+具有产生活性氧(ROS)的能力[20],而至今尚未发现Cd2+促进ROS的产生。
30 d时,镉严重抑制土壤脲酶活性,并且高浓度镉作用更为明显(图4)。60 d时,低浓度镉处理组(M1)脲酶活性大幅回升,高浓度镉处理组(M2)脲酶活性尽管也有回升,但仍远低于CK组。在相同镉浓度组中,CHT的添加对脲酶有一定的促进作用,高浓度CHT对脲酶活性的促进作用更大,说明高浓度CHT的加入减弱了镉对脲酶活性的抑制,或者CHT对脲酶活性有促进作用。
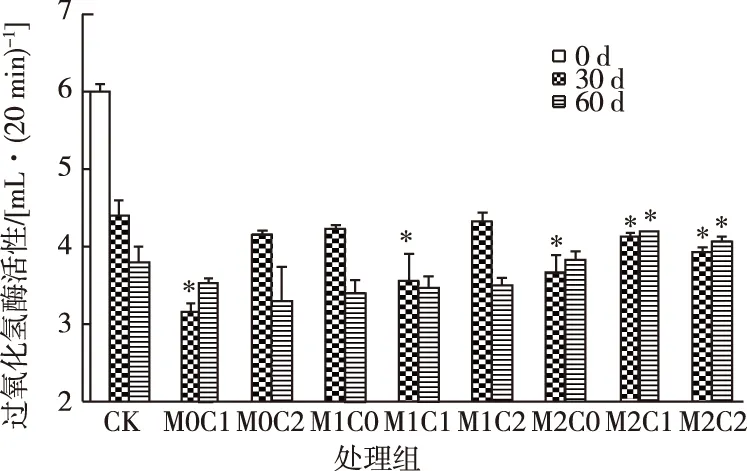
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间过氧化氢酶活性差异显著(P<0.05)。
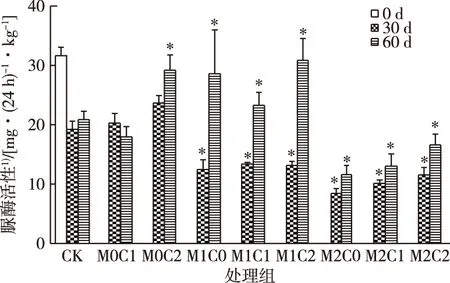
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间脲酶活性差异显著(P<0.05)。1)以干土计。
30 d时,与CK相比,CHT和镉都对碱性磷酸酶产生显著抑制作用(P<0.05),其中M2处理的抑制率最高(图5)。当CHT与低浓度镉复合污染(M1C1和M1C2处理)时,体现出更强的抑制作用(P<0.05);而与高浓度镉复合(M2C1和M2C2处理)时则无显著抑制作用。60 d时,除CK外各组碱性磷酸酶活性均较30 d时有所回升,之前受抑制较为明显的高浓度镉处理组的回升幅度更大。
脲酶和碱性磷酸酶是氮磷矿化的重要驱动力,影响着土壤中氮磷的生物可利用性。它们的活性降低会导致土壤中氮磷的固定以及C/N比和C/P比的升高。所有处理的脲酶和碱性磷酸酶都呈先抑制后升高,并且镉在复合污染中起着主导作用。事实上,镉浓度越高,对脲酶和碱性磷酸酶活性的抑制越大,但CHT与高浓度镉复合后会部分抵消镉对脲酶和碱性磷酸酶的抑制作用。但在60 d时,所有处理酶活性均得到恢复,低浓度镉处理脲酶活性甚至高于未被污染的对照组,表明土壤的生物酶活性得到恢复。
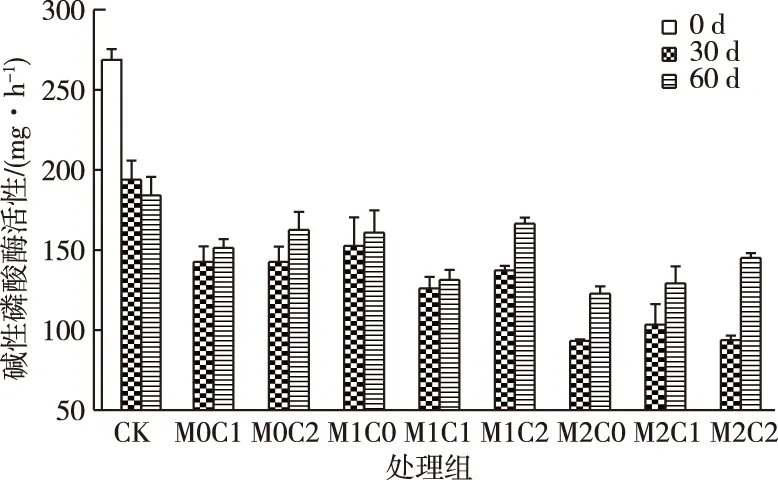
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。
2.3 微生物群落对镉的耐受性
污染物在影响土壤微生物活性和功能的同时,也会造成土壤微生物群落结构和功能的改变。土壤微生物群落抗性分析(PICT)代表了土壤微生物群落对污染物的抗性,是由对污染物最敏感的指标物组成[21],除了污染物敏感的种群被选择性的淘汰外,PICT也与胞外大分子或通过基因转移而获得的抗性有关。在未曾被镉污染的土壤中(M0),微生物群落抗性的EC50值相对较低(0.9 g·kg-1)。M1各处理组EC50值提高至CK组的2~3倍,M2各处理组EC50值大幅提高(图6)。与CK相比,单独CHT未引起土壤细菌群落对镉的耐受性,但CHT与高浓度镉复合污染(M1和M2各处理)时对提高土壤细菌群落的镉耐受性具有协同作用。这些结果表明镉进入土壤后,在重金属胁迫下,土壤微生物群落结构会从敏感型逐渐演化至较不敏感型[22],提高土壤对镉的抗性水平。
土壤中广泛存在着对CHT耐受度高和具有降解功能的菌[23-24],CHT这种相对易利用碳源的输入会给微生物群落提供更多的碳源和能源,促进微生物的增殖,从而提高土壤微生物群落对镉胁迫的适应性,这种影响在高浓度镉作用下更为明显,体现在CHT与高浓度镉复合作用时,微生物群落对镉抗性更高。这种群落抗性的提高,一方面是因为微生物群落结构的改变,另一方面也可能是因为微生物分泌的胞外物和酶等一系列变化的综合体现。对污染物敏感的微生物受到抑制或被杀死,而有抗性的种群则逐渐占据优势,最终体现在微生物群落对污染物抗性的提高和土壤活性的恢复。
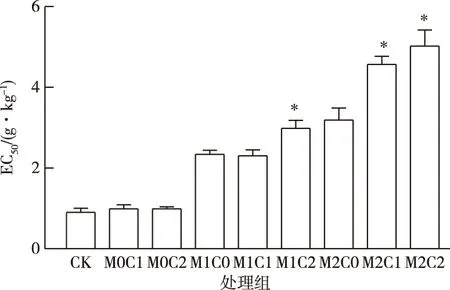
CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间EC50值差异显著(P<0.05)。
2.4 DGT分析镉的生物可利用性
普遍认为镉的生物可利用性决定着其生物效应。生物可利用性与众多因子相关,包括土壤类型、镉的形态、施用方式和土壤微生物群落。DGT法是目前最为成熟直接的生物可利用性的测试方法[12]。经DGT分析发现,进入土壤的重金属,其有效性会随着时间的延长而降低。虽然30 d时生物可利用态镉浓度高于60 d时,但其生物有效性(CDGT)却无显著差异(图7),说明镉进入土壤后,会在30 d内迅速老化,30 d以后老化速度变慢,生物有效性维持在一个较稳定的水平。纳明亮[25]对Zn、Pb和Cu等重金属的研究也有类似结果。总体来看,无论CHT是否存在,生物有效性随着镉浓度的增加而增加。SIKKEMA等[26]发现菊酯类农药可以与质膜上的脂类相互作用,影响质膜的透过性和结构,从而可能会增加重金属生物有效性。CHT的添加可以促进高浓度镉的生物有效性,但低浓度镉则无显著促进作用。菊酯类农药对镉的生物有效性的影响还需要进一步研究。

CK为对照组;M0、 M1、M2表示w(镉)为0、2和10 mg·kg-1;C0、C1、C2表示w(CHT)为0、50和150 mg·kg-1。*表示同一时期处理组与CK组之间CDGT值差异显著(P<0.05)。
3 结论
针对不同的指标和镉浓度,CHT与镉的复合效应不同。CHT与低浓度镉的复合污染会刺激微生物活性,而高浓度镉则对微生物活性有抑制作用,并且在复合污染中起着主导作用。CHT可明显促进土壤微生物群落对镉的抗性,并提高镉的生物可利用性。在目前重金属和杀虫剂、农药对土壤的复合污染条件下,还需要进一步研究它们之间的复合作用对重金属的生物可利用性及土壤质量的影响,以阻断作物吸收,保障食品安全。
[1] CASIDA J E,QUISTAD G B.Golden Age of Insecticide Research:Past,Present,or Future[J].Annual Review of Entomology,1998,43:1-16.
[2] OUDOU H C,HANSEN H C B.Sorption of Lambda-Cyhalothrin,Cypermethrin,Deltamethrin and Fenvalerate to Quartz,Corundum,Kaolinite and Montmorillonite [J].Chemosphere,2002,49(10):1285-1294.
[3] XIE J M,WANG P L,LIU J,etal.Photodegradation of Lambda-Cyhalother in and Cypermethrin in Aqueous Solution as Affected by Humic Acid and/ or Copper:Intermediates and Degradation Pathways [J].Environmental Toxicology and Chemistry,2011,30(11):2440-2448.
[4] 陈莹莹,王金花,陆贻通.丁草胺与镉复合污染对土壤呼吸强度的影响[J].环境污染与防治,2006,28(10):723-726,730.[5] BARDGETT R D.The Biology of Soil:A Community and Ecosystem Approach[M].Oxford,UK:Oxford University Press,2005:124-205.
[6] XIE W J,ZHOU J M,WANG H Y,etal.Effect of Nitrogen on the Degradation of Cypermethrin and Its Metabolite 3-Phenoxybenzoic Acid in Soil[J].Pedosphere,2008,18(5):638-644
[7] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985:58-73.
[8] 关松荫,张德生,张志明.土壤酶及其研究法[M].北京:农业出版社,1986:78-103.
[9] TABATABAI M A.Soil Enzymes[C]∥WEEWER R M,ANGLES A,BOTTOMLEY P,etal.Methods of Soil Analysis:Part 2:Microbiological and Biochemical Properties.Wisconsin,USA:Soil Science Society of America,1994:775-833.
[10]BÅÅTH E,PETTERSSON M,SÖDERBER K H.Adaptation of a Rapid and Economical Microcentrifugation Method to Measure Thymidine and Leucinein Corporation by Soil Bacteria [J].Soil Biology & Biochemistry,2001,33(11):1571-1574.
[11]ZHANG H,ZHAO F J,SUN B,etal.New Method to Measure Effective Soil Solution Concentration Predicts Copper Availability to Plants [J].Environmental Science and Technology,2001,35(12):2602-2607.
[12]SIMPSON A J,SIMPSON M J,SMITH E,etal.Microbially Derived Inputs to Soil Organic Matter:Are Current Estimates Too Low?[J].Environmental Science and Technology,2007,41(23):8070-8076.
[13]KILLHAM K.A Physiological Determination of the Impact of Environmental Stress on the Activity of Microbial Biomass [J].Environmental Pollution Series A:Ecological and Biological,1985,38(3):283-294.
[14]LIU T F,SUN C,TAN A,etal.Effect of Copper on the Degradation of Pesticides Cypermethrin and Cyhalothrin[J].Journal of Environmental Sciences,2007,19(10):1235-1238.
[15]史婕,申鸿,王兵,等.紫色土中联苯菊酯残留对土著微生物的影响[J].中国农学通报,2011,27(24):312-316.
[16]DOS SANTOS E C,SILVA I S,SIMES T H N.etal.Correlation of Soil Microbial Community Responses to Contamination With Crude Oil With and Without Chromium and Copper [J].International Biodeterioration and Biodegradation,2012,70:104-110.
[17]MALISZEWSKA-KORDBACH B,SMRECZAK B.Habitat Function of Agricultural Soils as Affected by Heavy Metals and Polycyclic Aromatic Hydrocarbons Contamination[J].Environment International,2003,28(8):719-728.[18]BELLO D,TRASAR-CEPEDA C,LEIROS M C,etal.Modification of Enzymatic Activity in Soils of Contrasting pH Contaminated With 2,4-Dichlorophenol and 2,4,5-Trichlorophenol [J].Soil Biology and Biochemistry,2013,56(Suppl. 1):80-86.
[19]LIU J,XIE J,CHU Y,etal.Combined Effect of Cypermethrin and Copperon Catalase Activity in Soil[J].Journal of Soils and Sediments,2008,8(5):327-332.
[20]XIE J,WANG L,LIU J,etal.Photode Gradation of Lambda-Cyhal Othrin and Cypermethrin in Aqueous Solution as Affected by Humic Acid and/ or Copper:Interme Diates and Degradation Pathways[J].Environmental Toxicology and Chemistry,2011,30(11):2440-2448.
[21]DAVIDF C,MANUEL A E,MONTSERRAT D R,etal.Bacterial Pollution Induced Community Tolerance (PICT) to Cu and Interactions With pH in Long-Term Polluted Vineyard Soils[J].Soil Biology and Biochemistry,2011,43(11):2324-2331.
[22]GILLER K E,WITTER E,MCGRATH S P.Toxicity of Heavy Metals to Microorganisms and Microbial Processes in Agricultural Soils:A Review [J].Soil Biology and Biochemistry,1998,30(10/11):1389-1414.
[23]CHENS H,HU M Y,LIU J J,etal.Biodegradation of Beta-Cypermethrin and 3-Phenoxybenzoic Acid by a Novel Ochrobactrum lupini DG-S-01[J].Journal of Hazardous Materials,2011,187(1/2/3):433-440.
[24]ZHANG C,JIA L,WANG S H,etal.Biodegradation of Beta-Cypermethrin by TwoSerratiaspp. With Different Cell Surface Hydrophobicity [J].Bioresource Technology,2010,101(10):3423-3429.
[25]纳明亮.土壤重金属污染剂量与蔬菜毒性效应及其控制技术研究[D].杨凌:西北农林科技大学,2007.
[26]SIKKEMA J,DE BONT J A,POOLMAN B.Interactions of Cyclic Hydrocarbons With Biological Membranes[J].Journal of Biological Chemistry,1994,269(11):8022-8028.
(责任编辑: 陈 昕)
Impact of Combined Cyhalothrin-Cd Pollution on Soil Microbes and Bioavailability of Cd.
LI Jie, ZHANG Si-fan, XIAO Lin
(School of Environment/ State Key Laboratory of Pollution Control and Resource Reuse, Nanjing University, Nanjing 210023, China)
To assess the joint impact of cyhalothrin and cadmium on soil microbial activity and bioavailability of Cd, soil samples were collected from a polluted field for analysis of changes in microbial biomass, respiration, enzymatic activity, pollution induced community tolerance (PICT), as well as bioavailability of Cd. For determining the latter two indices, the isotope-labeling and DGT (diffusive gradients in thin-films) technologies were used. Results show that soil respiration rate increased when 2 mg·kg-1Cd was amended into the soil, but decreased when 10 mg·kg-1Cd was. The amendment of both cyhalothrin and a low level of Cd stimulated soil biomass and respiration. Soil catalase, urease and alkaline phosphatase responded differently in activity to Cd and cyhalothrin. Urease was inhibited by Cd and revived to some extend when cyhalothrin was added, whilst alkaline phosphatase was inhibited in the initial 30 days and revived till the 60th day. The pollution of cyhalothrin alone did not show any PICT effect, however, the combined pollution elevated PICT to Cd, as well as bioavailability of Cd represented by DGT concentration. All the findings suggest that Cd in the combined pollution plays an essential role in affecting the studied indices, but the stimulating effects on soil microbial activity are synergistic ones when pyrethroidis coupled with a low level of Cd. CHT could increase PICT to Cd as well as bioavailability of Cd, which should be considered in the issue of food safety.
cadmium;cyhalothrin;combined pollution;soil microbe;bioavailability
2015-08-19
国家自然科学基金(41071313)
X53
A
1673-4831(2016)05-0826-06
10.11934/j.issn.1673-4831.2016.05.021
李洁(1992—),女,江苏宜兴人,硕士生,主要研究方向为环境生物学。E-mail: 1035227946@qq.com
① 通信作者E-mail: xiaolin@nju.edu.cn

