黄褐斑患者组织病理特征分析
朱丽萍 庞勤 吕乐春 易水桃 丁冬梅 何黎
650032昆明医科大学第一附属医院皮肤科(朱丽萍、吕乐春、易水桃、丁冬梅);昆明薇诺娜皮肤医疗美容门诊部(庞勤);昆明医科大学第一附属医院皮肤科 云南省皮肤性病研究所 云南省工程技术研究中心(何黎)
黄褐斑患者组织病理特征分析
朱丽萍 庞勤 吕乐春 易水桃 丁冬梅 何黎
650032昆明医科大学第一附属医院皮肤科(朱丽萍、吕乐春、易水桃、丁冬梅);昆明薇诺娜皮肤医疗美容门诊部(庞勤);昆明医科大学第一附属医院皮肤科 云南省皮肤性病研究所 云南省工程技术研究中心(何黎)
目的探讨黄褐斑组与正常对照组组织病理学及超微结构差异。方法分别取8例黄褐斑患者的皮损组织,16例面部色素痣皮损周围正常组织,分别取2 mm活检,进行HE染色、Fontana⁃Masson染色、Verhoeff⁃van Gieson染色,HMB45、NKI/beteb免疫组化及透射电镜观察。光镜下半定量及计算机图像定量分析。结果黄褐斑组组织病理表现为以基底层、棘层为主的黑素颗粒增多,部分伴真皮黑素颗粒增加。黄褐斑组黑素细胞仅存在于表皮层,较正常皮肤黑素细胞数量无增加,但表皮层黑素细胞体积增大,染色强度增加,树突增多。8例黄褐斑患者均在真皮浅层及毛细血管周围观察到轻到中度的淋巴细胞浸润,8例黄褐斑患者均在真皮浅层观察到轻到中度的毛细血管扩张。电镜:黄褐斑组黑素细胞,角质形成细胞内都含有更多黑素小体,此外,还观察到黑素细胞树突伸入到真皮层。结论8例黄褐斑患者中,仅有表皮型和混合型(表皮真皮型)2型,无单纯真皮型黄褐斑。炎症反应、毛细血管扩张可能引发或加重黄褐斑。
黄褐斑;病理学;免疫组织化学;显微镜检查,电子,透射;炎症;毛细血管扩张
黄褐斑是一种常见的面部获得性色素性皮肤病,常发生于面颊、前额、上唇、鼻部及下颏。其发病机制及病因尚不完全清楚。既往有学者提出将黄褐斑分为表皮型、真皮型、混合型[1],目前国际上也一直沿用此标准。但依据光折射Tyndall效应,黑素沉着于表皮时,呈黑色或褐色,在真皮浅层呈灰蓝色,在真皮深层呈青色,但黄褐斑皮损为黄褐色,因此该分型方法与黄褐斑皮损表现矛盾[2]。Liu等[3]依据组织病理及共聚焦显微镜观察发现黄褐斑仅有表皮型与混合型(表皮真皮型)。顾华等[4]发现,黄褐斑发病除与黑素有关外,还与炎症反应、血管因素相关。本研究采用HE染色、特殊染色及两种黑素细胞免疫组化方法等对黄褐斑患者皮损的特点进行探讨。
对象与方法
一、对象
2012年7月至2013年8月,昆明医科大学第一附属医院皮肤科门诊确诊为黄褐斑的8例女性患者作为黄褐斑组。黄褐斑组年龄(42.38±5.18)岁(33~49岁)。另收集女性面部色素痣皮损周围正常组织16例作为正常对照组。正常对照组年龄(40.69±8.064)岁(23~52岁)。两组年龄差异无统计学意义,皮肤类型均为FitzpatrickⅡ~Ⅴ型。本研究通过本院医学伦理委员会批准,入组者均签署知情同意书。
二、方法
1.HE染色:常规方法制作病理片。
2.特殊染色:Fontana⁃Masson染色,用Regaud苏木精染核,Fontana⁃Masson染色后进行核固红复染。用Verhoeff⁃van Gieson染色液进行染色[5]。
3.免疫组化染色:兔单克隆抗人抗体HMB45(1∶100美国Abcam公司)和鼠单克隆抗人抗体NKI/beteb(1∶20美国Abcam公司)抗体为一抗,按照SP免疫组化试剂盒(美国Zyled公司生产,昆明中云美生物技术有限公司提供)操作步骤进行,其中一抗孵育时间为37℃、1 h,二氨基联苯氨(3,3 diaminobezidin,DAB)显色,苏木精复染,水溶性封片剂封片。
4.电子显微镜观察制备:取新鲜皮损,0.25%的戊二醛固定,4℃冰箱放置18 h,0.1 mmol/L磷酸盐缓冲液(pH7.2)再次洗涤,1%四氧化锇液固定1 h,1%醋酸双氧铀和50%乙醇染色30 min。系列浓度乙醇和丙酮将组织脱水,环氧树脂包埋。超薄切片机将组织切成80 nm厚度,切片以醋酸双氧铀和柠檬酸铅染色。由Philip EM420型透射电镜观察制备的铜网,加压为80 kV。
三、图像分析
1.HE染色:对结果采用双盲分析的方法,采集显微镜图像(×200),利用图像分析软件Image⁃Pro Plus 6.0对图像进行分析。对HE染色显示的毛细血管及炎症细胞,以每4 mm2真皮毛细血管、炎症细胞含量作为定量参数。以无炎症细胞为基线,每4 mm2炎症细胞占总细胞数的百分比进行分级,<30%为轻度,30%~60%为中度,>60%为重度。以对照组毛细血管数量均值为基线,超过对照组<30%为轻度,30%~60%为中度,>60%为重度。
2.特殊染色:采集显微镜图像(×200),利用图像分析软件Image⁃Pro Plus 6.0对图像进行分析。对Fonton⁃Masson染色显示的表皮内黑素颗粒,以每1 mm2表皮黑素颗粒含量作为定量参数。Verhoeff⁃van Gieson染色显示弹性纤维的含量,以每1 mm2真皮内弹性纤维的含量作为定量参数。
3.免疫组化:同时采用HMB45,NKI/beteb免疫组化法对黄褐斑皮损进行处理。HMB45和NKI/beteb用于显示表皮黑素细胞,染色阳性的黑素细胞和染色阴性的角质形成细胞均以存在明确的细胞核而计数为1个细胞。对黄褐斑皮损阳性细胞与角质层细胞的比值[黑素细胞(MC)/角质形成细胞(KC)]进行计数。对结果采用双盲分析的方法,在显微镜下随机选取5个高倍镜(×400)视野,由2位病理学者进行独立评分。根据样本的染色强度及阳性细胞的数目进行评分。染色强度评分标准:无色为0分,浅黄色为1分,浅棕色为2分,棕色为3分。阳性细胞数评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。依据两者评分之和分为4级:0~1分(-),2分(+),3~4分(++),> 4分(+++),-或+为阴性,++或+++定义为阳性,计算黄褐斑组及正常对照组阳性率[6]。
4.透射电子显微镜观察:采用透射电子显微镜对8例黄褐斑及16例正常皮肤电镜标本进行定性观察,记录黄褐斑皮损及正常皮肤电子显微镜下特征。
四、统计学分析
实验数据均采用SPSS.19进行t检验,χ2检验和Mann⁃Whitney秩和检验,异质性检验分析。
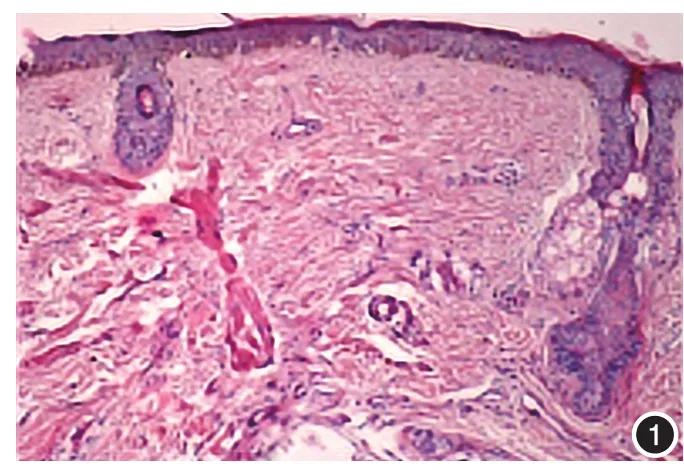
图1 黄褐斑组皮损区表皮变薄,皮突变平,基底层黑素细胞下移,真皮毛细血管周围炎症细胞浸润,真皮浅层毛细血管扩张(HE×100)

图2 正常对照组皮肤未见表皮变薄,皮突变平,未见基底层黑素细胞下移,明显的炎症细胞浸润及毛细血管扩张(HE×100)
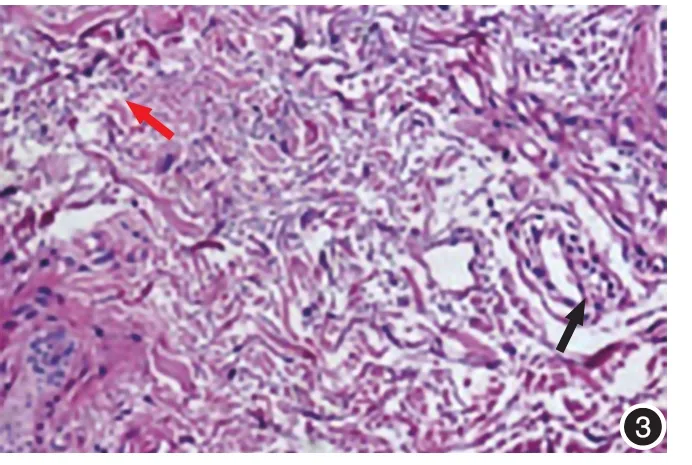
图3 黄褐斑组皮损区弹性纤维嗜碱性变(红箭头);毛细血管扩张及淋巴细胞浸润(黑箭头,HE×200)
结 果
一、组织病理染色
1.HE染色:8例黄褐斑组皮损均有不同程度的表皮变薄,皮突变平,基底层黑素细胞下移(即黑素细胞在基底膜带上方,但较正常对照组黑素细胞位置下移,基底膜带尚完整),未在正常对照组观察到皮突变平和黑素细胞下移(图1,2)。真皮毛细血管周围见炎症细胞浸润(P<0.05),以淋巴细胞为主,伴少量中性粒细胞。真皮浅层见毛细血管扩张(P< 0.05)(图3)。
2.Fonton⁃Masson染色:8例黄褐斑组患者和12例正常对照组均在真皮层见到少量噬色素细胞,两组差异无统计学意义(P>0.05)。8例黄褐斑组(图4)基底层黑素均较正常对照组(图5)明显增加,其中6例基底层、棘层黑素颗粒明显增加,棘层角质形成细胞内明显的黑素颗粒沉积,仅3例在真皮浅层观察到黑素颗粒增加,未在正常对照组观察到真皮黑素颗粒增加(P<0.05)。采用图像分析软件Image⁃Pro Plus 6.0对黄褐斑皮损表皮区进行分析,黄褐斑组较正常对照组黑素增加(P<0.05)。Verhoeff⁃van Gieson染色显示:黄褐斑组皮损区(图6A)弹性纤维平均吸光度值较正常对照组(图6B)无明显变化(P>0.05)。见表1。
二、免疫组化
HMB45免疫组化显示黄褐斑组(图7A)阳性比例为8/8,正常对照组(图7B)阳性比例为7/16,NKI/beteb免疫组化显示黄褐斑组(图8A)阳性比例为6/8,正常对照组(图8B)阳性比例为4/16(表2)。此外,应用HMB45,NKI/beteb免疫组化方法对黄褐斑皮损阳性细胞与角质形成细胞的比值(MC/KC)进行计数,HMB45免疫组化显示黄褐斑组、正常对照组差异无统计学意义(P>0.05),NKI/beteb也显示二者差异无统计学意义(P>0.05)。以上结果表明,黄褐斑组较正常对照组表皮黑素细胞数量无增加,但染色强度增强。
三、透射电子显微镜观察
与正常对照组(图9)相比,8例黄褐斑组皮损区(图10)基底层黑素细胞体积增大,线粒体,核糖体,粗面内质网较为丰富。基底层,棘层细胞内可见各期黑素小体,以Ⅲ、Ⅳ期的为主,数量较正常对照组明显增加。棘层的角质形成层细胞内有大量Ⅳ期黑素小体。黑素细胞树突伸入真皮层(图11,12)。基底细胞间被结缔组织所占据,期间可见滤泡状结构,滤泡间的黑素细胞凸向真皮。8例黄褐斑皮损电镜组织中均在皮损区真皮浅层血管周围见到以淋巴细胞为主的炎症细胞浸润(图13,14)。黄褐斑皮损区(图15)较正常皮肤见到更多噬色素细胞,其内含有大量成熟的黑素小体及被溶酶体吞噬的黑素颗粒,呈团块状分布,正常皮肤真皮层也可见少量噬色素细胞(图16),皮损区较正常皮肤噬色素细胞吞噬更多黑素颗粒,黄褐斑组、正常对照组真皮均未观察到黑素细胞。
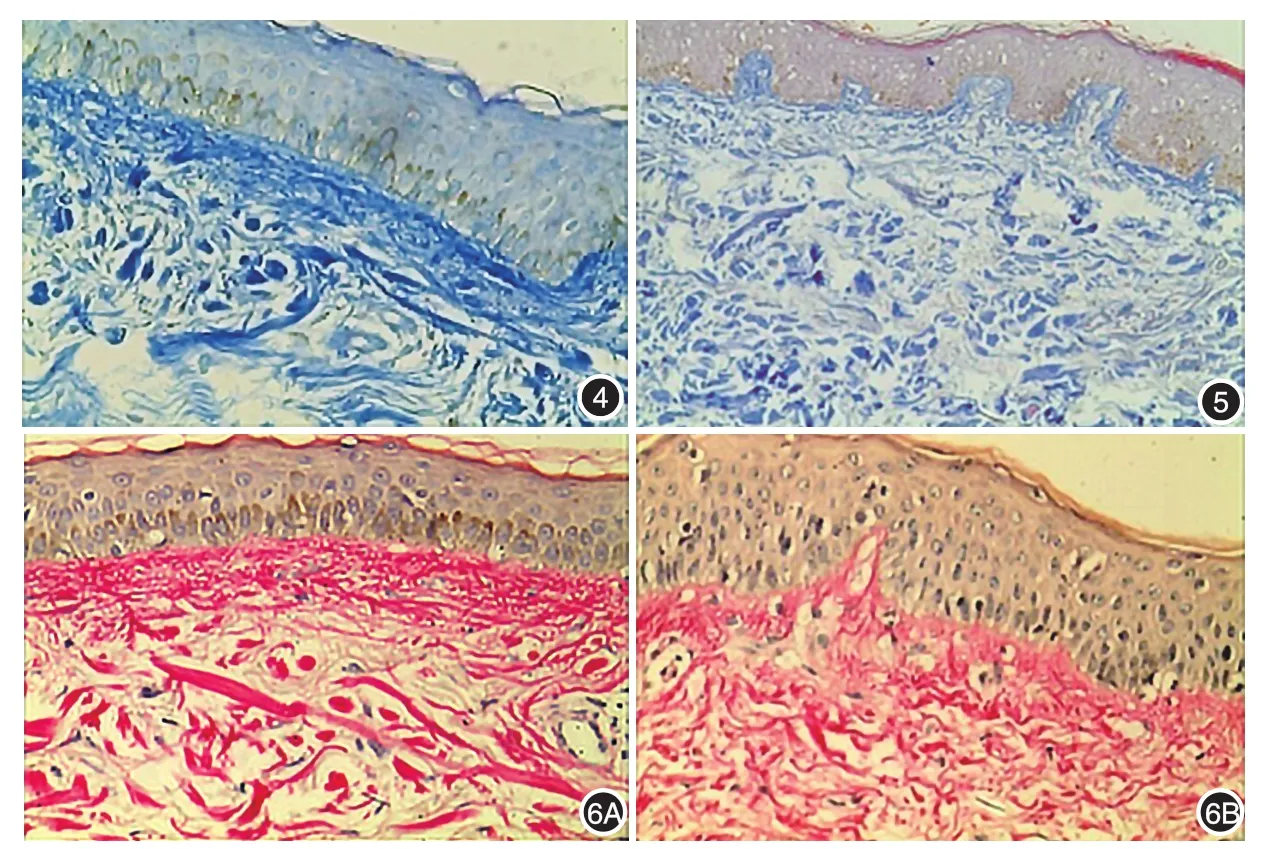
图4 黄褐斑组皮损区基底层、棘层黑素明显增加,棘层角质形成细胞内可见明显的黑素沉积(Fonton⁃Masson染色×200) 图5 正常对照组表皮全层无明显黑素增加(Fonton⁃Masson染色×200) 图6 黄褐斑组皮损区(6A)较正常对照组皮肤(6B)弹性纤维平均吸光度值无明显增加(Verhoeff⁃van Gieson染色×200)
讨 论
本研究发现,黄褐斑组黑素细胞仅存在于表皮层,组织病理主要表现为以基底层、棘层为主的黑素增多,依据既往研究[3]将其划分为表皮型黄褐斑,部分伴真皮黑素增加,为混合型(即表皮真皮型)黄褐斑,无单纯真皮型。本研究中,Fonton⁃Masson染色显示黄褐斑组皮损区以基底层、棘层为主的黑素增加,透射电镜显示基底层黑素细胞体积较正常对照组增大,树突增多,线粒体、核糖体、粗面内质网较为丰富。黄褐斑组黑素细胞内含各期黑素小体,以Ⅲ、Ⅳ期的为主,数量较正常对照组明显增加,提示皮损区黑素细胞功能较为活跃。棘层的角质形成层细胞内有大量Ⅳ期黑素小体,提示黑素小体向角质形成层细胞转移增多。Liu等[3]依据组织病理及共聚焦显微镜观察发现黄褐斑仅有表皮型与混合型两型。本研究从病理及超微结构方面再次支持该研究结论。Kang等[7]研究发现,黄褐斑皮损区较非皮损区黑素细胞数量及染色强度均增加、表皮全层黑素颗粒增多、黑素细胞和角质形成细胞功能活跃。但Grimes等[8]研究发现,黄褐斑皮损区黑素细胞的数量并无改变,与Kang等[7]的研究结果有所差异,考虑可能与研究人种相关。黄褐斑组较正常对照组真皮层噬色素细胞无明显增加,关于表皮黑素颗粒如何转移至真皮噬色素细胞,既往有多种假说。本研究未在黄褐斑组及正常对照组观察到Schwann细胞,未在真皮发现黑素细胞,未在表皮观察到吞噬细胞,但黄褐斑组基底层黑素细胞凸向真皮,且在真皮层发现黑素细胞树突,提示游离黑素掉入真皮或表皮黑素细胞树突凸入真皮释放黑素后可能被真皮成纤维细胞吞噬,该现象可能为真皮黑素代谢的生理过程,此代谢过程紊乱是否与黄褐斑发病相关尚待更多研究证实。黑素细胞特异性免疫组化显示黄褐斑皮损区黑素细胞数量与正常皮肤无差别。但二者抗体染色强度都增加,提示黑素合成相关Pmel⁃17和GP100蛋白的表达水平增高,与黄褐斑黑素合成增加有关。本研究还发现皮损区基底层黑素细胞下移现象,黑素细胞下移的临床意义尚不清楚,长期慢性高剂量的UVA可能会引起下移的黑素细胞由表皮移入真皮,或由于治疗不当等破坏基底膜从而引起黑素细胞落入真皮从而产生炎症后色素沉着[9],提示黄褐斑的治疗不宜过激,联合治疗和序贯治疗更为有效[10]。
表1 黄褐斑患者与正常对照组黑素颗粒含量与弹性纤维含量(±s)
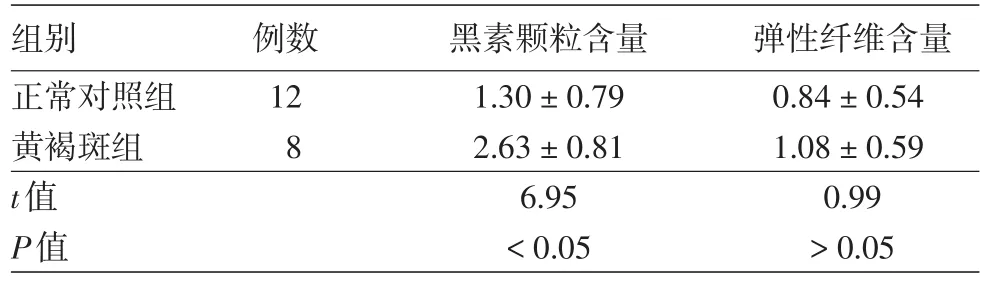
表1 黄褐斑患者与正常对照组黑素颗粒含量与弹性纤维含量(±s)
组别正常对照组黄褐斑组t值P值例数12 8黑素颗粒含量1.30±0.79 2.63±0.81 6.95<0.05弹性纤维含量0.84±0.54 1.08±0.59 0.99>0.05
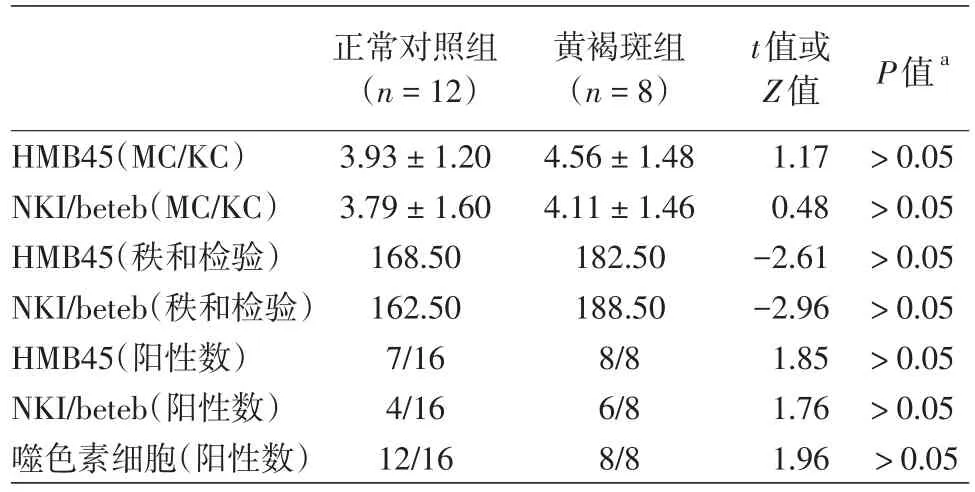
表2 黄褐斑皮损免疫组化半定量及噬色素细胞阳性结果

图7 黄褐斑皮损区(7A)基底层少量黑素细胞胞核阳性,正常皮肤(7B)基底层也可见少量胞核阳性黑素细胞(HMB45免疫组化×200) 图8 黄褐斑皮损区(8A)基底层少量黑素细胞胞核阳性,正常皮肤(8B)基底层也可见少量胞核阳性黑素细胞(NKI/beteb免疫组化 × 200)
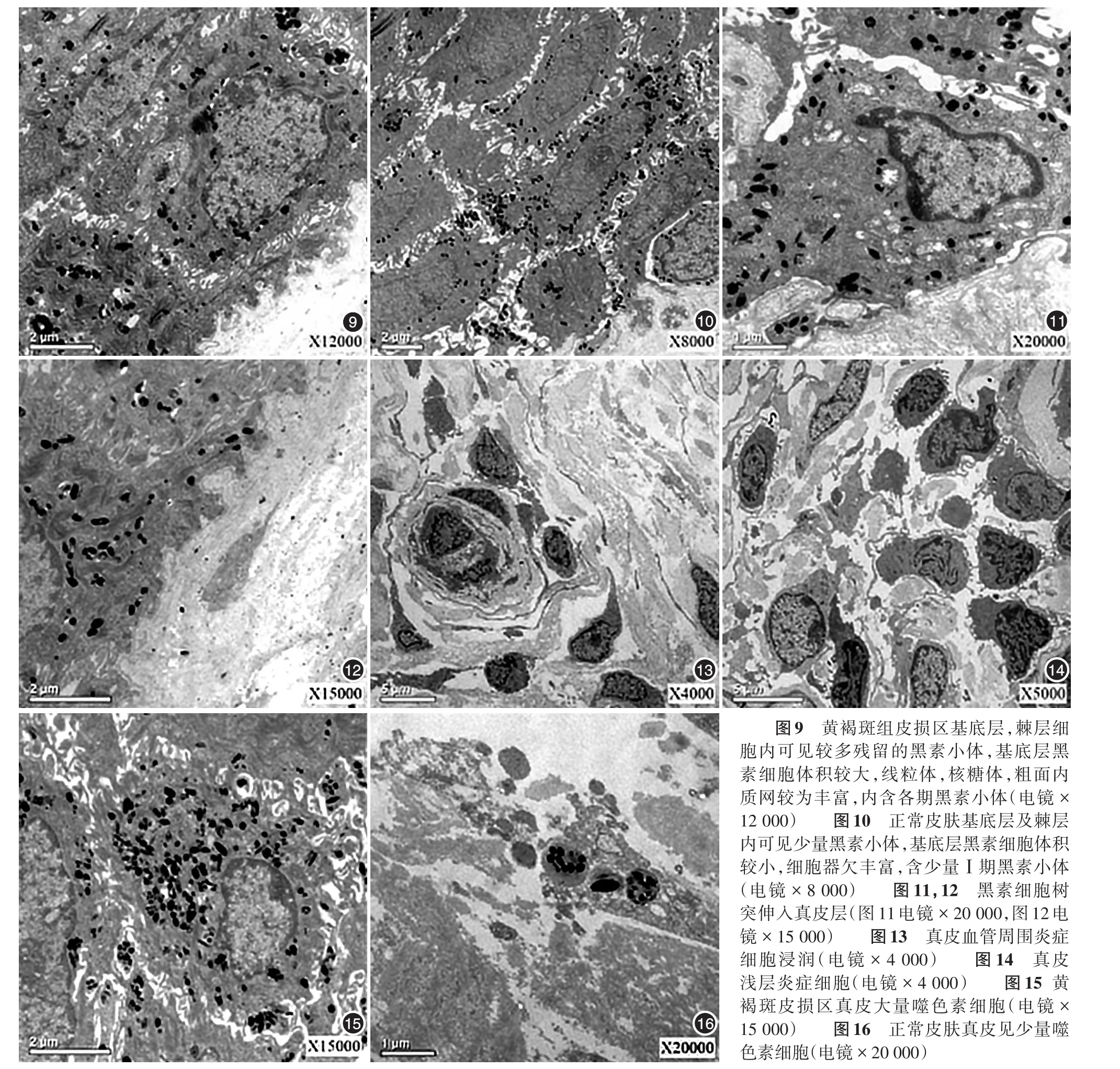
图9 黄褐斑组皮损区基底层,棘层细胞内可见较多残留的黑素小体,基底层黑素细胞体积较大,线粒体,核糖体,粗面内质网较为丰富,内含各期黑素小体(电镜×12 000) 图10 正常皮肤基底层及棘层内可见少量黑素小体,基底层黑素细胞体积较小,细胞器欠丰富,含少量Ⅰ期黑素小体(电镜×8 000) 图11,12 黑素细胞树突伸入真皮层(图11电镜×20 000,图12电镜×15 000) 图13 真皮血管周围炎症细胞浸润(电镜×4 000) 图14 真皮浅层炎症细胞(电镜×4 000) 图15黄褐斑皮损区真皮大量噬色素细胞(电镜×15 000) 图16 正常皮肤真皮见少量噬色素细胞(电镜×20 000)
本研究还发现,黄褐斑发病与皮损区炎症及毛细血管扩张相关。在HE染色中,观察到黄褐斑皮损区真皮浅层及毛细血管周围以淋巴细胞为主的炎症细胞浸润。Kang等[11]在75%的黄褐斑患者皮损中观察到轻度淋巴细胞浸润。既往研究表明,黄褐斑皮损区SCF和肥大细胞活性增加,c⁃kit表达上调,TLR⁃2,TLR⁃4表达上调[12⁃13],皮损区多种炎症因子表达上调支持黄褐斑发病有炎症因素参与。此外,还发现真皮浅、中层毛细血管扩张,考虑长期外界环境刺激及机械摩擦引起皮肤微损伤,炎症因子释放,其中的舒血管物质引发毛细血管扩张[13]。但本实验研究样本量较小,故尚待更多研究来证实。目前有学者认为,以前之所以分出真皮型黄褐斑是对获得性太田样痣的误诊,而获得性太田样痣的病理特点是:真皮乳头层和网状浅层存在散在黑素细胞,且黑素细胞所在位置比太田痣表浅[14]。建议之后的研究可增加获得性太田样痣组为另一对照组。
综上所述,本研究证实黄褐斑仅存在表皮型和混合型2型,尚未发现单纯真皮型黄褐斑。黄褐斑发病除与黑素相关外,还与炎症因素及毛细血管扩张相关。顾华等[4]提出将黄褐斑分为色素型M(色素)型,V(血管)型,M>V(色素优势),V >M(血管优势)型,本研究从病理学方面支持何黎等的研究结论。
[1]Sheth VM,Pandya AG.Melasma:a comprehensive update.part I[J].J Am Acad Dermatol,2011,65(4):689⁃697.DOI:10.1016/j.jaad.2010.12.046.
[2]廖康煌.色素障碍性皮肤病//杨国亮.杨国亮皮肤病学[M].上海科学技术文献出版社,2007:638⁃639.
Liao KH.Dermatosis of depigmentation disorder//Yang GL.Yang GL Dermatology[M].Shanghai science and technology literature press,2007:638⁃639.
[3]Liu H,Lin Y,Nie X,et al.Histological classification of melasma with reflectance confocal microscopy:a pilot study in Chinese patients[J].Skin Res Technol,2011,17(4):398 ⁃403.DOI:10.1111/j.1600⁃0846.2011.00517.x.
[4]顾华,罗雯,刘付华,等.无创性皮肤测试在黄褐斑临床分型中的应用及意义[J].皮肤病与性病,2012,34(2):69⁃70,76.DOI:10.3969/j.issn.1002⁃1310.2012.02.003.
Hua GU,Wen L,FU⁃hua L,et al.The application of non⁃invasive physiometry in different clinical type of melasma and its clinical significance[J].J Dermatol Venereol,2012,34(2):69 ⁃70,76.DOI:10.3969/j.issn.1002⁃1310.2012.02.003.
[5]谭城,朱文元,鲁严.白癜风皮损黑素细胞HMB⁃45、酪氨酸酶及其相关蛋白1的免疫组化研究[J].临床皮肤科杂志,2003,32(7):376⁃378.DOI:10.3969/j.issn.1000⁃4963.2003.07.003.
Immunohistochemical study on HMB⁃45,tyrosinase and TRP1 in the residual melanocytes of vitiligo[J].J Clin Dermatol,2003,32(7):376⁃378.DOI:10.3969/j.issn.1000⁃4963.2003.07.003.
[6]Ma Y,Ma L,Guo Q,et al.Expression of bone morphogenetic protein⁃2 and its receptors in epithelial ovarian cancer and their influence on the prognosis of ovarian cancer patients[J].J Exp Clin Cancer Res,2010,29:85.DOI:10.1186/1756⁃9966⁃29⁃85.
[7]Kang WH,Yoon KH,Lee ES,et al.Melasma:histopathological characteristics in 56 Korean patients[J].Br J Dermatol,2002,146(2):228⁃237.
[8]Grimes PE,Yamada N,Bhawan J.Light microscopic,immunohis⁃tochemical,and ultrastructuralalterationsin patientswith melasma[J].Am J Dermatopathol,2005,27(2):96⁃101.
[9]Lee DJ,Park KC,Ortonne JP,et al.Pendulous melanocytes:a characteristic feature of melasma and how it may occur[J].Br J Dermatol,2012,166(3):684 ⁃686.DOI:10.1111/j.1365 ⁃2133.2011.10648.x.
[10]朱丽萍,刘海洋,庞勤,等.联合治疗黄褐斑的研究进展[J].中华皮肤科杂志,2016,49(2):147⁃150.DOI:10.3760/cma.j.issn.0412⁃4030.2016.02.022.
Zhu LP,Liu HY,Pang Q,et al.Combination therapy for melasma[J].Chin J Dermatol,2016,49(2):147⁃150.DOI:10.3760/cma.j.issn.0412⁃4030.2016.02.022.
[11]Kang HY,Hwang JS,Lee JY,et al.The dermal stem cell factor and c⁃kit are overexpressed in melasma[J].Br J Dermatol,2006,154(6):1094⁃1099.DOI:10.1111/j.1365⁃2133.2006.07179.x.
[12]王银娟,顾华,郭美华,等.黄褐斑患者皮损及血液中Toll样受体2和4的表达[J].中华皮肤科杂志,2015,48(2):100⁃103.DOI:10.3760/cma.j.issn.0412⁃4030.2015.02.010.
Yinjuan W,Hua G,Meihua G,et al.Expressions of Toll⁃like receptors 2 and 4 in skin lesions and peripheral blood from patients with chloasma[J].Chin J Dermatol,2015,48(2):100 ⁃103.DOI:10.3760/cma.j.issn.0412⁃4030.2015.02.010.
[13]Kim EH,Kim YC,Lee ES,et al.The vascular characteristics of melasma[J].J Dermatol Sci,2007,46(2):111 ⁃116.DOI:10.1016/j.jdermsci.2007.01.009.
[14]Ho SG,Chan HH.The Asian dermatologic patient:review of common pigmentary disorders and cutaneous diseases[J].Am J Clin Dermatol,2009,10(3):153⁃168.
Histopathological characteristics of melasma
Zhu Liping,Pang Qin,Lyu Lechun,Yi Shuitao,Ding Dongmei,He Li Department of Dermatology,First Affiliated Hospital of Kunming Medical University,Kunming 650032,China(Zhu LP,Lyu LC,Yi ST,Ding DM);Outpatient Department,Winona Cosmetic⁃Dermatology Center,Kunming 650000,China(Pang Q);Department of Dermatology,First Affiliated Hospital of Kunming Medical University,Institute of Dermatology and Venereology of Yunnan Province,Engineering Research Center of Yunnan Province,Kunming 650032,China(He L)
ObjectiveTo investigate histopathological and ultrastructural differences between melasma tissues and normal skin tissues around pigmented nevus.MethodsEight patients with melasma and 16 patients with facial pigmented nevus were included in this study.Two millimeter punch biopsies were taken from melasma lesions and adjacent normal skin of facial pigmented nevus.Biopsy specimens were then subjected to hematoxylin⁃eosin(HE)staining,Fonton⁃Masson staining,Verhoeff⁃van Gieson staining,and immunohistochemical staining with monoclonal antibodies HMB45 and NKI/beteb.Transmission electron microscopy was used to observe the tissue specimens.Semi⁃quantitative analysis was performed under a light microscope,and quantitative analysis by using a computerized image analysis system.ResultsHistopathological study revealed increased number of melanin granules mainly in the basal and prickle cell layers,sometimes in the dermis,in melasma tissues compared with normal skin tissues.Melanocytes were only observed in the epidermis of melasma tissues.Compared with normal skin tissues,melasma tissues showed no significant difference in the quantity of melanocytes,but a significant increase in the volume,staining intensity and dendrite number of melanocytes.In all of the 8 patients with melasma,mild to moderate lymphocytic infiltration was observed in the superficial dermis and around capillaries,with moderate telangiectasis in the superficial dermis.Electron microscopy revealed that there were more melanosomes in melanocytes and keratinocytes,and melanocyte dendrites extended into the dermis in melasma tissues.ConclusionsAmong the 8 patients,there were only two types of melasma,i.e.,epidermal melasma and mixed melasma,and no dermal melasma was found.Inflammation and telangiectasis may induce or aggravate melasma.
Chloasma;Pathology;Immunohistochemistry;Microscopy,electron,transmission;Inflammation;Telangiectasis
He Li,Email:drheli2662@126.com
2016⁃02⁃24)
(本文编辑:吴晓初)
何黎,Email:drheli2662@126.com
10.3760/cma.j.issn.0412⁃4030.2016.10.006
教育部2013年度“创新团队发展计划”(RIT13067);云南省高层次人才培养计划(L⁃201011);科技创新人才计划(2014HC008)
Fund programs:Program for Innovative Research Team in University of Ministry of Education of China in 2013(RIT13067);High⁃level Talent Cultivation Project of Yunnan Province(L⁃201011);Science and Technology Innovation Talent Project(2014HC008)

