不同类型流式细胞仪检测卷烟烟气体外微核比对研究
高茜,缪明明,李雪梅,杨陟华,毛健,卢斌斌,郑赛晶,刘姜瑾,夭建华
1 云南中烟工业有限责任公司技术中心,云南省昆明市科医路41号 650106;2 军事医学科学院,北京市海淀区太平路27号 100850;3 中国烟草总公司郑州烟草研究院,河南省郑州高新技术产业开发区枫杨街2号 450001;4 上海烟草集团有限责任公司,上海市杨浦区长阳路717号 200082;5 湖南中烟工业有限责任公司,长沙市芙蓉区紫薇路210号 410016
烟草设备
不同类型流式细胞仪检测卷烟烟气体外微核比对研究
高茜1,缪明明1,李雪梅1,杨陟华2,毛健3,卢斌斌3,郑赛晶4,刘姜瑾5,夭建华1
1 云南中烟工业有限责任公司技术中心,云南省昆明市科医路41号 650106;2 军事医学科学院,北京市海淀区太平路27号 100850;3 中国烟草总公司郑州烟草研究院,河南省郑州高新技术产业开发区枫杨街2号 450001;4 上海烟草集团有限责任公司,上海市杨浦区长阳路717号 200082;5 湖南中烟工业有限责任公司,长沙市芙蓉区紫薇路210号 410016
目的:为了评估流式细胞仪(FCM)检测卷烟烟气体外微核的广泛适用性和稳定性。方法:采用4种不同类型的FCM,对国内5种品牌的卷烟烟气总粒相物(TPM)处理的中国仓鼠卵巢细胞(CHO)和人支气管上皮细胞(BEAS-2B)微核进行检测并比较检测数据。结果:不同类型FCM检测参数差异较大,但经过调整优化之后均可达到卷烟烟气体外微核检测的技术要求。不同类型FCM测定的微核率之间统计学分析没有显著差异(P>0.05)。结论:不同类型的FCM均适用于卷烟烟气体外微核的检测,且检测结果具有一致性和稳定性。
流式细胞仪;卷烟烟气总粒相物;微核
流式细胞仪( fl ow cytometry,FCM)是于20世纪70年代发展起来用于定量测定细胞和亚细胞的仪器。其工作原理是将待测样品进行荧光染色并制成悬液,然后以单个颗粒的状态通过激光束,同时用光电倍增管记录散射光和荧光信号,并传输到计算机上进行信号同步检测分析,以达到定量测定的目的[1]。FCM检测方法具有检测速度快、样品制备简单等优点,在生命科学领域得到了广泛的应用[2-4]。20世纪以来,FCM法逐渐开始应用于体外微核的检测。2010年经济合作与发展组织 (Organization for Economic Co-operation and Development,OECD) 在《遗传毒性指导原则》中提到可使用高通量自动化的系统对微核进行检测和计数[5]。长期以来,人们研究较多的是无核细胞如红细胞微核的FCM检测,而对有核细胞微核的FCM检测研究较少[6-7],原因是微核与细胞核在核酸染料标记后发出相同的荧光,难以用仪器分辨。但是有核细胞(如淋巴细胞、组织脱落细胞和生殖细胞等)的微核率是一项重要的生物剂量监测指标,于是研究者们开始积极探索有核细胞微核的FCM检测方法[8-9]。研究人员曾用FCM检测大鼠原代培养肝细胞微核,取得了比较理想的结果[10]。同样,其他类型的培养细胞如淋巴细胞微核的FCM自动化检测也取得了一定的进展[11]。2008年,国际多家实验室参与了一项评价FCM体外微核自动检测方法在小鼠淋巴瘤L5718Y细胞的应用试验,采用的是BD公司的不同型号的FCM,试验结果表明FCM方法在各家实验室具有较好的重复性[12]。本项目组近年也使用Litron实验室开发的试剂盒建立了烟气的体外微核FCM自动检测法[13]。但由于不同类型的FCM存在差异,目前国内外仍没有该方法的操作指南和标准,不同型号的FCM是否适用于检测卷烟烟气体外微核,检测结果是否具有一致性仍亟待研究。目前行业内主要选择中国仓鼠卵巢细胞(Chinese hamster ovary cells,CHO)和人支气管上皮细胞(human bronchial epithelial cells,BEAS-2B)作为卷烟烟气体外微核试验的检测细胞系。CHO细胞为上皮贴壁型细胞,是目前生物工程上广泛使用的细胞系。Canada Health组织采用CHO细胞作为TPM体外微核试验的检测细胞。BEAS-2B(人支气管上皮细胞)是由美国国立癌症研究所Harris教授及其同事建系,可用于检测化学物质和生物制剂的遗传毒性[14]。由于BEAS-2B 细胞是来源于正常的人支气管上皮细胞,因此可作为烟气直接作用的靶细胞,也可作为烟气安全性生物学评价体外微核试验的检测细胞系。因此,本文选择了多个卷烟样品,使用以上两种细胞,在不同类型的FCM上对体外微核自动检测法进行了比对试验,旨在对该方法的稳定性和广泛适用性进行评估,从而为标准方法的制定提供试验依据。
1 材料与方法
1.1 细胞与试剂
中国仓鼠卵巢细胞(Chinese hamster ovary cells,CHO细胞)购自美国标准生物品收藏中心(ATCC),BEAS-2B细胞来自军事医学科学院;In VitroMicroFlow试剂盒购自Litron Laboratory;磷酸盐缓冲液(PBS)、DMEM/F12培养基、胎牛血清购自Gibco公司;二甲基亚砜(DMSO,细胞培养级)购自Biomol公司;LHC-8细胞培养基、胰蛋白酶购自Invitrogen公司。
1.2 卷烟样品
参试卷烟为5种卷烟,其中1种为市售混合型卷烟(1#),1种为肯塔基标准卷烟3R4F(2#),另外3种为市售烤烟型卷烟(3~5#)。
1.3 主要器材和仪器
全自动吸烟机(CERULEAN SM 450);CO2培养箱(美国Thermo公司);二级生物安全柜(Heal Force公司);倒置显微镜(TS100-F-HMC,Nikon公司);96孔板、细胞培养瓶(美国Corning公司);XS204型分析天平(感量0.0001g,Mettler Toledo公司);离心机(DT5-5型,北京时代北利离心机有限公司);流式细胞仪(Quanta SC,Beckman 公司;FACSAriaTMLLU、Accuri C6、FACSCalibur,BD Biosciences公司,具体见表1)。

表1 参与试验的FCMTab.1 FCM participating in the experiment
1.4 方法
1.4.1 烟气收集及制备方法
5种卷烟按以下方法进行烟气捕集:将卷烟在恒温恒湿箱中平衡48 h,选取重量和吸阻一致的烟支。分别在全自动转盘式吸烟机上抽吸20支卷烟,用剑桥滤片捕集烟气的总粒相物。剑桥滤片用DMSO浸泡,超声提取20 min,最后定容至10 mg/mL,-80 ℃低温保存备用。
1.4.2 单细胞悬浮液的制备
单细胞悬浮液的制备参照文献[13]进行,BEAS-2B细胞培养至80%汇合,用0.05%胰蛋白酶溶液消化细胞,再加入含10%胎牛血清的DMEM/F12培养基终止消化,移取细胞悬液至无菌离心管中,于1000 r/min转速离心5 min。弃上清液,加入LHC-8培养基悬起,形成单细胞悬浮液。计数后用LHC-8培养基稀释至细胞浓度为(1~2)×105个/mL。
CHO细胞培养至80%汇合,用0.25%胰蛋白酶溶液消化细胞1 min,再加入含10%胎牛血清的DMEM/F12培养基终止消化,形成单细胞悬浮液。计数后用含10%胎牛血清的DMEM/F12培养基稀释使细胞浓度为(1~2)×105个/mL。
1.4.3 TPM暴露
TPM暴露步骤参照文献[13]进行,将细胞悬浮液接种于24孔细胞培养板中,接种量为500 μL/孔,培养24 h后移除培养板内的培养基,细胞对照组加入500 μL细胞生长培养基;溶剂对照组加入DMSO,加入量与TPM组最高检测剂量相当;TPM组加入不同剂量的烟气样品,并用DMSO补齐各TPM浓度组,使组内所有孔中的DMSO浓度与溶剂对照组一致。溶剂对照组、阳性对照组和TPM组加入相应的受试物后用细胞生长培养基将孔内溶液体积补足至500 μL,继续培养24 h。
1.4.4 细胞裂解及染色
细胞裂解及染色参照文献[13]进行,将细胞培养板置于冰上放置20 min。吸出培养板内的培养基,加入300 μL核酸染料A工作液。保持培养板置于冰上,移开板盖,在板上方距离大约10~15 cm处放置一白炽灯光源,使样品暴露于可见光下30 min。移除培养板内的溶液,用1 mL预冷的1×Bu ff er溶液冲洗一次。加入500 μL完全裂解液I,将板置于微孔板振荡器混合5 s后再加入500 μL完全裂解液II,混合均匀。室温避光放置30 min后用FCM进行分析。每个样品统计10,000个细胞核。
1.4.5 流式细胞仪检测
FCM检测方法按照文献[13]中描述进行,具体如下:
1.4.5.1 非核物质排除
图1a为以前向角(Forward Scatter)和侧向角(Side Scatter)作图。前向角表征细胞核的相对大小,通常依此设置阈值来排除样品中的各种碎片及鞘液中的小颗粒物质。侧向角表征细胞核的相对颗粒度,可用于反映胞核内的精细结构。根据前向角和侧向角设置细胞核的阈值R1门,以排除非核物质。

图1 流式细胞仪分析体外微核图Fig.1 Flow cytometry analysis in vitro micronucleus
1.4.5.2 二聚体细胞核排除
图1b为以SYTOX的荧光宽度(FL1-W)荧光面积(FL1-A)作图,荧光宽度常用来区分双联体细胞,荧光面积则是采用对荧光光通量进行积分测量,根据以上两个指标设置R2门,以排除二聚体细胞核及其他非核物质。
1.4.5.3 多倍体细胞核排除
图1c为以SYTOX的荧光强度(FL1-H)和细胞数量(Counts)作图,用以观察细胞周期状态,双峰处代表G1、S、G2/M期细胞主核,一般最小的微核荧光强度为细胞主核荧光强度的1/100,因此根据细胞主核及低于主核荧光1/100范围设置R3门,以排除多倍体的细胞核及其他非核杂质。
1.4.5.4 凋亡小体排除
图1d和图1e分别为以SYTOX荧光强度与前向角和侧向角作图,正常的细胞核荧光强度与颗粒大小或颗粒度成线性关系,根据R4门和R5门的设置,可排除荧光强度与颗粒大小或颗粒度成非线性关系的物质,如凋亡小体。
1.4.5.5 死亡细胞核排除
图1f为以EMA荧光强度(FL3-H)和SYTOX荧光强度作图。EMA染料是在细胞裂解前加入,从而将凋亡及坏死细胞核染色,设置R6门以排除EMA着色物质如死亡细胞核或凋亡小体。
1.4.5.6 微核率计算
图1g以SYTOX荧光强度和前向角作图,通过以上R1-R6的设置,得到的交集为健康的细胞主核及微核群,右上框(R7)为细胞主核物质,左下框(R8)为微核。根据R7和R8门内颗粒计算微核率:
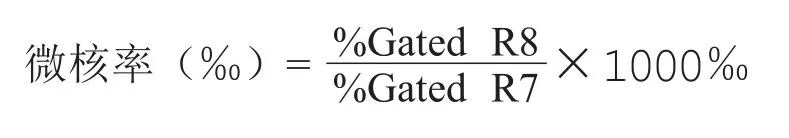
1.4.5.7 数据分析
选用FCM自带分析软件或其他合适的流式分析软件对所获取的图像进行分析,统计学数据分析使用SPSS 16.0软件。用SPSS软件中的多因素方差分析(样品、FCM两个因素)方法,对不同FCM测定的CHO细胞和BEAS-2B细胞的微核率分别进行比较。
2 结果与讨论
2.1 不同品牌型号流式细胞仪参数的优化调整及检测图比较
图2为160 μg/mL 1号样品TPM处理后的CHO细胞体外微核检测示意图,FCM1、FCM2、FCM4参与了该细胞的体外微核检测,由于FCM3所在实验室不具备CHO细胞培养经验,因此未参加该细胞的体外微核检测。

图2 TPM处理的CHO细胞二元图Fig. 2 Bivariate plots of TPM-treated CHO cells
图3为16 μg/mL 1号样品TPM处理后的BEAS-2B细胞体外微核检测示意图,FCM1、FCM2、FCM3参与了该细胞的体外微核检测,由于FCM4所在实验室不具备CHO细胞培养经验,因此未参加该细胞的体外微核检测。
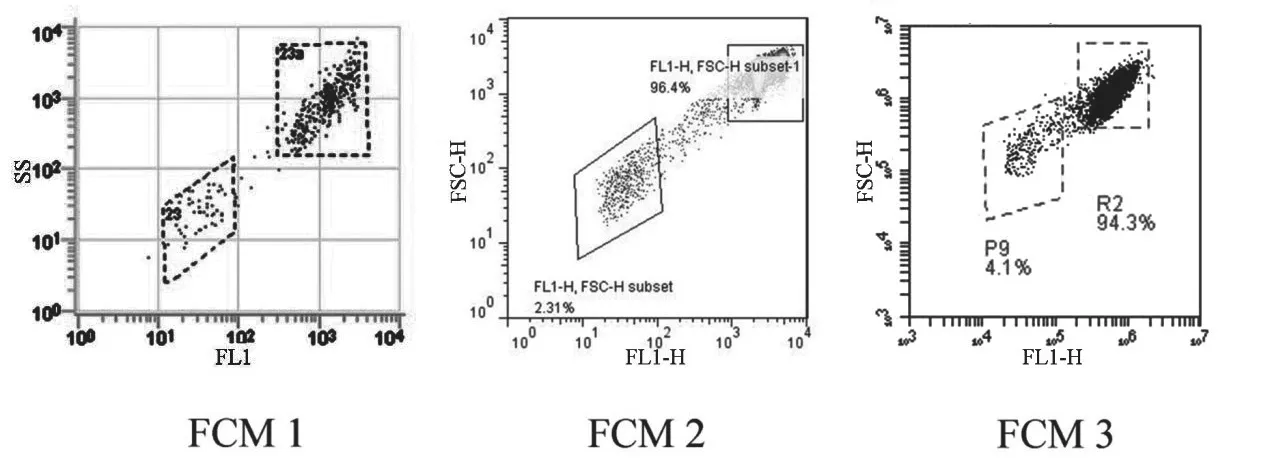
图3 TPM处理的BEAS-2B细胞二元图Fig. 3 Bivariate plots of TPM-treated BEAS-2B cells
流式细胞仪分析细胞核大小及颗粒度的参数使用前向角散射光(FSC)和侧向角散射光(SSC)。FCM2、FCM3、FCM4公司的仪器均具有以上检测指标,FCM1具备SS、FL1、FL3参数,但不具备FSC参数,在试验中发现用细胞体积(EV)参数可代替FSC参数用于体外微核的分析。由于细胞核的体积小于细胞的体积,因此在进行分析时通常需要调整FSC及SSC的值以使细胞群的位置易于分析,由于不同品牌的FCM在电压设置上有较大差异,因此无法设定具体的电压值,通常将细胞群的位置位于分析框的右上角(见图1a),同时观察是否有未裂解完全的细胞存在,以保证分析的质量。
本实验中选用的两种荧光染料分别为SYTOX Green 和EMA,其中SYTOX Green的激发波长为488 nm,发射波长为523 nm。EMA的激发波长为510 nm,发射波长为610 nm。所有FCM均具备488 nm的激发光源,因此统一选择488 nm作为激发波长。但不同型号的流式细胞仪配备的光学滤片不同,因此原则是选择仪器上与染料发射波长较为接近的滤片,具体是FCM1选择525 nm和575 nm滤片,FCM2选择530 nm和575 nm滤片,FCM3和FCM4均选择530 nm和585 nm滤片。
图1b为以SYTOX的荧光宽度(FL1-W)荧光面积(FL1-A)作图,从而排除二聚体细胞核及其他非核物质,在操作过程中,FCM1硬件上不具备FL1-W及FL1-A这两个参数,但是通过与其他的FCM实验结果进行比对,实际上二聚体细胞核数量较少,并且二聚体细胞核可以通过图1c排除,其他非核物质可以采用图1d和图1e的方式排除,因此对最终的测试结果不存在显著影响。
参与实验的FCM的硬件均满足图1c~g的分析条件,在实际操作过程中通过调整荧光电压从而使细胞核主群位于图像中右上角的位置,一般约在103的坐标位置,图1c~f门控范围设置为细胞主核荧光峰及低于主核荧光的1/100,细胞主核荧光应与细胞微核荧光呈线性关系,以避免在排除非核物质及凋亡小体的过程中误将微核排除。图1g为最终分析图,图中设了两个门,左上角的门内为健康的细胞主核群,右下方的门内为细胞微核群。
图2及图3所示为不同FCM的实际分析图,由图可以看出,不同FCM所使用的分析软件及模版有所差异,如细胞主核及微核所在的位置有所差异,门控的位置及形状也随之不一致,但是通过以上的参数调整优化,不同品牌类型的FCM均可利用分析软件检测出CHO细胞及BEAS-2B细胞的主核及微核的比例,最终计算微核率。
2.2 流式细胞仪检测卷烟烟气体外微核结果
采用2.1中所示的分析方法,对5种TPM处理的细胞分别用FCM进行检测,并计算出它们的微核率。CHO细胞检测结果如表2所示,BEAS-2B细胞检测结果如表3所示,表中所示的微核率均为3次平行试验的平均值,并根据微核率计算出不同类型FCM间微核率平均值和标准方差。结果表明:两种细胞的微核率与TPM的处理浓度基本呈剂量反应关系;不同类型FCM在同一细胞上的结果较为一致,说明FCM检测体外微核方法可在多种类型FCM间重复。

表2 FCM方法检测出的5种TPM诱导的微核率(CHO细胞)Tab. 2 Detection of 5 types of TPM-induced MN frequencies by FCM (CHO cell)

表3 FCM方法检测出的5种TPM诱导的微核率(BEAS-2B细胞)Tab. 3 Detection of 5 types of TPM-induced MN frequencies by FCM(BEAS-2B cell)
2.3 不同类型流式细胞仪检测卷烟烟气体外微核差异分析
为了研究不同类型FCM对卷烟烟气诱导的微核率测定值之间是否有显著差异,利用广义线性模型(general linear model)对不同FCM间检测的5种TPM诱导的细胞微核率进行比较。如表4中所示,按0.05显著性水平,3种类型FCM在CHO细胞上的微核率测定值之间没有显著性差异(P=0.053),且5个参比样品诱导的微核率之间也无显著性差异(P=0.779)。表5中显示,3种类型FCM在BEAS-2B细胞上的微核率测定值之间没有显著性差异(P=0.131),但是5个参比样品诱导的微核率之间存在显著性差异(P=0.000),其中1#样品(混合型)诱导的微核率高于其他4个样品,因此可以认为不同类型FCM检测卷烟烟气体外微核得出的数据差异无统计学意义,且可以分辨不同样品引发的微核率差异。

表4 多因素方差分析(CHO细胞)Tab. 4 Multivariate analysis of variance (CHO cell)因变量: 微核率

表5 多因素方差分析(BEAS-2B细胞)Tab. 5 Multivariate analysis of variance (BEAS-2B cell)因变量: 微核率
3 讨论
CHO细胞及BEAS-2B细胞的TPM处理浓度是基于多家实验室对TPM样品长期检测的结果,浓度设定基于不超过该样品在细胞中性红实验中CHO得 出 的IC50(The half maximal inhibitory concentration)值,由于BEAS-2B细胞对TPM的敏感性高于CHO细胞[15],两种细胞对TPM的IC50相差较大,因此两种细胞采用不同的TPM浓度梯度处理。检测结果表明在CHO细胞上参比样品诱导的微核率之间无显著性差异,但是在BEAS-2B细胞上参比样品诱导的微核率之间存在显著性差异,这进一步印证了BEAS-2B细胞比CHO细胞敏感,所以能检测出不同样品间的微小差异。此外,在试验中发现,BEAS-2B细胞的贴壁性低于CHO细胞,因此在细胞裂解前的处理步骤中操作需要极为轻柔,以免将细胞冲下而导致试验失败。
2008年Litron实验室组织的FCM检测体外微核共同试验选用的为小鼠淋巴瘤L5718Y细胞(悬浮细胞),选用的检测仪器均为BD品牌的FCM,检测样品为典型的遗传毒性物质如丝裂霉素C(MMC)遗传毒物,依托泊苷,长春新碱等,验证了FCM可应用于检测遗传毒性物质悬浮细胞体外微核的影响[12]。本研究选用的两种细胞均为贴壁细胞,检测样品为5种卷烟样品的TPM,并且增加了其他品牌的FCM参与检测,进一步验证了FCM检测体外微核的广泛适用性。
根据参与本次共同试验的实验室的长期比对经验,传统的显微镜检法检测卷烟烟气体外微核的实验室间RSD值一般在20~30%之间,而本研究中FCM法在2种细胞5种TPM上的的检测结果间的RSD值基本都在20%之下,说明FCM检测体外微核方法比普通的显微镜检法更在易于在多家实验室间重复,数据具有较高的一致性和稳定性。
4 结论
本研究表明,尽管不同品牌类型的FCM检测参数差异较大,但在调整优化之后均可达到卷烟烟气体外微核的检测的技术要求,在5个卷烟样品,2种不同类型的细胞上使用4种类型FCM检测卷烟烟气体外微核获得的结果一致。
[1]Nicoletti I, Migliorati G, Pagliacci M C, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and fl ow cytometry[J]. Journal of Immunological Methods, 1991, 139(2):271-279.
[2]Díaz M, Herrero M, García L A, et al. Application of flow cytometry to industrial microbial bioprocesses[J].Biochemical Engineering Journal, 2010, 48(3):385-407.
[3]Ateya D A, Erickson J S, Jr P B H, et al. The good, the bad,and the tiny: a review of micro fl ow cytometry[J]. Analytical& Bioanalytical Chemistry, 2008, 391(5):1485-1498.
[4]Carlo R, Ildo N. Analysis of apoptosis by propidium iodide staining and flow cytometry[J]. Nature Protocol, 2006,1(3):1458-61.
[5]OECD. OECD Guideline for the Testing of Chemicals Test No. 487: In Vitro Mammalian Cell Micronucleus Test[EB/OL]. 2014-09-26/2016-4-13, http://www.keepeek.com/Digital-Asset-Management/oecd/environment/test-no-487-in-vitro-mammalian-cell-micronucleustest_9789264224438-en#page1.
[6]Witt K L. Comparison of fl ow cytometry- and microscopybased methods for measuring micronucleated reticulocyte frequencies in rodents treated with nongenotoxic and genotoxic chemicals[J]. Mutation Research/fundamental& Molecular Mechanisms of Mutagenesis, 2008, 649(1-2):101–113.
[7]Cammerer Z, Elhajouji A, Suter W. In vivo micronucleus test with fl ow cytometry after acute and chronic exposures of rats to chemicals[J]. Mutation Research/fundamental &Molecular Mechanisms of Mutagenesis, 2007, 626(1-2):26-33.
[8]Avlasevich S L, Bryce S M, Cairns S E, et al. In vitro micronucleus scoring by flow cytometry: Differential staining of micronuclei versus apoptotic and necrotic chromatin enhances assay reliability[J]. Environmental &Molecular Mutagenesis, 2006, 47(1):56-66.
[9]Roman D, Locher F, Suter W, et al. Evaluation of a new procedure for the flow cytometric analysis of in vitro, chemically induced micronuclei in V79 cells[J].Environmental & Molecular Mutagenesis, 1998, 32(4):387-396.
[10]Cao J, Leibold E, Beisker W, et al. Flow cytometric analysis of in vitro micronucleus induction in hepatocytes treated with carcinogens[J]. Toxicology in Vitro, 1993, 7(4):447-51.
[11]Bryce S M, Bemis J C, Avlasevich S L, et al. In vitro micronucleus assay scored by flow cytometry provides a comprehensive evaluation of cytogenetic damage and cytotoxicity[J]. Mutation Research/fundamental &Molecular Mechanisms of Mutagenesis, 2007, 630(1-2):78-91.
[12]Bryce S M, Avlasevich S L, Bemis J C, et al. Interlaboratory evaluation of a flow cytometric, high content in vitro micronucleus assay[J]. Mutation Research/genetic Toxicology & Environmental Mutagenesis, 2008,650(2):181-195.
[13]YAO Jianhua, GAO Qian, MI Qili, et al. In vitro micronucleus assay for the analysis of total particulate matter in cigarette smoke: Comparison of flow cytometry and laser scanning cytometry with microscopy[J]. Mutation Research/fundamental & Molecular Mechanisms of Mutagenesis, 2013, 755(2):120-125.
[14]Reddel R R, Ke Y, Gerwin B I, et al. Transformation of human bronchial epithelial cells by infection with SV40 or adenovirus-12 SV40 hybrid virus, or transfection via strontium phosphate coprecipitation with a plasmid containing SV40 early region genes.[J]. Cancer Research,1988, 48(7):1904-1909.
[15]黄波, 龙颖, 李东阳. 卷烟烟气抽提物对细胞遗传毒性及茶多酚干预作用[J]. 中国公共卫生, 2013, 29(6):823-825.HUANG Bo, LONG Ying, LI Dongyang. Hereditary toxicity of cigarette smoke extraction and protection of tea polyphenols on the toxicity in BEAS-2B cells[J]. Chinese Journal of Public Health, 2013, 29(6):823-825.
Comparison study onin vitromicronucleus assay for cigarette smoke fl ow cytometry of different types
GAO Qian1, MIAO Mingming1, LI Xuemei1, YANG Zhihua2, MAO Jian3, Lu Binbin3, ZHENG Saijing4, LIU Jiangjin5,YAO Jianhua1
1 Technology Center of China Tobacco Yunnan Industrial Co., Ltd., Kunming 650106, China;2 Academy of Military Medical Sciences, Beijing 100850, China;3 Zhengzhou Tobacco Research Institute of China National Tobacco Corporation, Zhengzhou 450001, China;4 Shanghai Tobacco Group, Shanghai 200082, China;5 China Tobacco Hunan Industrial Co., Ltd., Changsha 410016, China
Objective: This paper was aimed to evaluate the applicability and stability of flow cytometry to detectin vitromicronucleus assay for cigarette smoke. Method: Chinese hamster ovary (CHO) cells and human bronchial epithelial cells(BEAS-2B) were treated with total particulate matter (TPM) from 5 cigarette brands in 4 types FCM,and test data were compared. Results: Parameters varied greatly by different types of FCM and could meet the technical requirements for testing micronucleus induced by TPM after adjustment and optimization. There are no significant differences between micronucleus frequencies of 4 FCM detected (P>0.05). Conclusion: Different types of FCM were all applicable toin vitromicronucleus testing of cigarette smoke, and test results boasted consistency and stability.
flow cytometry; cigarette smoke total particulate matter; micronucleus
高茜,缪明明,李雪梅,等. 不同类型流式细胞仪检测卷烟烟气体外微核比对研究[J]. 中国烟草学报,2016,22(4)
云南中烟工业有限责任公司项目(2015JC02);中国烟草总公司标准项目(2014QB002)
高 茜(1984—),博士,助理研究员,研究方向为烟草生物学,Tel:0871-68315903,Email:gaoqian840905@163.com
夭建华(1968—),研究员,研究方向为烟草生物学,Tel:0871-65353781,Email: jhyao_2007@126.com
2016-01-08
:GAO Qian, MIAO Mingming, LI Xuemei, et al. Comparison study onin vitromicronucleus assay for cigarette smoke fl ow cytometry of di ff erent types [J]. Acta Tabacaria Sinica, 2016,22(4)

