甘蔗梢腐病原菌分离纯化与ITS序列鉴定
何姗珊,方位宽,经 艳,谭 芳,韦永定,韦士评,梁朝旭,李 鸣
(1.广西农业科学院甘蔗研究所,广西 南宁 530007;2.广西农业科学院,广西 南宁 530007;3.广西武宣种畜场,来宾 武宣 545900)
甘蔗梢腐病原菌分离纯化与ITS序列鉴定
何姗珊1,方位宽2,经 艳1,谭 芳1,韦永定3,韦士评3,梁朝旭1,李 鸣1
(1.广西农业科学院甘蔗研究所,广西 南宁 530007;2.广西农业科学院,广西 南宁 530007;3.广西武宣种畜场,来宾 武宣 545900)
采集甘蔗梢腐病发病植株叶片为材料,采用组织分离法,分别取发病甘蔗叶片和叶片的病健交接处,用PDA培养基对甘蔗梢腐病病原菌进行分离和纯化,将纯化后的菌株进行形态学和显微镜观察,采用CTAB法提取菌丝DNA,利用2对真菌ITS通用引物进行PCR扩增,琼脂糖凝胶电泳后,回收特异条带,T克隆测序。结果表明,甘蔗梢腐病原菌ITS序列与镰刀菌属ITS序列高度同源,属于镰刀菌属。
甘蔗梢腐病;病原菌分离纯化;ITS序列鉴定
甘蔗梢腐病是一种由镰刀菌(Gibberella fujikuroi(Saw.)Wolle.,无性阶段为Fusarium moniliforme Sheldon),有性态为串珠赤霉菌(Gibberella moniliforme Wineland)引起的,是甘蔗生产中常见的一种真菌性病害(Martin JP,et al.,1984;Raid RN,et al.1991,2002)。甘蔗梢腐病主要发生在高温高湿、甘蔗生长最旺盛的6~9月份,也常发生在干旱后遇到降雨、干旱后充分灌水或施用氮肥过多等环境下。甘蔗梢腐病病原菌为镰刀菌,主要危害蔗茎的梢部和叶片,感病后引起腐烂,故名梢腐病。带病甘蔗种苗是甘蔗梢腐病的初次侵染来源,分生孢子随风雨传播,降落在梢头心叶上,依靠心叶水分萌芽侵入。被害心叶呈梯形凸凹捻曲,并有纵裂,梢头部的叶片常扭缠在一起变形,有明显褐色皱纹。生长点受害时,引起甘蔗顶端腐烂和幼轴坏死,甚至腐烂发出恶臭,致使甘蔗茎整株干死。患病部位呈褐色,上方偶有淡桃红色或淡黄色的粉霉状物,时而伴有黑色小点。该病于1921年印度尼西亚爪哇首次报道,目前几乎遍及所有甘蔗生产国和地区,并引起比较严重的病害,造成一定的损失(张国棉,2009)。早在1989年,广东省珠江三角洲蔗区梢腐病突然爆发,造成POJ2878品种10%~38%的甘蔗茎枯死(黄鸿能,1993)。目前,甘蔗梢腐病在我国南方如广西、广东、福建、台湾、云南和海南等甘蔗生产区都普遍发生。王伯辉报道,2005年广西部分蔗田甘蔗梢腐病发生较重,特别是新台糖23、新台糖25和新台糖26品种,病株率高达70%~80%(王伯辉,2007)。韦金菊等报道,2010年广西主蔗区如柳州、隆安和北海等地甘蔗梢腐病发病率在25%以上,最高达40%。随着新台糖22等易感病甘蔗品种的引进和大面积推广种植,甘蔗梢腐病发生呈逐渐加重的趋势,已经成为甘蔗生长前中期的主要病害(韦金菊,2012)。
近些年来,有关甘蔗梢腐病的研究,国外大多聚焦于病原菌Gibberella fujikuroi及其无性态串珠镰刀菌Fusarium moniliforme Sheldon的分类学、种系发育,以及代谢产物等方面进行(Hanson J.R,1996;Bacon,C.W,1996;Emma T,4000)。由于我国对甘蔗病害的基础性研究比较薄弱,与先进国家相比有较大差距,关于甘蔗病害研究还停留在甘蔗梢腐病的发生和防治(黄鸿能,1990;刘梦林,1991;冯奕玺,2002;卢昌,2002;卢文洁,2007;李钊,2013)。由于传统真菌的分类、鉴定主要是基于营养体和子实体的形态学特征并结合其生理生化性状的描述。由于真菌形态特征易受培养条件和其他因素影响,且许多子实体类型很难获得,传统分类方法无法满足准确鉴定和分类要求。近年来,由于真菌核糖体基因转录间隔区(Internal Transcribed Spacer,ITS)序列能够反映出属间、种间以及菌株间碱基对差异,已被广泛应用于真菌属内不同种间或近似属间的系统发育研究。本文除了对纯化菌株进行形态学和显微镜观察外,还利用分子技术在DNA水平对其进行ITS鉴定。
1 材料与方法
1.1 试验材料
1.1.1 材料来源
试验材料采集于广西农业科学院甘蔗研究所田间实验,实验材料为桂糖43号。利用组织分离法,分别取患有梢腐病甘蔗植株的病叶叶片,冲洗干净后,在叶片病健交界处,切下5mm×5mm的小块,用浓度为0.1%的升汞溶液消毒3min,75%乙醇溶液浸泡1min,用无菌水冲洗3次,在超净工作台吹干后转入PDA平板培养基上(取土豆200g,洗干净,去皮后切成小块,加水1000 mL煮沸25 min,用纱布过滤,加水将滤液补充至1000 mL,加入20g葡萄糖和20g琼脂,加热充分溶解即可),25℃恒温培养,待长出菌丝后,在菌落边缘用无菌接种针挑取小块带有菌丝的培养基,转移至新PDA培养基,25℃恒温培养。反复多次培养、挑菌、转移至新PDA培养基,直至无杂菌出现。
1.1.2 引物选择
利用2对真菌ITS通用引物ITS1(5’-GGAAGTAAAAGTCGTAACAAGG-3’)和ITS2(5’-TCCTCCGCTTATTGATATGC-3’),ITS3(5’-TCCGTAGGTGAACCTGCGG-3’) 和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。
1.2 试验方法
1.2.1 菌丝DNA提取
挑取菌丝,转移至PDA培养基,25℃恒温培养箱中培养,待菌落覆盖培养皿80%左右时刮下菌丝置于2ml离心管中,参照上海生工真菌基因组DNA抽提试剂盒说明书提取菌丝DNA。
1.2.2 ITS特异性扩增和序列分析
分别用真菌ITS通用引物对菌丝DNA进行PCR扩增:ITS1(5’-GGAAGTAAAAGTCGTA ACAAGG-3’)和ITS2(5’-TCCTCCGCTTATTGA TATGC-3’),ITS3(5’-TCCGTAGGTGAACCTCGG-3’)和ITS4(5’-TCCTCCGC TT ATTGATATGC-3’),以菌丝DNA为模板,用引物ITS1和ITS2进行PCR扩增,反应体系为:10×PCR Buffer 2.5μL,10mmol/LdNTPs Mixture 0.5μL,MAP1和MAP2引物(10μmol/L)各1.0μL,ddH2O 19.3μL,cDNA模板0.5μL,总体积25.0μL。反应程序为:95℃预变性3 min;95℃120 s,54℃30 s,72℃1 min,进行35个循环,72℃5min。用1%琼脂糖凝胶电泳检测PCR扩增产物,用琼脂糖凝胶回收试剂盒(天根司)回收目的片段,回收产物连接T载体,反应体系为:5.0μL SolutionⅠ,4.5μL模板,0.5μL pMD18-T载体,16℃保温2.5 h。连接产物转化大肠杆菌(E.coli)DH5α感受态细胞,37℃过夜培养,筛选阳性克隆,送至生工生物工程(上海)股份有限公司测序。
2 结果与分析
2.1 形态和显微镜观察
在PDA培养基上,菌落呈放射式,白色绒毛状(如图1),菌丝生长速度缓慢,7d左右长满培养皿,取菌丝在显微镜下观察,发现有大小两种分生孢子,大分生孢子呈镰刀形,也有莲藕状,有多个黑色小颗粒(图2);小分生孢子,呈半月形,纺锤形,且在两端各有1个黑色小颗粒(图3)。
2.2 PCR扩增和ITS序列分析
图1 在PDA培养基上的菌丝

图2 显微镜下大分生孢子形态

图3 显微镜下小分生孢子形态
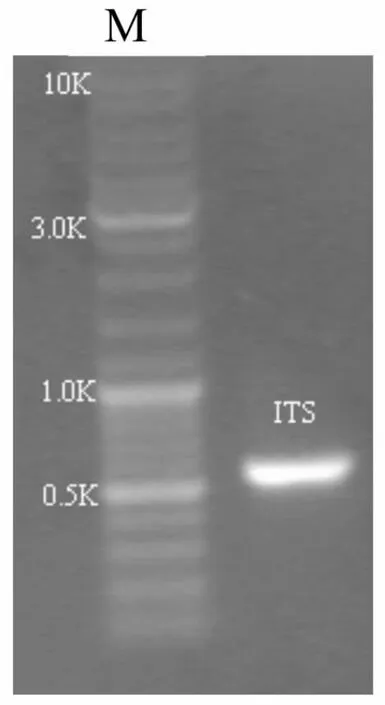
图4 PCR扩增ITS电泳结果M:DNA marker
由图4可知,1%琼脂糖凝胶电泳表明,PCR扩增产物具有很高的特异性,且产物片段大小在500-750bp之间,与预期结果一致。T-克隆送上海生个测序,获得一条长度为493bp的序列如下:
CCCTGTGACATACCAATTGTTGCCTCGGCGGA TCAGCCCGCTCCCGGTAAAACGGGACGGCCCGCC AGAGGACCCCTAAACTCTGTTTCTATATGTAACTT CTGAGTAAAACCATAAATAAATCAAAACTTTCAA CAACGGATCTCTTGGTTCTGGCATCGATGAAGAA CGCAGCAAAATGCGATAAGTAATGTGAATTGCA GAATTCAGTGAATCATCGAATCTTTGAACGCAAT TGCGCCCGCCAGTATTCTGGCGGGCATGCCTGTT CGAGCGTCATTTCAACCCTCAAGCCCCCGGGTTT GGTGTTGGGGATCGGCGAGCCCTTGCGGCAAGC CGGCCCCGAAATCTAGTGGCGGTCTCGCTGCAGC TTCCATTGCGTAGTAGTAAAACCCTCGCAACTGGT ACGCGGCGCGGCCAAGCCGTTAAACCCCCAACTT CTGAATGTTGACCTCGGATCAGGTAGGAATACCCG CTGAACTTAAGCATATC
将上述序列在NCBI中进行Blast比对,结果发现该序列与镰刀菌属呈100%的同源性(如图5)。由此表明,实验分离和纯化得到的菌丝属于镰刀菌属。
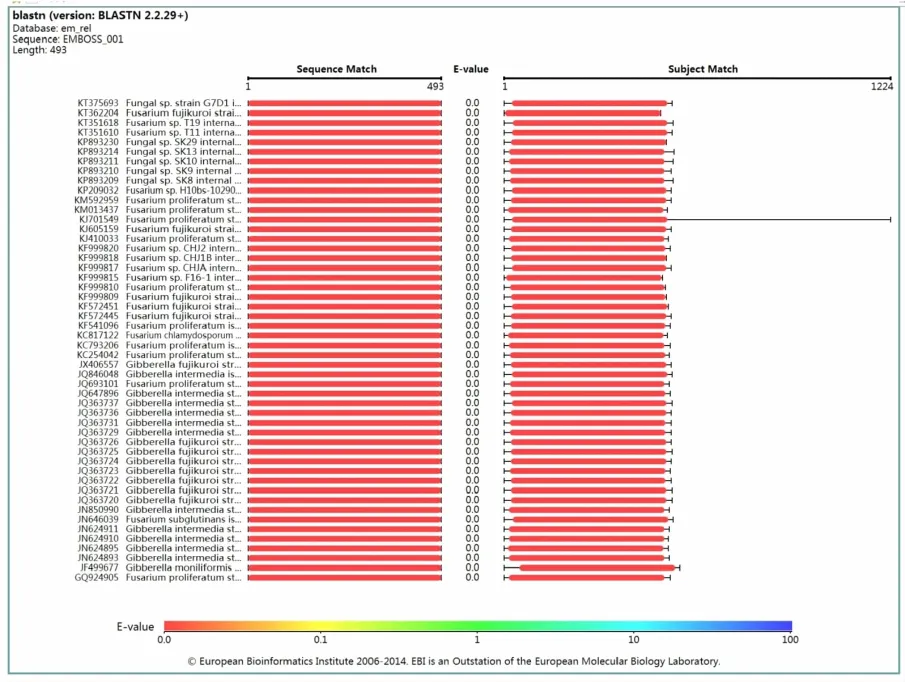
图5 序列在NCBI blast比对结果
3 结论和讨论
本试验采用组织分离法对甘蔗梢腐病病原菌进行分离、纯化,实验表明甘蔗梢腐病可以利用PDA培养基,从患有梢腐病甘蔗植株的病叶叶片快速获得,且纯化后的菌丝长势好,在25℃下生长速度快,并且污染率很低,这有可能与样品用0.1%升汞3min浸泡时间分不开,75%乙醇浸泡后,用无菌水多次冲洗后,一定置于超净工作台吹干样品,有利于减少污染。试验使用的PDA培养基不需要添加其他营养成分,培养基含有菌丝生长所需的营养物资和微量元素,完全满足菌丝分离和生长速度。
本试验关于菌种鉴定采用ITS法,其准确性高且简单易行。通过对菌丝体的ITS区段长度进行比对,验证了供试菌丝体属于镰刀菌属,为进一步研究甘蔗梢腐病提供了科学依据。
[1] Martin JP,Handojo H and Wismer CA.Pokkahboeng. Pages 157-168 in:Disease of sugarcane:major disease. 1989.Ricaud C,Egan BT,Gillaspie AG,and Hughes CG,eds.Elsevier Science Publishing Co.,Inc.,New York.
[2] 张国棉,薛林贵,张宝芹.微生物原生质体技术及其研究进展.中兽医医药杂志,2009,29(5):74-76.
[3] 黄鸿能.浅谈甘蔗病害在广东蔗区的为害及其主要防治对策.甘蔗糖业,1993(3):13-17.
[4] 王伯辉.我国甘蔗病害的发生现状与研究进展.中国糖料,2007,3:48-51.
[5] 韦金菊,邓展云,黄诚华,黄伟华,颜梅新,刘海斌.广西甘蔗主要真菌病害调查初报,南方农业学报,2012,43(9):1316-1319.
[6] Hanson JR.New metabolites of gibberellafujikuroi-X gibberellin A10.etrahedron,1996(22):701-704.
[7] 黄鸿能,邓国安,袁照明,陈玉成.东莞糖厂蔗区甘蔗梢腐病发生为害的调查.甘蔗糖业,1990,1:20-23.
[8] 刘梦林,黄冬发,李德健,张超冲.广西甘蔗梢腐病的发生和防治研究初报,广西农业科学,1991,4:175-177.
[9] 冯奕玺.甘蔗眼斑病与梢腐病的发生及防治,中国糖料,2002,1:20-22.
[10]卢昌.甘蔗梢腐病的发生为害与防治,广西植保,2002,15(3):20.
[11]卢文洁.甘蔗梢腐病的发生及综合防治措施.作物杂志,2002,02:
[12]李钊.甘蔗梢腐病症状及防治,云南科技报,2013,4月19日,第006版.
[13]张驰,高振蕊,董友魁,崔敏龙.四个大豆栽培种的花序转录组分析.《生态学杂志》,2015,34(12):3391-3396.
[14]袁阳阳,王青锋,陈进明.基于转录组测序信息的水生植物莕菜SSR标记开发.《植物科学学报》2013,31(5):485-492.
[15]张春荣,桑雪雨,渠萌,唐晓敏,程轩轩,潘利明,杨全.基于转录组测序揭示适度干旱胁迫对甘草根基因表达的调控.《中国中药杂志》,2015,40(24):4817-4823.
[16]刘红弟,陈丽,康立敏,耿金曼,孙海悦,张志东.基于转录组测序的越橘PDR转运蛋白基因的发掘及其表达分析.《吉林农业大学学报》,2015,37(6):674-681.
[17]朱立强,李庆华,张彦婷,朱相展,关方霞,薛乐勋.基于RNA-seq的杜氏盐藻全转录组测序与分析.《郑州大学学报》,2016,3(1):289-293.
[18]刘凯,谢楠,冯晓宇,姚桂桂,潘彬斌.基于RNA-seq技术对乌鳢和斑鳢肝脏的转录组分析.《经济动物学报》,2015,19(4):213-219.
[19]Sambrook J,Russell DW.Molecular Cloning[M].Huang PT,trans.3rd Edition.Beijing:Scientific Press,2002(in Chinese)萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].黄培堂,译.第3版.北京:科学出版社,2002.
[20]南文智,吴嫚,于霁雯,范术丽,黄双领,李兴丽,张红卫,张金发,喻树迅.利用高通量测序技术鉴定棉纤维发育相关miRNAs及其靶基因.棉花学报,2013,25(4):300-308.
[21]秦楠,栗东芳,杨瑞馥.高通量测序技术及其在微生物学研究中的应用.微生物学报,2011,51(4):445-457.
[22]杨静,秦智伟.基于高通量测序的逆境下植物miRNA的研究现状,中国蔬菜,2012,20:7-14.
[23]阴祖军.2011.胁迫诱导棉花microRNA的差异表达分析〔博士论文〕.泰安:山东农业大学.
[24]张玉娟,甘蔗梢腐病病原分子检测及甘蔗组合、品种的抗病性评价,福建农林大学,2009,硕士论文.
[25]Bacon CW,Porter JK,Norred WP and Leslie JF.Production of fusaric acid by Fusariumspecies.Appl.Environ.Microbiol.1996,62:4039-4043.
[26]Bartel DP,MicoRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[27]Carrington JC,Ambros V.Role of microRNAs in plant and animal development[J].Science,2003,301(5631):336-338.
[28]Du Peng,Wu Jiangguo,Zhang Jiayao,et al.Viral infection induces expression of novel phased microRNAs from conserved cellular microRNA precursors [J]. PloS Pathogens,2011,7(8):el002176.
S566.108
B
2095-820X(2016)04-05
2016-06-29
国家自然基金(31460093,31400281);广西科学研究与技术开发项目(桂科重14121005-1-2,桂科攻1598006-1-1D)。
何姗珊(1981-),女,甘肃金昌人,大学本科,主要从事甘蔗育种研究,email:shanbh613@126.com。
简介:李鸣(1977-),博士,副研究员,主要从事甘蔗育种研究工作,email:gxua9606@163.com;梁朝旭(1972-),硕士,副研究员,主要从事甘蔗育种工作,email:nnlzx@126.com。

