芎芷地龙汤对偏头痛模型三叉颈复合体PKCγ、NMDAR1作用的研究
赵永烈,胡 坤,岳广欣
芎芷地龙汤对偏头痛模型三叉颈复合体PKCγ、NMDAR1作用的研究
赵永烈1,2,胡 坤2,岳广欣3
目的 研究芎芷地龙汤对偏头痛动物模型三叉颈复合体内PKCγ、NMDAR1的影响。方法 将健康雄性SD大鼠随机分为生理盐水对照组、偏头痛模型组、芎芷地龙汤组、舒马普坦组,每组8只。给药干预后,皮下注射硝酸甘油注射剂10 mg/kg制作偏头痛动物模型,在皮下注射药物后4 h后采集标本,用Western印迹分析法测定三叉颈复合体内NMDAR1、PKCγ、pNMDAR1(Ser896)、pPKCγ (Thr514) 蛋白表达水平。结果 偏头痛模型组三叉神经脊束核PKCγ、NMDARl含量与生理盐水对照组比较差异无统计学意义(P>0.05),而pPKCγ(Thr514)、pNMDAR1(Ser896)含量较生理盐水对照组显著升高,差异有统计学意义(P<0.01),给予药物干预后,芎芷地龙汤组和舒马普坦组PKCγ、NMDARl含量与偏头痛模型组比较无统计学意义(P>0.05),而pPKCγ(Thr514)、p NMDAR1(Ser896)含量较偏头痛模型组显著降低,芎芷地龙汤组、舒马普坦组与偏头痛模型组比较差异有统计学意义(P<0.01)。结论 偏头痛伤害性信号的传导与三叉颈复合体内PKCγ和NMDARl磷酸化蛋白表达增多有关,芎芷地龙汤和舒马普坦均可抑制三叉颈复合体PKCγ和NMDARl磷酸化蛋白表达。
偏头痛;芎芷地龙汤;蛋白激酶Cγ;N-甲基-D-天冬氨酸受体1
研究表明:在偏头痛发生过程中,伤害性信息汇聚到由颈脊髓背角的C1和C2和三叉神经脊束核尾侧部(TNC)组成的三叉颈复合体(TCC),然后进一步上升到脑干不同的脑区和较高的脑结构(下丘脑和丘脑)、大脑皮层,从而产生多种临床症状。在伤害性信息感受过程中,有多种信号转导通路,其中蛋白激酶C(PKC)是重要的细胞内信号传导分子,是作为第二信使通路与c-fos(即早基因蛋白表达)偶联,被广泛应用作为神经元和痛觉激活的标志。活化的PKC 可取消Mg2+对NMDAR的阻断,增强受体通道的开放;此外,PKC可通过磷酸化NR1亚基胞质 C-末端的S-890、S-896 等多个丝氨酸位点,明显增强 NMDA 受体的功能[1-2]。因此,PKC、NMDAR信号通路可能在偏头痛的病理生理过程中发挥了重要的作用。
前期我们观察了芎芷地龙汤对偏头痛模型有镇痛、镇静作用[3-4],为进一步研究其作用机制,本实验以硝酸甘油诱发偏头痛动物模型,观察三叉颈复合体PKCγ、NMDAR1的蛋白表达及磷酸化表达情况,研究芎芷地龙汤对PKC、NMDAR的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级成年雄性SD大鼠,体重200 g±20 g;由维通利华实验动物技术有限公司提供。动物许可证号:SCXK(京)2012-0001。
1.1.2 药品与试剂 芎芷地龙汤(川芎、白芷、生石膏、地龙、元胡)由北京中医药大学东方医院制剂室提取(每毫升含生药2.0 g);硝酸甘油注射液(5 mg/mL), 北京益民药业有限公司生产;琥珀酸舒马普坦片,每片25 mg,海南先声药业有限公司生产;兔抗大鼠NMDAR1抗体;兔抗大鼠PKCγ抗体;兔抗大鼠pNMDAR1(Ser896)抗体;兔抗大鼠pPKC γ (Thr514)抗体;β-actin 抗体,Santa Cruz 公司生产。
1.2 方法
1.2.1 实验分组 将SD 大鼠随机分为4组:生理盐水对照组、偏头痛模型组、芎芷地龙汤组、舒马普坦组。生理盐水对照组、模型组灌胃生理盐水;芎芷地龙汤组灌胃芎芷地龙汤10.8 g/kg;舒马普坦组灌胃舒马普坦6 mg/kg。
1.2.2 造模及给药方法 生理盐水对照组:给予10 mL/(kg·d)生理盐水灌胃7 d,普通饲养,灌胃30 min后颈背部皮下注射2 mL/kg 生理盐水。偏头痛模型组:给予10 mL/(kg·d)生理盐水灌胃7 d,末次灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。芎芷地龙汤组:其他处理同偏头痛模型组,给予10.8 g/(kg·d) 芎芷地龙汤灌胃7 d,末次灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。舒马普坦组:其他处理同偏头痛模型组,给予琥珀酸舒马普坦6 mg/(kg·d) 灌胃7 d,灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。
1.2.3 标本的制备 动物皮下注射硝酸甘油注射剂或生理盐水后4 h采集标本。在戊巴比妥钠60 mg/kg 腹腔注射麻醉,断头取脑,快速将大鼠颈髓取出,并放入-70 ℃冰箱保存,以备进行Westen-Blot检测。
1.2.4 Western印迹法检测NMDAR1、PKCγ、pNMDAR1(Ser896)、pPKCγ(Thr514)蛋白表达
1.2.4.1 蛋白的提取 取冻存的含三叉颈复合体该节段的脑组织放入Eppendorf管中,加入0.5 mL裂解液,冰浴中机械匀浆,4 ℃ 12 000 r/min离心45 min,吸出上清。采用Folin-酚试剂法进行蛋白定量后,-20 ℃保存待用。
1.2.4.2 Western印迹分析 取脑组织匀浆液20 μL,用10%的SDS-PAGE电泳分离蛋白,将分离胶中的蛋白经水浴式电转印硝酸纤维膜上,经10%脱脂奶粉封闭1 h后,分别于兔抗鼠NMDAR1多克隆抗体(1∶300稀释)、兔抗鼠PKCγ多克隆抗体(1∶500稀释)、兔抗鼠NMDAR1Ser896位点磷酸化多克隆抗体(1∶1 000稀释)、兔抗鼠PKCγThr514位点磷酸化多克隆抗体(1∶800稀释)中孵育过夜。充分冲洗转印膜,将膜放入HRP标记的二抗(1∶1 000稀释)中室温孵育2 h。ECL 发光试剂盒显像,显影于感光胶片上,经透射扫描仪(SHARP JX330,Janpan)扫描胶片,用phoretix 1D 凝胶分析软件检测条带的灰度值。
2 结 果
2.1 各组大鼠三叉神经脊束核PKCγ和pPKCγ(Thr514)表达 偏头痛模型组三叉神经脊束核PKCγ含量较生理盐水对照组有所升高,但差异无统计学意义(P>0.05),而pPKCγ(Thr514)含量较生理盐水对照组升高明显,差异有统计学意义(P<0.01),给予药物干预后,芎芷地龙汤组和舒马普坦组PKCγ含量较偏头痛模型组有所降低,但差异无统计学意义(P>0.05),而pPKCγ(Thr514)含量较偏头痛模型组降低明显,芎芷地龙汤组、舒马普坦组与偏头痛模型组比较差异有统计学意义(P<0.01)。详见图1。
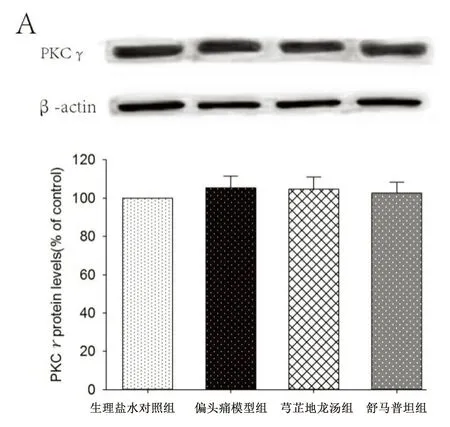
注:与生理盐水组比较,##P<0.01;与偏头痛模型组比较,**P<0.01。
图1 大鼠TCC内PKCγ、pPKCγ(Thr514) 蛋白表达及芎芷地龙汤的干预作用
2.2 各组大鼠三叉神经脊束核NMDAR1和pNMDAR1(Ser896)表达 偏头痛模型组三叉神经脊束核NMDAR1含量较生理盐水对照组有所升高,但差异无统计学意义(P>0.05),而pNMDAR1(Ser896)含量较生理盐水对照组升高明显,差异有统计学意义(P<0.01),给予药物干预后,芎芷地龙汤组和舒马普坦组PKCγ含量较偏头痛模型组有所降低,但差异无统计学意义(P>0.05),而pNMDAR1(Ser896)含量较偏头痛模型组降低明显,芎芷地龙汤组、舒马普坦组与偏头痛模型组比较差异有统计学意义(P<0.01)。详见图2。
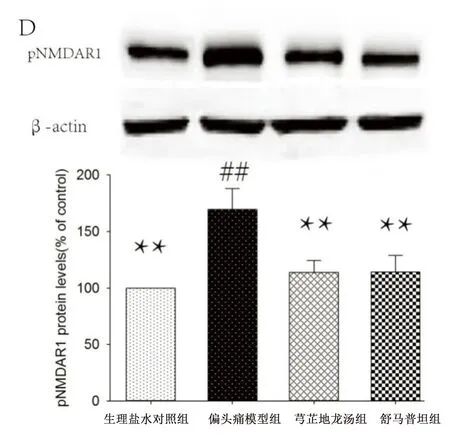
注:与生理盐水组比较,##P<0.01;与偏头痛模型组比较,**P<0.01。
图2 大鼠颈髓组织内NMDAR1、pNMDAR1(Ser896)蛋白的表达及芎芷地龙汤的干预作用
3 讨 论
大量的证据表明:偏头痛的发生和发展取决于支配脑组织(主要是脑膜及大血管)的三叉神经感觉传入神经纤维的激活和敏化[5-7]。在不同亚型和不同程度的偏头痛中,软脑膜、硬脑膜或颅外动脉周围感觉传入神经都会参与偏头痛的发病过程。对于大鼠,脑血管周围纤维具有相似的中心投射,这些投射纤维终止在由颈脊髓背角的C1和C2和三叉神经脊束核尾侧部组成的三叉颈复合体。TCC直接与脑干不同的脑区和较高的脑结构(下丘脑和丘脑)相连接,然后进一步上升与大脑皮层相连接[8-11]。TCC不仅接受来自脑血管周围纤维的中心投射,还接收来自皮质、脑干和下丘脑伤害性痛觉调节神经核的下行投射[9],在神经信号传导和痛觉的传递起着承上启下的作用。
在神经系统的伤害性感受过程中,有多种信号转导通路。其中PKC是重要的细胞内信号传导分子,是作为第二信使通路与c-fos(即早基因蛋白表达)偶联,被广泛应用作为神经元和痛觉激活的标志。在不同的解剖水平(外周神经终末,脊髓和脊髓上的部位),PKC集成了众多的受体通路进入可增加兴奋性信号和减少抑制性信号的最终效应器,进而诱发疼痛的产生[12]在静息状态,细胞中PKC主要存在于细胞浆中,当细胞受到刺激后,PKC从胞浆向胞膜移位,此过程称之为转位。PKC膜转位是PKC激活的一种表现形式。在中枢神经系统,PKC的激活可引起细胞内许多底物蛋白的磷酸化,开启或调节着各种神经信号通路,进而调节神经递质的释放[13]。PKC活性增强能减少Mg2+对NMDA受体的阻滞,促进NMDA受体通道的打开,导致痛觉过敏的形成[14]。PKC是一类Serine/Threonine蛋白激酶家族,按其对Ca2+和甘油二酯的依赖性不同,可以分为三个主要的亚家族:经典型PKC(α,βⅠ,βⅡ,γ),新型PKC(δ,ε,η,θ)非经典型PKC(ζ,λ/ι)[15]。其中PKCγ亚单位为脑、脊髓所独有,在疼痛信号处理及中枢敏感化诱导和维持中起重要作用[16-17]。在此实验中检测了TCC中PKCγ和磷酸化PKCγ(Thr514) 蛋白的表达情况,发现给予一氧化氮(NO)供体硝酸甘油后,PKCγ的蛋白表达水平与生理盐水对照组相比并无明显变化,而磷酸化PKCγ(Thr514) 蛋白表达水平较生理盐水组明显升高,提示PKC的激活一方面通过膜转位(蛋白表达量无变化),另一方面通过磷酸化(蛋白表达量有变化)进而引起伤害性信号的传导。
NMDAR广泛分布在中枢神经系统中,不仅对神经信号的传递和基因表达的调控起着主要作用,而且还影响大脑的认知功能和脑细胞的生长。过度激活的NMDAR是许多神经系统疾病的病因,末梢组织或神经损伤引起的疼痛与NMDAR的激活有关。目前已鉴定的NMDARs的亚基有NR1、NR2 (A-D )和NR3(A-B),其中NR1是该受体复合物的功能亚单位,对NMDAR的功能构成起着至关重要的作用[18]。现已知NMDA受体的突触表达受一系列蛋白激酶的调控。资料显示:活化的PKC可取消Mg2+对NMDA受体的阻断,增强受体通道的开放[19];此外,PKC也可通过磷酸化NR1亚基胞质C-末端的S-890,S-896等多个丝氨酸位点[1,20],明显增强NMDA受体的功能。近年来的研究表明:谷氨酸其受体NMDAR参与了CSD、三叉血管系统激活及中枢敏感化等与偏头痛密切相关的病理生理过程[21]。Dohrn等[22]研究发现三叉神经尾侧亚核浅层大多数含一氧化氮合酶的神经元表达NMDAR1mRNA,提示NMDAR1可能调节大部分一氧化氮的活动,谷氨酸由三叉血管系统初级传入,释放激活三叉神经尾侧亚核内的NMDAR,NMDAR的激活反过来引起一氧化氮的释放。庄志业等[23]用免疫组织化学染色技术研究表明:NMDAR1阳性胞体和纤维主要分布在三叉神经尾侧亚核浅层,N-甲基-D-天冬氨酸型受体1和2A/B亚单位免疫阳性胞体和纤维密集分布于大鼠三叉神经尾侧亚核的浅层(Ⅰ,Ⅱ层),磷酸激活的谷胺酰胺酶和谷氨酸免疫阳性胞体分布于三叉神经尾侧亚核各层,尤以浅层密集,磷酸激活的谷氨酰胺酶和谷氨酸阳性纤维及终末样结构主要分布于三叉神经尾侧亚核浅层。本研究检测了TCC中NMDAR1和磷酸化NMDAR1(Ser896)蛋白的表达情况,发现给予NO供体硝酸甘油后,NMDAR1的蛋白表达水平与生理盐水对照组相比并无明显变化,而磷酸化NMDAR1(Ser896) 蛋白表达水平较生理盐水对照组明显升高,提示NMDAR是通过磷酸化激活的变化参与偏头痛伤害性信号的传导过程。
本研究结果表明:偏头痛伤害性信号的传导与三叉颈复合体内PKCγ磷酸化和NMDAR1 serine-896位点磷酸化蛋白表达增多有关,说明PKC、NMDAR的激活在头痛发病中具有重要作用,芎芷地龙汤和舒马普坦均可抑制三叉颈复合体pPKCγ(Thr514)和NMDAR1 serine-896位点磷酸化蛋白表达,说明芎芷地龙汤治疗偏头痛的靶点可能位于这一通路。
[1] 葛志军,吴伟强,居刚,等.鞘内注射痛稳素对甲醛致痛大鼠脊髓 PKCα与 NMDA受体NR1亚单位磷酸化的影响[J].中国药理学通报,2010,21(5): 693-694.
[2] 汪健,孙磊,姚尚龙.N-甲基-D-天冬氨酸受体及其调控在麻醉镇痛中的研究进展[J].医学综述,2008,14(15):2354-2356.
[3] 赵永烈,王玉来,高颖.TL-Ⅰ号方镇痛作用的实验研究[J].中国康复理论与实践,2006,12 (1):37-38.
[4] 赵永烈,王玉来,高颖.TL-Ⅰ号方镇静作用的实验研究[J].中国康复理论与实践,2006,12 (4):332-333.
[5] Pietrobon D,Striessnig J.Neurobiology of migraine[J].Nat Rev Neurosci,2003,4(5):386-398.
[6] Olesen J,Burstein R,Ashina M,et al.Origin of pain in migraine:evidence for peripheral sensitisation[J].Lancet Neurol,2009,8(7):679-690.
[7] Levy D.Migraine pain and nociceptor activation:where do we stand? [J].Headache,2010,50(5):909-916.
[8] Edvinsson L.Tracing neural connections to pain pathways with relevance to primary headaches[J].Cephalalgia,2011,31(6):737-747.
[9] Akerman S,Holland PR,Goadsby PJ.Diencephalic and brainstem mechanisms in migraine[J].Nat Rev Neurosci,2011,12(10):570-584.
[10] Noseda R,Jakubowski M,Kainz V,et al.Cortical projections of functionally identified thalamic trigeminovascular neurons:implications for migraine headache and its associated symptoms[J].J Neurosci,2011,31(40):14204-14217.
[11] Pietrobon D,Moskowitz MA.Pathophysiology of migraine[J].Annu Rev Physiol, 2013,75:365-391.
[12] Velazquez KT,Mohammad H,Sweitzer SM.Protein kinase C in pain:involvement of multiple isoforms[J].Pharmacol Res,2007,55(6):578-589.
[13] Santafé MM,Lanuza MA,Garcia N,et al.Calcium inflow-dependent protein kinase c activity is involved in the modulation of transmitter release in the neuromuscular junction of the adult rat[J].Synapse,2005,57(2):76-84.
[14] Sluka K,Audette K.Activation of protein kinase C in the spinalcord produces mechanical hyperalgesia by activating glutamate receptors,but does not mediate chronic muscle-induced hyperalgesia[J].Mol Pain,2006,2(13):1-9.
[15] Way KJ,Chou E,King GL.Identification of PKCisoforms-specific biological actions using pharmacological approaches[J].Trends Pharmacol Sci,2000,21:181-187.
[16] Mellor H,Parker PJ.The extended protein kinase C superfamily[J].Biochem J,1998,332(12):281-292.
[17] Nishizuka Y.Protein kinase C and lipid signaling for sustained cellular responses[J].FASEB J,1995,9(7):484-496.
[18] Ishii T,Moriyoshi K,Sugihara H,et al.Molecular characterization of the family of the N-methyl-D-aspartate receptor subunits[J].J Biol Chem,1993,268:2836 -2843.
[19] Chen L,Huang LY.Protein kinase C reduces Mg2+block of NMDA-receptor channels as a mechanism of modulation[J].Nature,1992,356(6369):521-523.
[20] Stephenson FA,Cousins SL,Kenny AV.Assembly and forward trafficking of NMDA receptors[J].Mol Membr Biol,2008,25(4):311-320.
[21] Ramadan NM.The link between glutamate and migraine[J].CNS Spectr,2003,8(6):446-449.
[22] Dohrn CS,Beitz AJ.NMDA receptor mRNA expression in NOS-containing neurons in the spinal trigeminal nucleus of the rat[J].Neurosci Lett,1994,175:28.
[23] 庄志业,刘大庸,李云庆.大鼠三叉神经尾侧亚核内N-甲基-D-天冬胺酸型受体与磷酸激活的谷氨酰胺酶和谷氨酸的分布[J].解剖学杂志,1998,21(6):528-533.
(本文编辑郭怀印)
Research of Xiongzhi Dilong Decoction on PKCγ,NMDAR1 in the Trigeminocervical Complex in Migraine Animal
Zhao Yonglie,Hu Kun,Yue Guangxin
Dongfang Hospital,Beijing University of Chinese Medicine,Beijing 100078,China;The Third Hospital,Beijing University of Chinese Medicine,Beijing 100029,China
Objective To study the effects of Xiongzhi Dilong decoction (XDD) on PKCγ,NMDAR1 in the trigeminocervical complex in migraine animal.Methods Healthy male Sprague-Dawley (SD) rats were randomly divided into four groups:saline group,migraine model group,sumatriptan group and XDD group,8 rats in each group.The migraine animal model was made by subcutaneous injection of nitroglycerin (NTG).After administered with corresponding drug,specimens was collected after 4 hours of NTG subcutaneous injection.The protein expression levels of N-methyl-D-aspartate (NMDA) receptor-1(NMDAR1),protein kinase C (PKC)γ,pNMDAR1(Ser896),pPKCγ (Thr514) in the trigeminocervical complex of migraine animal were assayed by western blot analysis.Results The protein expression level of pPKCγ(Thr514),pNMDAR1(Ser896) in migraine model group were higher than that in saline group(P<0.01).After administration,the protein expression levels of pPKCγ(Thr514),pNMDAR1(Ser896) were significantly decreased in XDD group and sumatriptan group compared with the migraine model group(P<0.01).Conclusion The conduction of pain signal in migraine is related to the expression of pPKCγ and pNMDAR1 in trigeminocervical complex.XDD and sumatriptan can inhibit the protein expression levels of pPKCγ and pNMDAR1 in trigeminocervical complex.
migraine;Xiongzhi Dilong decoction;protein kinase C γ;N-methyl-D-aspartate receptor-1
国家自然科学基金资助项目(No.81373591);北京中医药大学自主选题(No.2013-JYBZZ-JS-096)
1.北京中医药大学东方医院(北京 100078),E-mail:yongy3@126.com;2.北京中医药大学第三附属医院;3.中国中医科学院
引用信息:赵永烈,胡坤,岳广欣.芎芷地龙汤对偏头痛模型三叉颈复合体PKCγ、NMDAR1作用的研究[J].中西医结合心脑血管病杂志,2016,14(19):2248-2251.
R742.2 R285.5
A
10.3969/j.issn.1672-1349.2016.19.013
1672-1349(2016)19-2248-04
2016-04-01)

