纯碱中少量NaHCO3的快速分析方法
喻长军
(江苏省盐城技师学院 环境工程系 224007)
纯碱中少量NaHCO3的快速分析方法
喻长军
(江苏省盐城技师学院 环境工程系 224007)
混合碱的测定是分析化学定量实验中最基本的实验之一,实验教材中大都采用双指示剂法(酚酞、甲基橙)来测定混合碱的含量。这种方法简便、快速、实用,但存在着较大的偏差。为了改进双指示剂法的这种弊端,本文采用了NaOH方法来测定,并对此方法进行了分析和讨论。
纯碱 NaHCO3NaOH 酚酞 分析
引言
纯碱就是碳酸钠,是最重要的化工工业原材料之一,广泛地应用于玻璃、化工工业(烧碱、硝酸钠、清洁剂、软化硬水)、石化、冶金等行业,同时也应用在造纸、肥皂、纺织、印染、皮革、食品、医药、胶卷、轻工等行业。但纯碱长期暴露在空气中会吸收空气中的水分及二氧化碳生成NaHCO3。Na2CO3和NaHCO3共同存在时,由于纯碱中碳酸钠和碳酸氢钠两者含量相差悬殊,用双指示剂「1~3」时对微量成分也测不出准确结果,误差很大。但是如果采用NaHCO3和NaOH起作用这特点,排除碳酸钠能与酚酞的显色,便可以用NaOH来滴定NaHCO3,从而进行检测。
一、实验部分
1.原理:Na2CO3溶液加酚酞后呈粉红色,而NaHCO3加酚酞后是无色的,试样中Na2CO3中的CO32-用钡离子沉淀,在本文中选用的是氯化钡「4~5」加入氯化钡后溶液就由粉红色变为白色了,然后再用NaOH滴定即可。
其反应式如下:
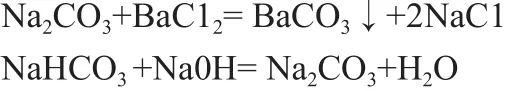
2.仪器和药品
(1)仪器:
1000mL和250mL容量瓶、250mL锥形瓶、50mL滴定管、25mL移液管、 电子天平(上海上天精密有限公司)、50mL和250mL的烧杯
(2)药品
Na2CO3宜兴市第二化学试剂厂 (分析纯)
NaHCO3上海虹光化工厂 (分析纯)
NaOH 天津市博迪化工有限公司 (分析纯)
BaC12上海中试化工总公司 (分析纯)
酚酞 宜兴市第二化学试剂厂 (分析纯)
去离子水
NaOH标准溶液(0.1mol/L) 准确称取4.0g NaOH于50mL的烧杯中,加去离子水使之溶解,然后用移液管移入1000mL容量瓶中,向刚才的烧杯中加去离子水洗涤3次。将洗涤液也倒入容量瓶中,加去离子水到距离刻度线还有3到5cm时改用胶头滴管加到刻度线,摇匀,定容。
BaC12溶液(0.1mol/L)准确称取6.1g BaC12于50mL的烧杯中,加去离子水使之溶解,然后用移液管移入250mL容量瓶中,向刚才的烧杯中加去离子水洗涤3次。将洗涤液也倒入容量瓶中,加去离子水到距离刻度线还有3到5cm时改用胶头滴管加到刻度线,摇匀,定容。
酚酞指示剂(1g/L )准确称取1.0g酚酞溶于600mL乙醇中,加水稀释至1L。
(3)操作步骤:
准确称取9.9122g Na2CO3和0.08780g NaHCO3,溶于250mL的容量瓶中稀释至刻度后并且摇匀。上述溶液即为已知含量的混合溶液,本实验即用此溶液来分析纯碱中微量NaHCO3的含量。
用移液管移取25mL上述溶液于250mL锥形瓶中,加1~ 2滴酚酞作指示剂,加入0.1mol/LBaCl2边加边振荡,直至溶液完全变成白色,再加入过量20%的BaCl2,接着用50mL滴定管0.1mol/L NaOH标准溶液滴定并用力摇匀使NaHCO3反应完全,当出现粉红色且在30s内不褪色即为终点。具体分析数据如下:(其中V0(NaOH)表示NaOH的起始读数,V1(NaOH)表示NaOH的终点读数,V(NaOH)表示NaOH的所用总体积,C(NaHCO3)表示NaHCO3的浓度,w(NaHCO3)表示NaHCO3的百分含量。)
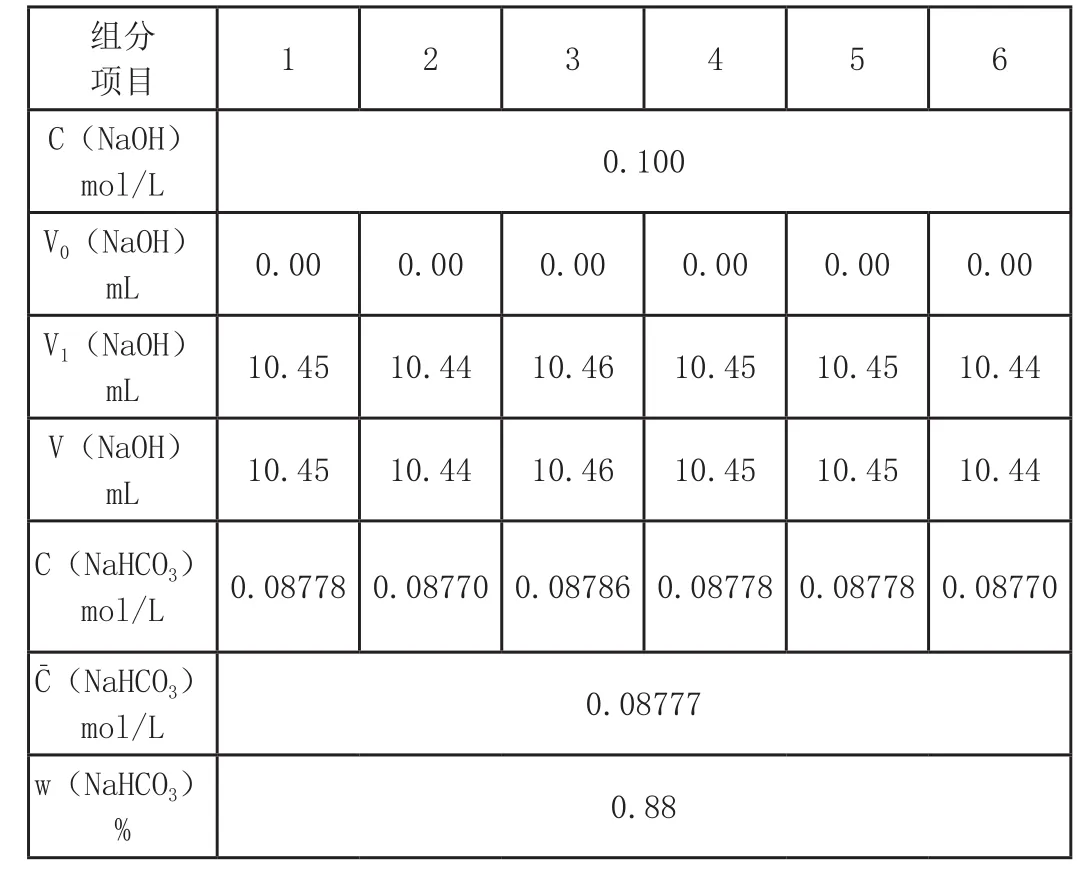
组分项目1 2 3 4 5 6 C(NaOH)mol/L 0.100 V0(NaOH)mL 0.00 0.00 0.00 0.00 0.00 0.00 V1(NaOH)mL 10.45 10.44 10.46 10.45 10.45 10.44 V(NaOH)mL 10.45 10.44 10.46 10.45 10.45 10.44 C(NaHCO3)mol/L 0.08778 0.08770 0.08786 0.08778 0.08778 0.08770 C(NaHCO3)mol/L 0.08777 w(NaHCO3)% 0.88
二、讨论和分析
1.加入BaCl2的量是很重要的,其目的是为了除去溶液里面的CO32-也使酚酞指示剂发挥应有的显色目的,避免Na2CO3的干扰,从而使实验有针对性。因此0.1 mol/L氯化钡的加入量以过量20%,进行氯化钡法测定,以提高分析结果的准确度和精密度。
2.如果加入BaCl2的量为理论值,那么当加入氯化钡后溶液由粉红色变为白色,此时溶液中的CO32-即已被完全沉淀。接着用NaOH标准溶液滴定,此时NaHCO3立即与NaOH反应生成Na2CO3,则溶液又立即变成粉红色,那么对终点的确定有影响。所以应加入BaCl2的量为过量20%,以消除NaHCO3生成的Na2CO3的影响。
3.终点时溶液变成粉红色是由于NaOH与酚酞作用。
4.加BaCl2时会出现沉淀,此时无须过滤,否则会影响实验的准确性。
5.在双指示剂测定时一般用酚酞作指示剂,用去的盐酸体积可以记为V1,甲基橙作指示剂时,又用去的盐酸体积可以记为V2。根据V1和V2数值的大小可判断混合碱的组成。若V1= V2, 试样组成为Na2CO3;若V1> V2> > 0 ,试样组成为NaOH和Na2CO3混合物;若V2> V1= 0 ,试样组成为NaHCO3;若V1> V2= 0 ,试样组成为NaOH ;当V2> V1> 0时,试样组成为NaHCO3和Na2CO3的混合物,则Na2CO3和NaHCO3的百分含量可由下列式子计算:

