glipr1基因的原核表达及多克隆抗体制备
生秀梅,陈 龙,王正新
glipr1基因的原核表达及多克隆抗体制备
生秀梅1,2,陈 龙1,王正新2
目的 克隆表达胶质瘤致病相关蛋白1基因(glipr1)并制备多克隆抗体,运用该抗体检测各肿瘤细胞系中GLIPR1的表达。方法 通过PCR技术以含glipr1基因的cDNA克隆质粒(pLX304-glipr1)为模板获得glipr1(M)片段,再将此片段克隆至表达载体pET-15b上,并转入大肠杆菌BL21-CodonPlus(DE3)进行表达;Ni柱纯化后的GLIPR1(M)蛋白作为抗原免疫家兔,获得多克隆抗体,Western blot法检测其特异性,并检测GLIPR1在A549、PC14、LNCaP、PC3及U87细胞中的表达。结果 成功构建了表达载体pET-15b-glipr1(M),并获得了纯化的GLIPR1(M)蛋白,成功制备了兔抗GLIPR1多克隆抗体,特异性高,可用于检测各细胞系中GLIPR1的表达,GLIPR1在U87中的表达最高。结论 成功表达了GLIPR1(M)蛋白,并获得了多克隆抗体,为进一步研究GLIPR1的功能和作用机制奠定了基础。
GLIPR1;蛋白表达;多克隆抗体
胶质瘤致病相关蛋白1基因(glipr1)是从胶质细胞瘤中克隆出来的新基因[1-2]。GLIPR1蛋白有一段信号肽和一段跨膜区段,在结构上与PR-1(group 1 plant pathogenesis-related proteins)同源[3-4]。研究[1-2,5-6]表明GLIPR1高表达与髓单核细胞的分化有关,神经胶质瘤和星形细胞瘤发病过程中,GLIPR1的表达显著增加。亦有报道[7-9]指出GLIPR1是p53靶基因,其过表达可诱导前列腺癌、结肠癌的细胞凋亡。前期研究[10]显示GLIPR1高表达抑制肺癌细胞的生长,但其机制尚不明确。该实验通过原核表达GLIPR1蛋白的抗原性区段(去除信号肽及跨膜后区段),制备其兔多克隆抗体,为进一步研究肿瘤细胞中GLIPR1的表达、分布规律,以及参与调节肿瘤细胞生长的具体机制奠定基础。
1 材料与方法
1.1 材料 原核表达质粒pET-15b、E.coliBL21-CodonPlus(DE3)感受态细胞、A549细胞,LNCaP细胞、PC14细胞及U87细胞由克拉克亚特兰大学肿瘤研究与治疗发展中心保存。人glipr1基因cDNA克隆 (HsCD00441029) 购自美国DNASU公司。
1.2 方法
1.2.1 目的基因的获得 根据GenBank注册的GLIPR1序列(HQ447422)设计并合成上下游引物GLIPR1-NOSIG-F和GLIPR1-NOTM-R,分别在上下游引物的5′端加接Nde I和BamHⅠ酶切位点序列, 引物序列为:GLIPR1- NOSIG-F:5′-GGAATTCCATATGGCAAATATTTTGCCAGATATCG-3′(下划线为Nde I酶切位点),GLIPR1-NOTM-R:5′-CGGGATCCTTATCTGTTACGTGGATATATGGGCC-3′(下划线为BamHⅠ酶切位点)。以含有glipr1基因的cDNA克隆质粒(pLX304-glipr1)为模板,以GLIPR1-NOSIG-F和GLIPR1-NOTM-R为引物,利用高保真DNA聚合酶pfu对目的基因进行扩增。扩增片段为glipr1基因去除N末端信号肽序列和去除自跨膜区段开始C末端序列的区段,即glipr1基因的55~711 bp部分,在上游引物加上起始密码子ATG,用glipr(M)表示。
1.2.2 重组表达载体的构建及鉴定 胶回收PCR产物和表达载体pET-15b 经Nde I和BamHⅠ双酶切后,PCR酶切产物经酚仿-乙醇法纯化后与胶回收的pET-15b载体酶切产物用T4DNA连接酶室温连接过夜,将连接产物热激转化入E.coliBL21-CodonPlus (DE3)感受态细胞,次日从平板上挑取12个菌落接种于含氨苄西林的LB平板上,37 ℃培养8 h后,将上述菌体和空载体转化菌体收集于含30 μl蒸馏水的EP管中,再加入等体积的酚/氯仿/异戊醇(25 ∶24 ∶1) 混合液,在振荡器上剧烈振荡,离心(12 000 r/min、2 min)后取10 μl上清液,用0.7%琼脂糖凝胶电泳观察质粒大小,初步筛选阳性克隆质粒,提取初筛阳性克隆质粒经过PCR和双酶切验证后,通过DNA测序分析最终确认。
1.2.3 重组蛋白的表达 分别挑取含重组质粒pET-15b-glipr1(M)和空质粒pET-15b的E.coliBL21-CodonPlus(DE3)单菌落于2 ml LB液体培养基中(氨苄西林100 μg/ml),37 ℃振摇过夜。次日以1 ∶100比例转接入20 ml的LB培养液中,37 ℃振摇至吸光度(optical density,OD)值OD600为0.6,加入IPTG至终浓度为1 mmol/L,30 ℃振摇4 h,冰浴10 min后收集菌体,洗涤后用500 μl PBS缓冲液重悬菌液,取出100 μl用于全菌蛋白电泳,剩余菌液4 ℃超声破碎,离心(12 000 r/min、15 min、4 ℃),取全菌、上清液和沉淀进行SDS-PAGE电泳。
1.2.4 重组蛋白纯化 因GLIPR1(M)蛋白主要存在于包涵体,用5 ml 平衡缓冲液(100 mmol/L NaH2PO4、10 mmol/L Tris-Cl、8 mol/L urea, pH 8.0)重悬包涵体,混匀后冰浴30 min。冰浴过程中超声裂解细菌(加入蛋白酶抑制剂1 mmol/L PMSF)。4 ℃、12 000 r/min离心20 min,收集上清液。上清液移入塑料离心管中,加入1 ml的NTA-Ni2+柱,不间断轻轻转动,室温2 h。将上述混合物转移到5 ml 注射器中,事先用滤纸封住底部。拔掉注射器针头让液体可以顺利流出。加入洗脱缓冲液 (100 mmol/L NaH2PO4、10 mmol/L Tris-Cl、 8 mol/L urea, pH 6.3)洗涤液,去除杂蛋白,当流出洗涤液OD280<0.01时,向 NTA-Ni2+柱中加入1 ml洗脱液洗脱4~5次,收集洗脱液,测蛋白浓度。SDS-PAGE 检测纯化后蛋白的纯度。
1.2.5 GLIPR1(M)的抗原性分析 利用antherprot[11]软件按照Parker et al[12]报道的方法对GLIPR1(M)进行抗原性分析。
1.2.6 兔抗GLIPR1(M)蛋白多克隆抗体的制备 用纯化的GLIPR1(M)蛋白作为免疫原,与等体积的弗氏完全佐剂充分研磨至完全乳化,每只家兔以1 ml乳化的免疫原,背部皮下多点注射法免疫家兔。初次免疫前采集兔耳缘静脉血液,取血清作阴性对照,第1次免疫后每隔2周免疫家兔,共免疫4次,末次免疫1周后颈动脉放血并获得抗血清,用半饱和硫酸铵盐析法和透析除盐法获得粗提的多克隆抗体,分装保存于-20 ℃。
1.2.7 Western blot法验证GLIPR1抗体 以每泳道2 μg GLIPR1(M)抗原蛋白进行12% SDS-PAGE凝胶电泳,电转至聚偏二氟乙烯(PVDF)膜上,将转膜后的PVDF膜用含3%的脱脂奶粉的TBST封闭1 h后,分别用上述anti-GLIPR1以1 ∶500、1 ∶1 000、1 ∶2 000、1 ∶10 000及购自Abnova 公司(台湾)的GLIPR1抗体和对应的二抗进行免疫标记,ECL化学发光试剂A、B液1 ∶1混匀,覆盖于PVDF膜的蛋白面,全自动凝胶成像系统进行曝光验证GLIPR1抗体。
1.2.8 Western blot法检测GLIPR1在各肿瘤细胞系中的表达 收集A549、PC14、U87、PC3及LNCaP细胞,用蛋白裂解液裂解后离心(12 000 r/min、10 min、4 ℃)取上清液,测定浓度后,以各泳道5 μg进行12% SDS-PAGE凝胶电泳,用1 ∶2 000 的anti-GLIPR1和对应的二抗进行免疫标记,检测A549、PC14、U87、PC3及LNCaP细胞中GLIPR1的表达。
2 结果
2.1 重组质粒pET-15b-glipr1(M)的构建 以含有glipr1基因的cDNA克隆质粒(pLX304-glipr1)为模板,以GLIPR1-NOSIG-F和GLIPR1-NOTM-R为引物,PCR扩增获得约657 bp的DNA片段,该片段为glipr1基因去除N末端信号肽序列和去除自跨膜区段开始C末端序列的区段(图1A),命名为glipr1(M)。将此片段回收、酶切后插入pET-15b构建成表达载体pET-15b-glipr1(M),然后转化大肠杆菌E.coliBL21-CodonPlus(DE3),挑取单克隆,提取质粒,经Nde Ⅰ和BamHⅠ双酶切验证,证明重组质粒pET-15b-glipr1(M)构建成功(图1B)。
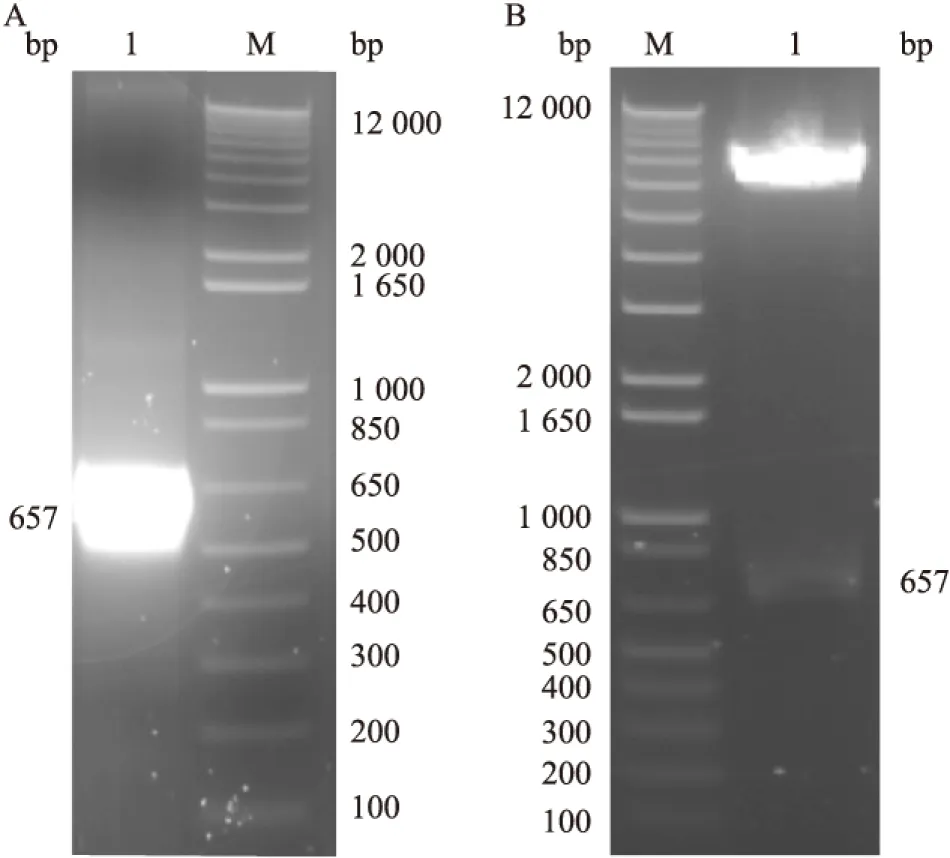
图1 重组表达质粒pET-15b-glipr1(M)的构建和鉴定
A:glipr1(M)基因PCR产物;1:PCR产物;M:1 000 bp plus DNA Ladder;B:pET-15b-glipr1(M)重组质粒酶切鉴定;M:1 000 bp plus DNA Ladder;1:pET-15b-glipr1(M)酶切结果
2.2 重组GLIPR1(M)蛋白的表达与纯化 表达载体pET-15b-glipr1(M)转入表达宿主菌E.coliBL21-CodonPlus(DE3)中,37 ℃振摇至OD600为0.6后,经IPTG诱导4 h,超声裂解细菌分别制备全菌蛋白、可溶性上清液和沉淀蛋白样品,进行SDS-PAGE电泳分析。结果表明pET-15b-glipr1(M)在大肠埃希菌E.coliBL21-CodonPlus(DE3)中成功表达,但主要以包涵体形式存在(图2)。通过利用Ni柱亲和纯化后,产物经SDS-PAGE电泳分析表明经过纯化后的GLIPR1(M)蛋白纯度较高,可用于兔抗GLIPR1(M)蛋白的多克隆抗体制备(图3)。
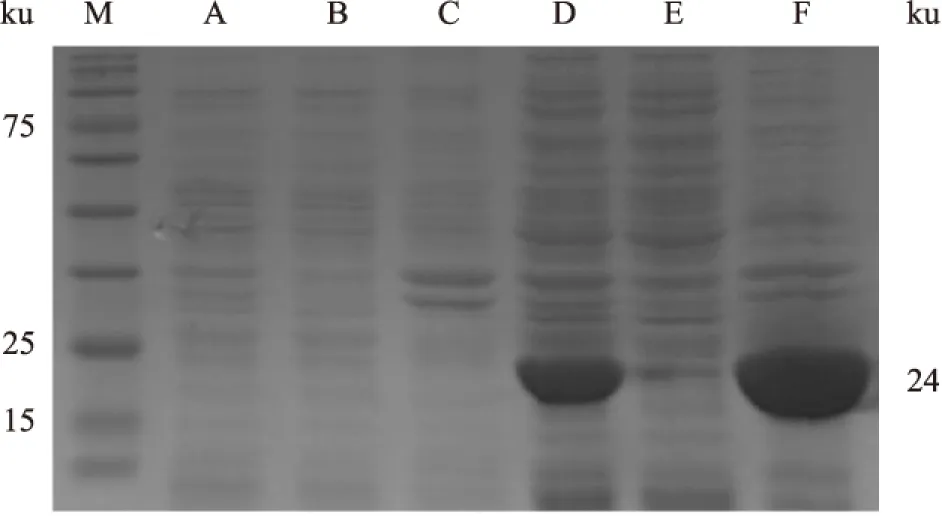
图2 SDS-PAGE鉴定重组GLIPR1(M)蛋白
M:宽范围彩色预染蛋白质标准;A:空质粒转化菌全菌蛋白;B:空质粒转化菌上清液;C:空质粒转化菌包涵体;D:重组表达菌全菌蛋白;E:重组表达菌上清;F:重组表达菌包涵体

图3 重组GLIPR1(M)蛋白的纯化
M:宽范围蛋白质标准;A:切胶纯化后的GLIPR1(M)蛋白;B~G:Ni柱亲和纯化后的GLIPR1(M)蛋白
2.3 兔抗GLIPR1(M)蛋白的多克隆抗体制备 应用antherprot软件对GLIPR1(M)蛋白进行抗原性分析,证明GLIPR1(M)蛋白抗原性预测值较高,可用于制备抗GLIPR1抗体。将抗GLIPR1蛋白的抗血清以1 ∶500、1 ∶1 000、1 ∶2 000及1 ∶10 000倍比稀释作为一抗,GLIPR1抗体1 ∶1 000为阳性对照,以纯化的GLIPR1(M)蛋白为检测对象,进行Western blot分析。结果表明抗GLIPR1(M)蛋白的抗血清在24 ku处能检测到符合预期大小的条带,且最低效价为1 ∶10 000,适宜的Westem blot使用效价为1 ∶2 000(图4)。
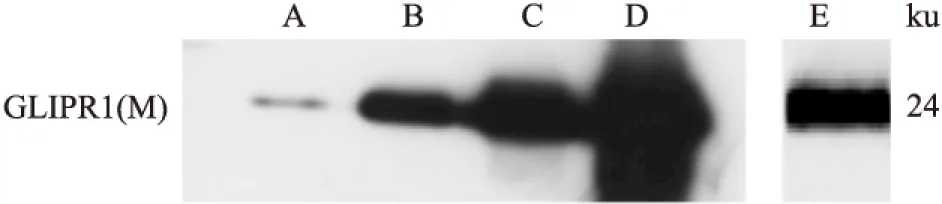
图4 Western blot检测抗GLIPR1抗体的特异性
A:1 ∶10 000;B:1 ∶2 000;C:1 ∶1 000;D:1 ∶500 ;E:1 ∶1 000 GLIPR1抗体与2 μg GLIPR1(M)抗原蛋白
2.4 抗GLIPR1抗体检测GLIPR1在各细胞系中的表达 为了进一步考察该多克隆抗体是否可用于检测细胞系中GLIPR1的表达,本实验用1 ∶2 000的anti-GLIPR1和对应的二抗进行免疫标记,Western blot法检测了A549、PC14、U87、PC3及LNCaP细胞中GLIPR1的表达。GLIPR1(全长约为30 ku)在人恶性胶质母细胞瘤U87细胞中表达最高,前列腺癌PC3中亦有表达,A549细胞中只有微量表达,而PC14和LNCaP细胞并未检测到GLIPR1蛋白。表明本实验制备的抗GLIPR1抗体适用于后期Western blot分析。见图5。
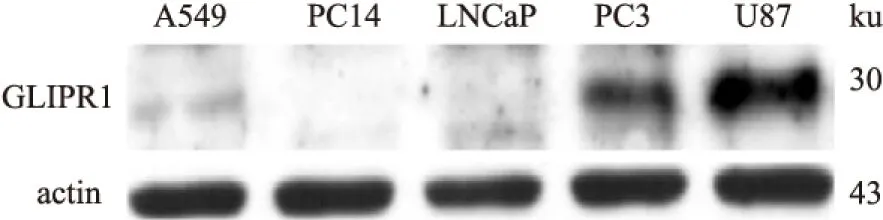
图5 GLIPR1在A549、PC14、LNCaP、PC3及U87细胞中的表达
3 讨论
胶质瘤致病相关蛋白1(GLIPR1)又称为RTVP-1,是富含半胱氨酸分泌蛋白家族CAP的一员[3]。早期作为原癌基因被发现于人神经胶质瘤中[1]。星形脑恶性肿瘤中GLIPR1的表达较高,其表达水平与星形细胞肿瘤的恶性程度呈正相关性[1-2,6]。GLIPR1的高表达促进神经胶质瘤的增殖、存活、侵袭及转移[6]。肾母细胞瘤中GLIPR1亦作为原癌基因发挥功能[13]。但是,在前列腺癌细胞中,GLIPR1表达较低,为p53调节基因,GLIPR1的高表达可产生活性氧,从而导致多种前列腺肿瘤细胞系的凋亡[14]。本实验室前期研究[10]显示肺癌细胞中GLIPR1的mRNA水平亦很低,其高表达会导致A549细胞的死亡。GLIPR1在不同细胞系中的表达差异和功能差异引起了注意,为进一步研究GLIPR1的功能和机制,本研究克隆表达了GLIPR1(M)蛋白,并制备了兔抗重组蛋白的多克隆抗体,特异性高。同时,本研究运用该抗体通过Western blot法检测了A549、PC14、U87、PC3及LNCaP细胞中GLIPR1的表达。与前期研究[1-2,6]报道一致,人恶性胶质母细胞瘤U87细胞中GLIPR1的表达最高,前列腺癌PC3中亦有表达,这与本研究结果GLIPR1在PC3中执行双重功能一致,即低浓度的GLIPR1有利于PC3的生长,而高浓度的PC3则抑制PC3的增殖。A549、PC14和LNCaP细胞中GLIPR1的表达较低,与GLIPR1在这些细胞中发挥抑癌功能相符[7-9,14-16]。综上所述,本实验成功制备了高效特异的抗GLIPR1多克隆抗体,为进一步研究的功能和机制奠定了基础。
[1] Murphy E V,Zhang Y,Zhu W,et al.The human glioma pathogenesis-related protein is structurally related to plant pathogenesis-related proteins and its gene is expressed specifically in brain tumors[J]. Gene,1995,159(1):131-5.
[2] Rich T,Chen P,Furman F,et al. RTVP-1, a novel human gene with sequence similarity to genes of diverse species, is expressed in tumor cell lines of glial but not neuronal origin[J]. Gene,1996,180(1-2):125-30.
[3] Gibbs G M,Roelants K,O'Bryan M K.The CAP superfamily: cysteine-rich secretory proteins,antigen 5,and pathogenesis-related 1 proteins-roles in reproduction,cancer,and immune defense[J]. Endocr Rev,2008,29(7):865-97.
[4] Szyperski T, Fernandez C, Mumenthaler C, et al. Structure comparison of human glioma pathogenesis-related protein GLIPR and the plant pathogenesis-related protein P14a indicates a functional link between the human immune system and a plant defense system[J]. Proc Natl Acad Sci U S A,1998,95(5):2262-6.
[5] Gringras M C, Margolin J F. Differential expression of multiple unexpected genes during U937 cell and macrophage differentiation detected by suppressive subtractive hybridization[J]. Exp Hematol,2000,28(1):65-76.
[6] Rosenzweig T,Ziv-Av A,Xiang C,et al.Related to testes-specific, vespid, and pathogenesis protein-1(RTVP-1) is overexpressed in gliomas and regulates the growth,survival,and invasion of glioma cells[J]. Cancer Res, 2006, 66(8):4139-48.
[7] Thompson T C. Glioma pathogenesis-related protein 1:tumor-suppressor activities and therapeutic potential[J]. Yonsei Med J, 2010, 51(4):479-83.
[8] Li L,Ren C,Yang G,et al. GLIPR1 suppresses prostate cancer development through targeted oncoprotein destruction[J].Cancer Res,2011,71(24):7694-704.
[9] Li L,Yang G,Ren C,et al.Glioma pathogenesis-related protein 1 induces prostate cancer cell death through Hsc70-mediated suppression of AURKA and TPX2[J]. Mol Oncol,2013, 7(3):484-96.
[10]Sheng X,Bowen N,Wang Z. GLI pathogenesis-related 1 functions as a tumor-suppressor in lung cancer[J]. Mol Cancer, 2016,15:25.
[11]Jayaraj S,Reid R,Santi D V.GeMS:an advanced software package for designing synthetic genes[J]. Nucleic Acids Res, 2005,33(9):3011-6.
[12]Parker J M,Guo D,Hodges R S.New hydrophilicity scale derived from high-performance liquid chromatography peptide retention data: correlation of predicted surface residues with antigenicity and X-ray-derived accessible sites[J].Biochemistry,1986, 25(19):5425-32.
[13]Chilukamarri L, Hancock A L, Malik S, et al. Hypomethylation and aberrant expression of the glioma pathogenesis-related 1 gene in Wilms tumors[J].Neoplasia,2007,9(11):970-8.
[14]Li L,Abdel Fattah E,Cao G,et al.Glioma pathogenesis-related protein 1 exerts tumor suppressor activities through proapoptotic reactive oxygen species-c-Jun-NH2 kinase signaling[J]. Cancer Res, 2008, 68(2):434-43.
[15]Ren C,Li L,Goltsov A A,et al.mRTPV-1, a novel p53 target gene with proapoptotic activities[J]. Mol Cell Biol, 2002, 22(10):3345-57.
[16]Ren C,Li L,Yang G,et al.RTVp-1 a tumor suppressor inactivated by methylation in prostate cancer[J]. Cancer Res, 2004, 64(3):969-76.
Prokaryotic expression and polyclonal antibody preparation ofglipr1 gene
Sheng Xiumei1,2, Chen Long1, Wang Zhengxin2
(1DeptofBiochemistry,SchoolofMedicine,JiangsuUniversity,Zhenjiang212013;2CenterforCancerResearchandTherapeuticDevelopment,DeptofBiologicalSciences,ClarkAtlantaUniversity,Atlanta,GA30314)
ObjectiveTocloneandexpressgliomapathogenesis-relatedprotein1gene,andpreparetheanti-GLIPR1polyclonalantibody.Useanti-GLIPR1tochecktheexpressionofGLIPR1insomecancercelllines.Methods
GLIPR1;protein expression;polyclonal antibody
时间:2016-8-10 11:04:48
http://www.cnki.net/kcms/detail/34.1065.R.20160810.1104.009.html
2016-06-02接收
江苏大学高级专业人才科研启动基金(编号:11JDG063);国家博士后科学基金(编号:2015M571702)
1江苏大学医学院生化教研室,镇江 212013
2The Center for Cancer Research and Therapeutic Development, Dept of Biological Sciences, Clark Atlanta University, Atlanta, GA 30314
生秀梅,女,副教授,博士研究生;
王正新,男,教授,博士生导师,责任作者,E-mail:zwang@cau.edu
R 34;Q 78
A
1000-1492(2016)10-1436-05
10.19405/j.cnki.issn1000-1492.2016.10.009
cDNA clone plasmids(pLX304-glipr1) were used as template to amplify theglipr1(M) fragment by PCR. The fragment was cloned into the pET-15b vector and expressed inE.coliBL21-CodonPlus(DE3). The GLIPR1(M) protein was purified by Ni affinity chromatography and was used as antigen to prepare polyclonal antibody. Western blot analysis was used to check the specificity of the antibody and detect the expression of GLIPR1 in A549, PC14, LNCaP, PC3 and U87 cells.Results Expression vector pET-15b-glipr1(M) was successfully constructed, and the purified GLIPR1(M) protein was obtained, the polyclonal anti-GLIPR1 antibody was successfully prepared and could be used to check the expression of GLIPR1 in cancer cell lines. GLIPR1 was highly expressed in U87 cells.Conclusion The GLIPR1(M) protein and the polyclonal anti-GLIPR1 antibody are successfully prepared, which lays the foundation for the research of GLIPR1 function mechanism.

