植物蛋白质N-糖基化修饰研究进展*
叶 强,金晓琴,刘伟娜,韩凤琴,康 振,杨 莉
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
植物蛋白质N-糖基化修饰研究进展*
叶 强,金晓琴,刘伟娜,韩凤琴,康 振,杨 莉
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
N-糖基化与植物蛋白质正确折叠、细胞凋亡、器官发育及信号转导等生物学功能密切相关.主要对植物蛋白N-糖基化的结构、生物合成、加工修饰、相关酶生物学功能,以及糖蛋白的分离鉴定方法等进行了综述,并探讨了植物糖基化蛋白功能研究的应用前景及存在的问题.
植物蛋白质;N-糖基化修饰;糖苷合成;生物学功能
真核生物细胞内的多肽及蛋白质分子经核糖体合成后大多需翻译后修饰,如泛素化、磷酰化、糖基化等,确保蛋白质正常行使其生物学功能[1].其中,糖基化是真核生物体内常见的蛋白翻译后修饰,糖蛋白占细胞蛋白质的50%以上,参与细胞识别、分化、发育、信号转导和免疫应答等多个重要的生命过程[2-3].
蛋白质的糖基化修饰是指糖链与蛋白质上特定氨基酸残基共价结合的过程.根据连接方式,主要分为N-糖基化、O-糖基化、C-糖基化及糖基磷脂酰肌醇锚定连接4种类型[3-5].N-糖基化是指内质网(endoplasmic reticulum,ER)上糖基转移酶催化转移至新生肽Asn-X-Ser/Thr(X是除脯氨酸Pro外的任一氨基酸;Asn为天冬酰胺;Ser为丝氨酸;Thr为苏氨酸)基序的Asn残基,是蛋白质糖基化修饰的重要形式,胞外分泌蛋白、膜整合蛋白及构成内膜系统的可溶性驻留蛋白大多经N-糖基化修饰.酵母、哺乳动物和细菌中相关糖蛋白的鉴定为植物N-糖基化蛋白功能分析奠定了基础,但植物蛋白N-糖基化研究尚处于起步阶段.蛋白质的N-糖基化主要包括糖链的生物合成、糖链的转移及糖链的进一步加工.本文主要从植物蛋白的N-糖链结构、N-糖基化过程及其生物学功能等方面进行了综述.
1 植物蛋白N-糖链的基本结构
植物N-糖蛋白的糖链包含1个核心五糖,根据其结构可分为4种类型(见图1):1)寡甘露糖型:最简单的N-糖链,仅含核心五糖结构;2)高甘露糖型:具有5个及以上的甘露糖(mannose,Man)残基;3)复杂型:糖链除含3个Man核心及与Man连接的N-乙酰葡糖胺糖基(GlcNAc)外,还包含唾液酸及其衍生物;4)杂合型:具有复杂型和高甘露糖型2类糖链结构元件[6-7].
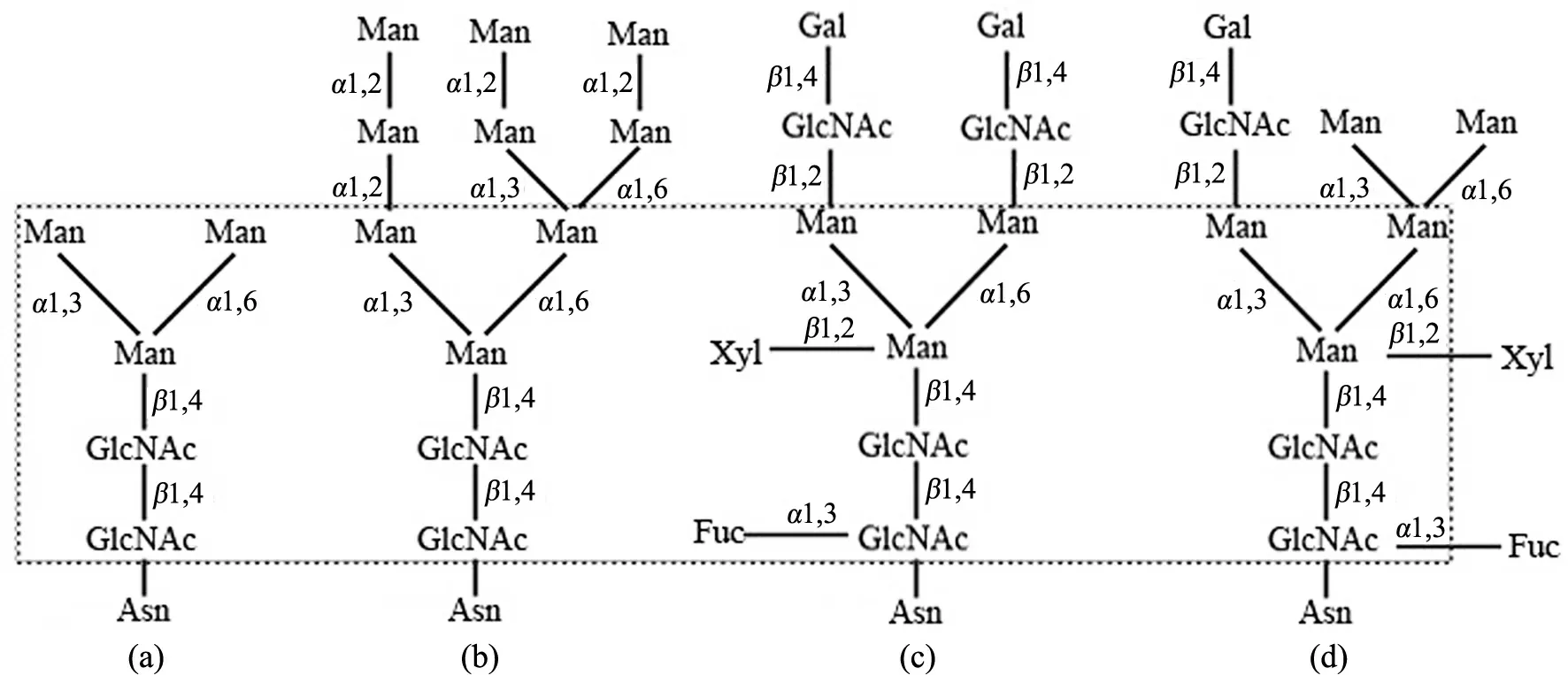
(a)寡甘露糖型;(b)高甘露糖型;(c)复杂型;(d)杂合型.虚框内为N-糖链核心结构图1 植物糖蛋白N-糖链的4种基本结构
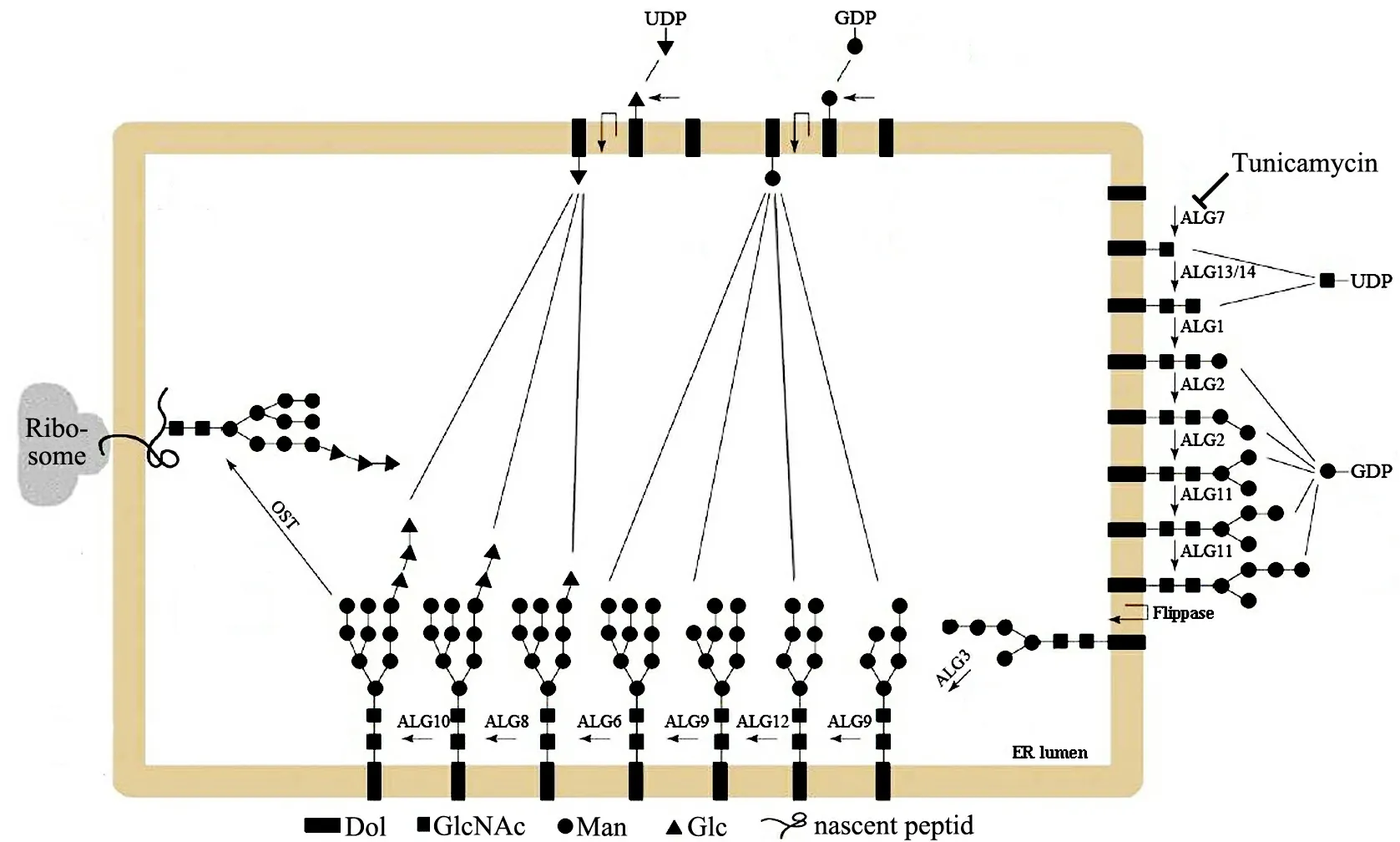
图2 脂连寡糖(LLO)的生物合成
2 植物蛋白质的N-糖基化修饰
蛋白质的N-糖基化修饰主要包括糖链的生物合成、糖链转移至新合成蛋白,以及蛋白糖链的进一步加工.
2.1N-糖链的生物合成
蛋白质的N-糖基化修饰主要发生于内质网(ER)和高尔基体(Golgi)上,糖链与肽链的生物合成同步进行,动物与植物N-糖链的生物合成基本一致[8].糖链与新生肽结合前以脂连寡糖(lipid-linked oligosaccharide,LLO)形式存在[9-10],LLO的生物合成主要包括4个步骤(见图2):1)面向胞质一侧的ER膜上,2分子GlcNAc经GlcNAc-1-磷酸转移酶(GlcNAc-1-P transferase,GPT,如ALG7与ALG13/14)催化与二磷酸-多萜醇(Dol-PP)结合生成GlcNAc2-PP-Dol;2)5分子Man在糖基转移酶(glycosyltransferase,GT,如ALG1,ALG2与ALG11)作用下依次与GlcNAc结合,生成具有2个分枝的核心五糖;3)核心五糖经翻转酶催化进入ER内腔;4)在ER内腔,核心五糖经特定GT(ALG3,ALG6,ALG8-ALG10及ALG12)催化添加4分子Man及3分子葡萄糖(glucose,Glc),生成包含14个糖基的LLO前体[3-4,11].在进入ER腔前,LLO糖链合成时糖基供体为鸟嘌呤核苷二磷酸(UDP)-甘露糖与尿嘧啶核苷二磷酸(GDP)-N-乙酰葡糖胺;LLO翻转进入ER内腔后,糖基供体则为多萜醇-葡萄糖与多萜醇-甘露糖.
2.2 蛋白质N-糖基化修饰
糖链LLO生物合成的同时,新合成的蛋白质也经易位子进入ER腔[3].LLO在寡聚糖转移酶(oligosaccharyltransferase,OST)作用下转移至新生肽Asn-X-Ser/Thr基序的Asn残基[9-10].LLO转移至新生肽后,新生肽上的LLO将继续被修饰,主要包括以下2个过程:
1)钙联蛋白-钙网蛋白(calnexin-calreticulin cycle,CNX-CRT)循环
如图3所示:转移至新合成蛋白的LLO分别经α-葡糖苷酶Ⅰ(α-glucosidase Ⅰ,GCSⅠ/GI)与α-葡糖苷酶Ⅱ(GCSⅡ/GⅡ)水解末端2个Glc残基,生成的寡糖结构Glc1Man9GlcNAc2被CNX或(和)CRT识别并结合;糖链上最后一个Glc残基经GCSⅡ水解后(结构为Man9GlcNAc2),糖蛋白脱离CNX-CRT循环,转运至Golgi进一步修饰[12-14].若蛋白质未正确折叠,糖链会经UDP-Glc:糖蛋白糖基转移酶(UDP-glucose:glycoprotein-glucosyltransferase,UGGT)再次糖基化,重新进入CNX-CRT循环,或者直接进入蛋白降解程序[15].
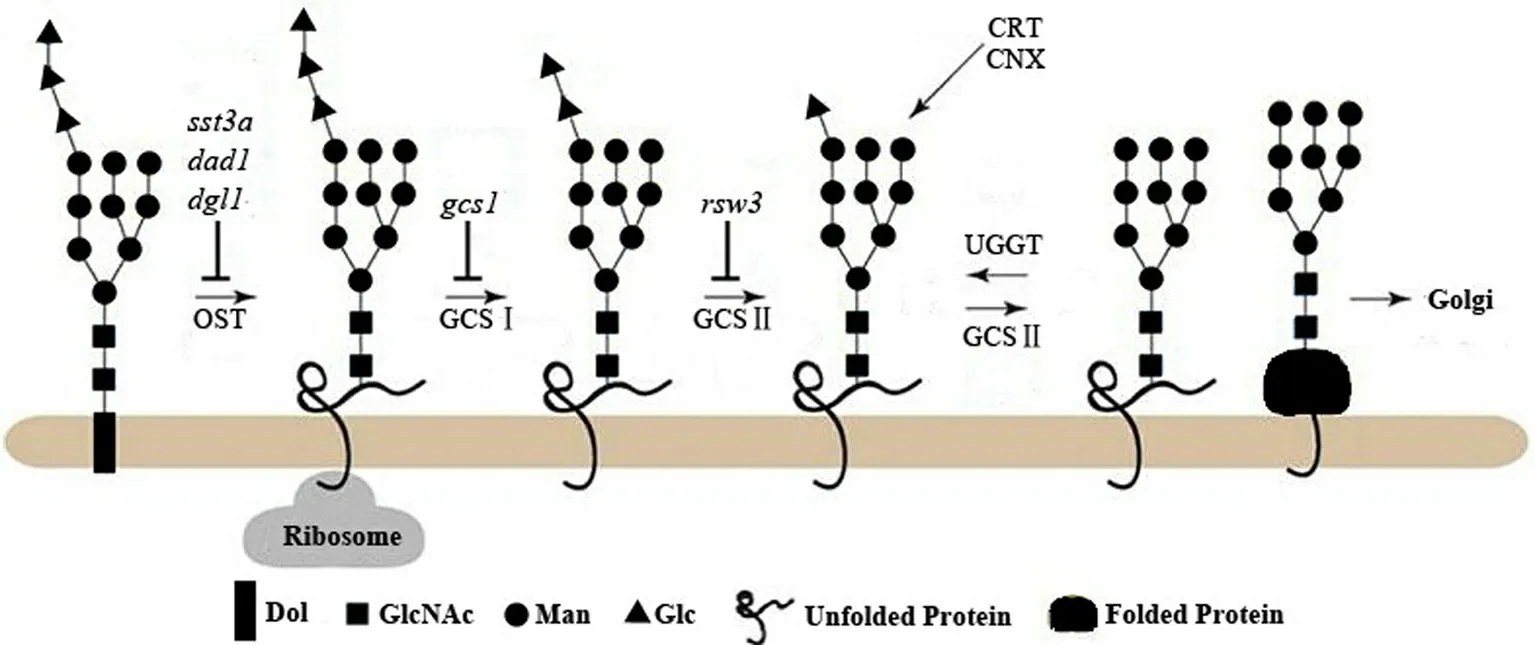
图3 钙联蛋白-钙网蛋白(CNX-CRT)循环
2)蛋白糖链在Golgi上的再加工
糖蛋白在ER完成修饰后,通过COPⅡ型膜泡运输至Golgi再加工[6,11].首先,Man9GlcNAc2或Man8GlcNAc2经α-甘露糖苷酶Ⅰ(Golgi-α-ManⅠ,MNS1/2)水解糖链上3~4分子Man残基;接着,N-乙酰氨基葡萄糖转移酶Ⅰ(glucosamine-phosphateN-acetyltransferase Ⅰ,GlcNAcT或GnTI)催化向糖链添加1分子GlcNAc残基,生成GlcNAcMan5GlcNAc2(见图4);最后,在XylT,FucT和GalT等酶的作用下加工生成复杂型或杂合型糖链[16-17].

图4 复杂型N-糖链在高尔基体上的再加工
3 蛋白质N-糖基化修饰的相关酶及其生物学功能
3.1 蛋白质N-糖基化修饰相关酶
植物中蛋白质保守的N-糖基化修饰进程主要是由糖基转移酶(glycosyltransferase,GT)、α-葡糖苷酶(α-glucosidase,GCS)及甘露糖苷酶(mannosidase,MNS)完成.
1)GT:主要负责LLO的生物合成.根据糖基供体,GT可分为Leloir与non-Leloir 2种类型.Leloir型GT以糖核苷酸GDP-Man及UDP-GlcNAc为糖基供体,LLO从胞质一侧翻转至ER内腔前所涉及的糖基转移酶多为该类型[18].non-Leloir型GT则以磷酸酯连接的糖Dol-Glc与Dol-Man为糖基供体[19].
2)GCS:在CNX-CRT循环中起重要作用的是GCSⅠ与GCSⅡ.GCSⅠ与OST复合物紧密相连,为Ⅱ型膜蛋白,水解LLO末端第一个Glc残基[15].GCSⅡ由α亚基(功能域)与β亚基(定位域)构成,在N-糖苷合成早期敲除α亚基后糖链末端多出1~2个Glc,N-糖链不能进行后续修饰[14,20].目前尚未发现能够替代GCSⅡ功能的酶.
3)MNS:由ER型(α-ManⅠ,MNS3)及Golgi型(α-ManⅠ,MNS1/2)组成,负责去除糖链上的Man残基(见图4).糖蛋白离开CNX-CRT循环后,其糖链可被MNS3水解生成Man8GlcNAc2,再进入Golgi;也可不经水解,直接进入Golgi[21-22].MNS1-3与ER执行错误折叠糖蛋白降解(endoplastic reticulum-associated degradation machinery,ERAD)途径密切相关,但具体机制尚未明确[17,23].
3.2 蛋白质N-糖基化修饰在植物中的生物学功能
真核生物蛋白质的N-糖苷具有帮助蛋白质正确折叠、辅助蛋白质功能发挥、抑制或延缓蛋白质降解等作用[7].
1)N-糖苷帮助蛋白质正确折叠.
蛋白质的N-糖基化修饰过程中,CNX-CRT能够专一识别糖蛋白上的GlcMan9GlcNAc2结构[14],与未折叠糖蛋白结合,避免折叠中间体及错误折叠蛋白从ER逃逸[22,24-25].错误折叠且无法修复的糖蛋白进入ERAD途径,由ERAD复合物运输至胞质溶胶,经糖基肽酶水解去除糖链后,蛋白进入26S蛋白酶体降解[15,26-27].
2)N-糖基化修饰蛋白与细胞凋亡密切相关.
错误折叠的糖蛋白滞留于ER,激发未折叠蛋白应答反应(unfold protein response,UPR).Iwata等[28]发现衣霉素(Tunicamycin,GT抑制剂)能够诱导烟草悬浮细胞产生UPR反应.DAD1(OST复合物亚基之一)作为抗细胞凋亡因子,缺失引起DGL1(OST复合物亚基之一)快速降解,引发细胞凋亡;超表达则保护原生质体免受紫外线引起的DNA断裂和细胞损伤[29-31].
3)N-糖基化修饰蛋白影响细胞壁的组成与含量.
植物细胞壁主要由纤维素、半纤维素、果胶质等多糖组成.N-糖基化受阻时,植物细胞壁成分与含量将发生改变.例如:DGL1能够影响细胞壁多糖的形成[32-34];突变体gcs1与rsw3的细胞壁纤维素含量显著降低[35];Mns1-3也观察到细胞壁不均匀等现象[36].
4)N-糖基化修饰蛋白对根发育的影响.
VTC1编码GDP-Man焦磷酸化酶,合成GDP-Man,VTC1缺失会引起根生长的不可逆抑制[37].文献[38]发现拟南芥突变体cgl1对盐胁迫敏感,根生长受抑制,根尖形态发生异常.此外,SWP1(OST复合物亚基之一)突变体将抑制侧根发生与伸长[39];Osdgl1的根细胞体积变小,部分根细胞死亡[40];AtMns1-3也观察到根变短的现象[21,36].
5)N-糖苷对果实发育的影响.
在果实的成熟过程中,N-聚糖大量积累,因此,N-糖基化也能够影响植物果实的发育.大量的实验证明,N-聚糖的增加能够促进果实转色并引起乙烯含量的增加,而对N-糖基化修饰过程进行抑制后果实延迟成熟.例如,对β-D-乙酰氨基己糖苷酶的酶活进行抑制能够延长果实的货架期[41-43].
此外,蛋白质的N-糖基化修饰在细胞分化、免疫、信号转导及激素调控等多个重要的生命进程都起到十分重要的作用[44-45].
4 N-糖蛋白的富集分离和鉴定方法
目前,有关植物蛋白的N-糖基化修饰研究较少,对于植物特定发育时期哪些糖蛋白发生N-糖基化修饰及N-糖基化位点等仍然知之甚少.植物体内糖蛋白上糖链的合成与修饰十分复杂,无固定模板与结构,且N-糖基化修饰的蛋白丰度远远低于未经N-糖基化修饰的蛋白.因此,富集分离N-糖苷、N-糖肽与N-糖蛋白十分困难[46-47].
近年来,随着蛋白质组学的飞速发展,应用蛋白质组学全面分析植物N-糖蛋白质,大大加快了糖蛋白质组的研究.目前最常用的N-糖蛋白组研究主要包括富集分离、酶解消化和鉴定3个步骤:首先应用刀豆蛋白A凝集素[47]、麦胚凝集素[48]及小扁豆凝集素[49]等凝集素与N-糖链特有的结构共价结合,将N-糖蛋白从众多蛋白中分离出来;分离出的糖蛋白再经PNGase F等糖苷酶处理,N-糖肽与N-糖链相连处由天冬酰胺转化为天冬氨酸,N-糖肽分子量发生改变,再采用质谱技术分析N-糖肽序列及N-糖蛋白的糖基化位点.文献[50]采用刀豆蛋白A凝集素层析结合二维液相色谱富集分离糖蛋白,经胰蛋白酶消化后进行液相色谱串联基质辅助激光解吸附质谱技术(LC-MALDI-MS/MS)分析,共鉴定出133个糖蛋白,并预测了其中大部分糖蛋白的糖基化位点.文献[51]采用类似方法,从二穗短柄草中鉴定出46个N-糖蛋白,以及47个糖基化位点.此外,Silva-Sanchez等[52]应用糖蛋白特异荧光染料 ProQ 染色2D蛋白胶,从玉米胚乳己糖缺失突变体mn1及野生型中分离出45个差异糖蛋白.
5 展 望
随着糖生物学研究的迅速发展,糖蛋白已成为生物化学研究的热点和前沿,在糖蛋白的结构、生物合成、代谢及其生理作用等方面已取得了不少的成果,但仍有很多糖蛋白的结构和功能未知.由于糖的合成无固定模板和糖结构与功能的不对应性,糖蛋白的鉴定、功能与开发利用研究相对困难,尤其是植物糖蛋白的研究落后于动物、酵母等的相关研究[25,45].
随着多种植物基因组测序的完成,以及大量新技术、新方法及新软件的开发利用,加速了植物中糖蛋白的分离及结构与生物学功能的鉴定.但是,一个蛋白质可能有几十种甚至上百种不同的多聚糖修饰基团,而且蛋白糖基化修饰在细胞中丰度也较低,如何明确这些糖蛋白的生物学功能仍面临巨大的挑战.此外,糖蛋白药物对人类健康的重要性已开始受到重视,已上市的医药蛋白中70%以上为糖蛋白[53-54].应用植物作为生物反应器大量生产药用糖蛋白,将是今后的研究方向之一.为确保糖蛋白药物的安全性、均一性和药效,研究植物糖蛋白的糖基化结构与生物活性,优化蛋白糖基化修饰的方法与条件,对于开发利用植物生产药用重组糖蛋白也是必不可少的.
[1]Eisenhaber B,Eisenhaber F.Prediction of posttranslational modification of proteins from their amino acid sequence[J].Method Mol Biol,2010,609:365-384.
[2]Apweiler R,Hermjakob H,Sharon N.On the frequency of protein glycosylation,as deduced from analysis of the SWISS-PROT database[J].Biochim Biophys Acta,1999,1473(1):4-8.
[3]Wiederschain G Y.Glycobiology:Progress,problems,and perspectives[J].Biochemistry (Moscow),2013,78(7):679-696.
[4]Maeda Y,Kinoshita T.Dolichol-phosphate mannose synthase:Structure,function and regulation[J].Biochim Biophys Acta,2008,1780(6):861-868.
[5]阮班军,代鹏,王伟,等.蛋白质翻译后修饰研究进展[J].中国细胞生物学报,2014,36(7):1027- 1037.
[6]Kornfeld R,Kornfeld S.Assembly of asparagine-linked oligosaccharides[J].Annu Rev Biochem,1985,54(1):631-664.
[7]Lerouge P,Cabanes-Macheteau M,Rayon C,et al.N-glycoprotein biosynthesis in plants:Recent developments and future trends[J].Plant Mol Biol,1998,38(1/2):31-48.
[8]Faye L,Boulaflous A,Benchabane M,et al.Protein modifications in the plant secretory pathway:Current status and practical implications in molecular pharming[J].Vaccine,2005,23(15):1770-1778.
[9]Aebi M,Bernasconi R,Clerc S,et al.N-glycan structures:Recognition and processing in the ER[J].Trends Biochem Sci,2010,35(2):74-82.
[10]Pattison R J,Amtmann A.N-glycan production in the endoplasmic reticulum of plants[J].Trends Plant Sci,2009,14(2):92-99.
[11]Ruiz-May E,Kim S J,Brandizzi F,et al.The secreted plantN-glycoproteome and associated secretory pathways[J].Front Plant Sci,2012,3:117.
[12]Gomord V,Fitchette A C,Menu-Bouaouiche L,et al.Plant-specific glycosylation patterns in the context of therapeutic protein production[J].Plant Biotechnol J,2010,8(5):564-587.
[13]Lederkremer G Z.Glycoprotein folding,quality control and ER-associated degradation[J].Curr Opin Struc Bio,2009,19(5):515-523.
[14]Soussillane P,D′Alessio C,Paccalet T,et al.N-glycan trimming by glucosidase Ⅱ is essential forArabidopsisdevelopment[J].Glycoconj J,2009,26(5):597-607.
[15]Liu Jianxiang,Howell S H.Endoplasmic reticulum protein quality control and its relationship to environmental stress responses in plants[J].Plant Cell,2010,22(9):2930-2942.
[16]Baiet B,Burel C,Saint-Jean B,et al.N-glycans of phaeodactylum tricornutum diatom and functional characterization of itsN-acetylglucosaminyltransferase Ⅰ enzyme[J].J Biol Chem,2011,286(8):6152-6164.
[17]Kajiura H,Koiwa H,Nakazawa Y,et al.TwoArabidopsisthalianaGolgi alpha-mannosidase Ⅰ enzymes are responsible for plantN-glycan maturation[J].Glycobiology,2010,20(2):235-247.
[18]Chang A,Singh S,Phillips G N,et al.Glycosyltransferase structural biology and its role in the design of catalysts for glycosylation[J].Curr Opin Biotechnol,2011,22(6):800-808.
[19]Lairson L L,Henrissat B,Davies G J,et al.Glycosyltransferases:structures,functions,and mechanisms[J].Annu Rev Biochem,2008,77:521-555.
[20]Lucocq J M,Brada D,Roth J.Immunolocalization of the oligosaccharide trimming enzyme glucosidase Ⅱ[J].J Cell Biol,1986,102(6):2137-2146.
[21]Liebminger E,Hüttner S,Vavra U,et al.Class Ⅰα-mannosidases are required forN-glycan processing and root development inArabidopsisthaliana[J].Plant Cell,2009,21(12):3850-3867.
[22]Banerjee S,Vishwanath P,Cui J,et al.The evolution ofN-glycan-dependent endoplasmic reticulum quality control factors for glycoprotein folding and degradation[J].Proc Natl Acad Sci USA,2007,104(28):11676-11681.
[23]Liebminger E,Veit C,Mach L,et al.Mannose trimming reactions in the early stages of theN-glycan processing pathway[J].Plant Signal Behav,2010,5(4):476-478.
[24]Maattanen P,Gehring K,Bergeron J J,et al.Protein quality control in the ER:the recognition of misfolded proteins[J].Semin Cell Dev Biol,2010,21(5):500-511.
[25]尹恒,王文霞,赵小明,等.植物糖生物学研究进展[J].植物学报,2010,45(5):521-529.
[26]Ahner A,Brodsky J L.Checkpoints in ER-associated degradation:excuse me,which way to the proteasome?[J].Trends Cell Biol,2004,14(9):474-478.
[27]Masahara-Negishi Y,Hosomi A,Mea M D,et al.A plant peptide:N-glycanase orthologue facilitates glycoprotein ER-associated degradation in yeast[J].Biochimica Et Biophysica Acta,2012,1820(10):1457-1462.
[28]Iwata Y,Koizumi N.Unfolded protein response followed by induction of cell death in cultured tobacco cells treated with tunicamycin[J].Planta,2005,220(5):804-807.
[29]Sanjay A,Fu Jie,Kreibich G.DAD1 is required for the function and the structural integrity of the oligosaccharyltransferase complex[J].J Biol Chem,1998,273(40):26094-26099.
[30]Silberstein S,Collins P G,Kelleher D J,et al.The essentialOST2 gene encodes the 16-kD subunit of the yeast oligosaccharyltransferase,a highly conserved protein expressed in diverse eukaryotic organisms[J].J Cell Biol,1995,131(2):371-383.
[31]潘永娟,金晓琴,刘伟娜,等.抗细胞凋亡蛋白DAD研究进展[J].浙江师范大学学报:自然科学报,2014,37(2):212-218.
[32]Boisson M,Gomord V,Audran C,et al.Arabidopsisglucosidase Ⅰ mutants reveal a critical role ofN-glycan trimming in seed development[J].EMBO J,2001,20(5):1010-1019.
[33]Gillmor C S,Poindexter P,Lorieau J,et al.Alpha-glucosidase Ⅰ is required for cellulose biosynthesis and morphogenesis inArabidopsis[J].J Cell Biol,2002,156(6):1003-1013.
[34]Lerouxel O,Mouille G,Andeme-Onzighi C,et al.Mutants in DEFECTIVE GLYCOSYLATION,anArabidopsishomolog of an oligosaccharyltransferase complex subunit,show protein underglycosylation and defects in cell differentiation and growth[J].Plant J,2005,42(4):455-468.
[35]Zhang Min,Henquet M,Chen Zhizhong,et al.LEW3,encoding a putative alpha-1,2-mannosyltransferase (ALG11) inN-linked glycoprotein,plays vital roles in cell-wall biosynthesis and the abiotic stress response inArabidopsisthaliana[J].Plant J,2009,60(6):983-999.
[36]Wei Song,Henquet M G L,Mentink R A,et al.N-glycoproteomics in plants:perspectives and challenges[J].J Proteomics,2011,74(8):1463-1474.
[37]Barth C,Gouzd Z A,Steele H P,et al.A mutation in GDP-mannose pyrophosphorylase causes conditional hypersensitivity to ammonium,resulting inArabidopsisroot growth inhibition,altered ammonium metabolism,and hormone homeostasis[J].J Exp Bot,2010,61(2):379-394.
[38]Kang J S,Frank J,Kang C H,et al.Salt tolerance ofArabidopsisthalianarequires maturation ofN-glycosylated proteins in the Golgi apparatus[J].Proc Natl Acad Sci USA,2008,105(15):5933-5938.
[39]Singh S,Singh A,Roy S,et al.SWP1 negatively regulates lateral root initiation and elongation inArabidopsis[J].Plant Signal Behav,2012,7(12):1522-1525.
[40]Qin Cheng,Li Yuanya,Gan Jian,et al.OsDGL1,a homolog of an oligosaccharyltransferase complex subunit,is involved inN-glycosylation and root development in rice[J].Plant Cell Physiol,2013,54(1):129-137.
[41]Meli V S,Ghosh S,Prabha T N,et al.Enhancement of fruit shelf life by suppressingN-glycan processing enzymes[J].Proc Natl Acad Sci USA,2010,107(6):2413-2418.
[42]Priem B,Gitti R,Bush C A,et al.Structure of ten freeN-glycans in ripening tomato fruit.Arabinose is a constituent of a plantN-glycan[J].Plant Physiol,1993,102(2):445-458.
[43]Irfan M,Ghosh S,Kumar V,et al.Insights into transcriptional regulation of beta-D-N-acetylhexosaminidase,anN-glycan-processing enzyme involved in ripening-associated fruit softening[J].J Exp Bot,2014,65(20):5835-5848.
[44]Isaji T,Kariya Y,Xu Qingsong,et al.Functional roles of the bisecting GlcNAc in integrin-mediated cell adhesion[J].Methods in Enzymol,2010,480:445-459.
[45]Woodward A W,Bartel B.Auxin:regulation,action,and interaction[J].Ann Bot,2005,95(5):707-735.
[46]Ruiz-May E,Thannhauser T W,Zhang Sheng,et al.Analytical technologies for identification and characterization of the plantN-glycoproteome[J].Front Plant Sci,2012,3:1-8.
[47]周蕾,顾建新.N-糖基化位点鉴定方法和非经典N-糖基化序列[J].生命科学,2011,23(6):605-611.
[48]Zhang Yu,Giboulot A,Zivy M,et al.Combining various strategies to increase the coverage of the plant cell wall glycoproteome[J].Phytochemistry,2011,72(10):1109-1123.
[49]Leonard R,Strasser R,Altmann F.Plant glycosidases acting on protein-linked oligosaccharides[J].Phytochemistry,2009,70(3):318-324.
[50]Catalá C,Howe K J,Hucko S,et al.Towards characterization of the glycoproteome of tomato (Solanumlycopersicum) fruit using Concanavalin A lectin affinity chromatography and LC-MALDI-MS/MS analysis[J].Proteomics,2011,11(8):1530-1544.
[51]Zhang M,Chen G X,Lü D W,et al.N-linked glycoproteome profiling of seedling leaf inBrachypodiumdistachyonL.[J].Journal of Proteome Research,2015,14(4):1727-1738.
[52]Silva-Sanchez C,Chen Sixue,Li Jinxi,et al.A comparative glycoproteome study of developing endosperm in the hexose-deficientminiature1 (mn1) seed mutant and its wild typeMn1 in maize[J].Front Plant Sci,2014,5(1):217-226.
[53]Sethuraman N,Stadheim T A.Challenges in therapeutic glycoprotein production[J].Curr Opin Biotechnol,2006,17(4):341-346.
[54]徐沙,中西秀树,高晓冬.糖蛋白药物表达系统糖基化研究进展[J].微生物学报,2013,53(3):221-229.
(责任编辑 薛 荣)
Research progress onN-glycosylation proteins in plants
YE Qiang,JIN Xiaoqin,LIU Weina,HAN Fengqin,KANG Zhen,YANG Li
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
N-glycosylation was closely related to correctly folded proteins,apoptosis,organ developments and signal transductions.It was reviewed the structures,biosynthesis,modifications and functions ofN-glycosylation,methods for isolation and identification of glycoprotein in plants.The application perspectives and potential problems were also discussed.
plant proteins; glycosylation;N-glycan synthesis; biological functions
10.16218/j.issn.1001-5051.2016.01.015
��2015-04-20;
2015-05-18
浙江省自然科学基金资助项目(LY14C150001);浙江省大学生新苗人才计划项目(2104R404024)
叶 强(1992-),男,浙江金华人,硕士研究生.研究方向:生物化学与分子生物学.通信作者:杨 莉.E-mail:yangli@zjnu.cn
Q51
A
1001-5051(2016)01-080-07

