PKCβ/p66Shc介导高尿素引起的人脐静脉内皮细胞 ROS的产生
何菲,樊春华,郭珮,王弘凯,周宏宇,陈益,李晋芳,冉建华*
(重庆医科大学1基础医学院解剖学教研室,2神经科学研究中心,3附属第二医院神经内科,重庆 400016)
论 著
PKCβ/p66Shc介导高尿素引起的人脐静脉内皮细胞ROS的产生
何菲1,2,樊春华1,2,郭珮1,2,王弘凯1,2,周宏宇1,2,陈益1,2,李晋芳3,冉建华1,2*
(重庆医科大学1基础医学院解剖学教研室,2神经科学研究中心,3附属第二医院神经内科,重庆 400016)
目的 探讨PKCβ/p66Shc通路在高浓度尿素引起的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)活性氧簇(reactive oxygen species,ROS)产生中的作用。方法 体外培养HUVECs,分为正常对照组、甘露醇组、尿素组和尿素+LY333531(PKCβ抑制剂)组。采用CCK8法检测高浓度尿素对细胞活性的影响,倒置显微镜观察细胞形态改变;DCFH-DA法检测细胞内ROS含量;Western blot检测细胞中p66Shc、p-p66Shc、PKCβ和p-PKCβ水平;免疫荧光技术观察细胞内p-p66Shc水平。结果 25mmol/L尿素明显抑制HUVECs活力,并引起细胞排列紊乱、细胞间隙增大、铺路石样排列结构受到破坏等形态学改变。与对照组相比,25mmol/L尿素引起细胞内ROS水平明显升高,在6h达到峰值;加入PKCβ抑制剂LY333531后ROS水平明显降低。Western blot结果显示,25mmol/L尿素诱导p66Shc、p-p66Shc、PKCβ和p-PKCβ水平随作用时间的延长而逐渐增加。25mmol/L尿素负荷6h后可见细胞胞质内p-p66Shc免疫反应性明显增强,LY333531可阻断该作用;Western blot检测也显示LY333531可显著抑制高浓度尿素对p-p66Shc水平的上调。结论 PKCβ/p66Shc信号通路是高浓度尿素诱导HUVECs内ROS产生的重要途径。
尿素;人脐静脉内皮细胞;PKCβ/p66Shc;活性氧簇
心血管疾病(cardiovascular disease,CVD)是终末期肾病(end stage renal disease,ESRD)患者最常见的并发症和最主要的死亡原因,其致死率比其他并发症高10~20倍[1];而ESRD并发CVD中以动脉粥样硬化(atherosclerosis,AS)多见。与普通人群不同,ESRD患者并发AS具有发病率高、发病年龄早、病变累及广等特点,并以氧化应激和炎症反应为主要病理改变,但目前的病理机制尚不清楚。近年来的研究证实,高浓度尿素可诱导多种细胞中活性氧簇(reactive oxygen species,ROS)的大量产生,造成蛋白质氧化、脂质过氧化及DNA损伤,是导致慢性肾衰竭氧化应激(oxidative stress)、胰岛素抵抗等多种病理改变的重要致病因素[2,3]。我们前期研究也证实了高浓度尿素诱导人脑内皮细胞炎症反应的产生[4]。众所周知,氧化应激可促进炎症反应的发生,而ROS产生过多是导致氧化应激发生的主要因素。那么,ESRD患者体内的高尿素水平是否通过 ROS大量产生介导血管内皮氧化应激及后续炎症反应的发生,其具体机制如何都不清楚。p66Shc是调控细胞氧化应激的关键蛋白,磷酸化的p66Shc通过转位进入线粒体介导产生的ROS在诱导细胞氧化损伤中发挥重要作用[5-8]。研究报道,高血糖、高血脂、高浓度酒精等可通过激活PKCβ,进而导致p66Shc蛋白磷酸化及其线粒体转位,引起ROS过量产生和氧化应激的发生[9-11]。目前PKCβ/p66Shc通路在高浓度尿素诱导内皮细胞氧化应激中的作用尚未见报道。因此,本研究采用高浓度尿素负荷HUVECs细胞,观察细胞活性、形态的改变以及ROS的产生,检测PKCβ/p66Shc通路在ROS产生过程中的改变,为阐明ESRD患者并发AS的病理机制提供实验基础。
材料和方法
1 主要试剂
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)由重庆医科大学神经科学研究中心实验室提供。胎牛血清(fetal bovine serum,FBS)(Excell公司);1640培养基(Gbico公司);胰酶细胞消化液(碧云天生物技术有限公司);青-链霉素溶液(100 X)(碧云天公司);DMSO、甘露醇(Sigma公司);尿素(Solaibao生物技术公司);活性氧测定试剂盒(贝博生物有限公司);RIPA裂解液(碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(碧云天公司);ECL化学发光试剂盒(Milipore公司);PVDF膜(Milipore公司);β-actin抗体(博士德公司);p66Shc和p-p66Shc抗体(Santa公司);PKCβ和 p-PKCβ抗体(abcam公司);PKCβ抑制剂LY333531(Santa公司);Alexa Fluor 488标记的羊抗兔IgG(H+L)(碧云天公司);辣根过氧化物酶二抗(Santa公司)。
2 人脐静脉内皮细胞株培养
HUVECs复苏后,加入含10%FBS和1%青-链霉素的RPMI-1640培养液,在孵育箱中以37℃、5% CO2的饱和湿度进行培养。每两天换液一次,待其达对数生长期时,以胰蛋白酶消化细胞并传代培养或进行相应的实验分组。
3 尿素对细胞活性影响的CCK8检测
取对数期的HUVECs经胰酶消化后,细胞计数后制成细胞悬液(约1×105个/ml),种于96孔板中,每孔加入含10%FBS的培养液0.1ml,放入37℃、5%CO2环境中培养24h后,加入不同浓度(0、3.125、6.25、12.5、25、100、200mmol/L)的尿素,每种浓度设3个复孔,置于培养箱中孵育24h。然后向每个孔中加入10μl CCK-8溶液,在37℃、5%CO2培养箱中继续孵育2h后,用酶标仪测定其在450nm(A450值)的吸光度值。用下列公式计算 HUVECs细胞活力抑制率(IR)∶IR(%)=[(对照组A值实验组A值)/(对照组A值-空白组A值)]×100%。
4 活性氧测定
以25mmol/L尿素在不同时间点干预HUVECs后,按照ROS检测试剂盒说明书进行操作,用DCFH-DA探针孵育30min后用0.01mol/L的PBS洗3次,再置于荧光显微镜下观察并拍照。镜下的荧光强度越高代表ROS的产生越多,反之则越少。
5 免疫荧光技术检测p-p66Shc的表达
HUVEC细胞培养后,待细胞增殖至70%~80%后,用胰蛋白酶消化并制成细胞悬液,然后接种于12孔板的盖玻片上,培养24h后进行分组。进行相应的干预后用0.01mol/L的PBS洗3次,每次5min,4%多聚甲醛37℃固定30min,然后用0.01mol/L的PBS洗3次,每次5min;加入0.2%Triton X-100室温孵育15min,PBS洗涤后,加入含10%的马血清于37℃封闭30min。然后加入一抗(阴性对照以PBS代替一抗),4℃过夜。第2天用PBS洗3次,每次10min,然后避光滴加荧光二抗(1∶200)于37℃孵育1h。DAPI染核5min后PBS洗3次,每次10min,用防猝灭封片剂封片,倒置荧光显微镜下观察并采集图片。
6 Western blot检测细胞内p66Shc、p-p66Shc、PKCβ和p-PKCβ水平
培养的HUVEC按实验要求干预后收集细胞。加细胞裂解液冰上裂解30min,4℃低温离心机、12000r/min离心20min后,上清即为细胞总蛋白,用BCA法检测蛋白浓度。以10%聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,电泳结束后将蛋白电转至PVDF膜,于37℃用5%BSA封闭2h,加入一抗(均为1∶1000),4℃孵育过夜。次日TBST洗膜3次,每次15min,再加入辣根过氧化物酶标记的山羊抗兔或抗鼠抗体 IgG(1∶10000)37℃杂交1h,TBST洗膜3次,每次20min;ECL显色液显色,Image Lab Tool机器曝光。Image Lab Tool分析软件对目的条带进行灰度值分析,实验重复3次。
7 统计学分析
采用SPSS 20.0软件系统处理实验数据。计量资料以均数±标准差(±s)表示,两样本均数的比较采用独立样本t检验,以P<0.05为差异有显著性。
结 果
1 高浓度尿素抑制HUVECs活力
为了明确尿素对细胞活力的影响,应用CCK-8法检测不同浓度尿素负荷24h后细胞抑制率。结果显示,细胞的抑制率随尿素浓度的升高呈逐渐上升的趋势,25mmol/L及更高浓度的尿素对细胞的活性有明显的抑制作用(图1)。
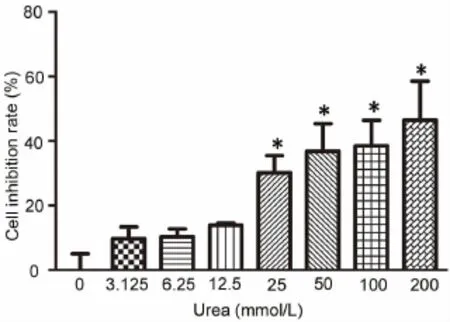
图1 不同浓度的尿素负荷对 HUVECs活力的影响;*,与0mmol/L组相比,0.01<P<0.05(n=3)Fig.1 Effects of different concentrations of urea on HUVECs viability;*,0.01<P<0.05,compared with the 0 mmol/L group(n=3)
2 高浓度尿素负荷对HUVECs形态的影响
为了明确25mmol/L尿素是否引起HUVECs形态的变化,用倒置显微镜观察25mmol/L负荷 24h对HUVECs形态的影响。结果显示,未负荷尿素的HUVECs为短梭形或小三角形,单层贴壁生长,呈铺路石样镶嵌排列(图2A)。以25mmol/L尿素负荷24h后,细胞间隙明显增大,细胞体积变小,排列较为紊乱,典型的铺路石样镶嵌排列方式消失(图2B)。
3 高浓度尿素诱导HUVECs中ROS的产生
为了明确25mmol/L尿素负荷 HUVECs后可通过产生ROS来引起细胞损伤,用荧光倒置显微镜观察25mmol/L尿素负荷HUVECs 0h、1h、3h和12h后ROS产生情况。以甘露醇组(25mmol/L)作为渗透压对照,以排除渗透压对ROS产生的影响。结果显示,12h内甘露醇组中均未见绿色荧光表达,排除了渗透压的改变会引起ROS的产生;尿素负荷HUVECs细胞1h后,细胞内荧光强度明显增加,并随时间延长而增高,在6h荧光强度达到峰值(图3)。
4 PKCβ抑制剂减少高浓度尿素诱导的HUVECs中ROS的产生
为了验证HUVECs中PKCβ是否参与尿素诱导的ROS的产生,应用PKCβ抑制剂LY333531(10μmol/L)预培养HUVECs 2h后,再负荷尿素6h,用DCFH-DA方法检测细胞内ROS的改变。荧光倒置显微镜可见,与对照组相比,负荷尿素的细胞内绿色荧光强度较未负荷尿素的对照细胞明显增强,而用LY333531预孵育再负荷尿素的细胞,其绿色荧光强度明显低于单纯尿素负荷细胞,但仍高于未负荷尿素的对照细胞(图4)。
5 高浓度尿素激活PKCβ/p66Shc信号通路
为了证明高浓度尿素是否激活PKCβ/p66Shc信号通路,应用Western blot检测了25mmol/L尿素负荷HUVECs、0h、3h、6h、12h、24h后 PKCβ、p-PKCβ、p66Shc和p-p66Shc水平的变化。结果显示,随着尿素负荷HUVECs的时间延长,p66Shc、pp66Shc、PKCβ和p-PKCβ水平均呈逐渐上升趋势(图5),提示高浓度尿素可激活PKCβ/p66Shc信号通路。
6 LY333531抑制高浓度尿素对HUVECs中pp66Shc水平的上调
为了进一步明确PKCβ是否为p66Shc的上游信号分子,用免疫荧光染色和Western blot检测了LY333531是否阻断25mmol/L尿素负荷上调HUVECs内p-p66Shc的作用。免疫荧光检测显示,HUVECs负荷25mmol/L尿素6h后,p-p66Shc免疫反应性(绿色荧光强度)明显增强,即p66Shc磷酸化水平明显升高(图6A);而用LY333531预孵育后的HUVECs内p-p66Shc免疫反应性在负荷尿素后不再明显增强(图6A)。Western blot检测显示,加入LY333531预孵育的HUVECs内p-p66Shc水平明显低于未用LY333531预孵育的HUVECs(图6B)。由此表明,PKCβ抑制剂可显著抑制高浓度尿素诱导的HUVECs中p66Shc蛋白的磷酸化水平上调,提示PKCβ是P66shc的上游信号分子。
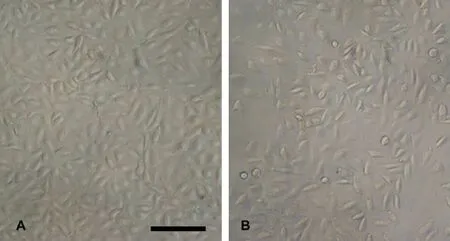
图2 尿素负荷前后人脐静脉内皮细胞的形态。A,正常的人脐静脉内皮细胞;B,尿素负荷24h后的人脐静脉内皮细胞;比例尺,100μmFig.2 Morphology of HUVECs before and after urea loading.A,normal HUVECs;B,HUVECs after 24h urea loading;scale bar,100 μm
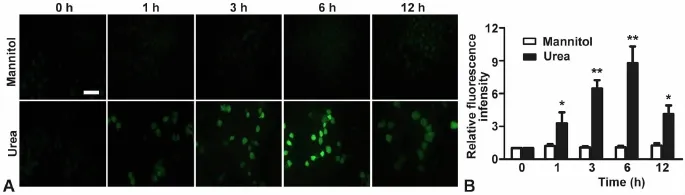
图3 高浓度尿素诱导HUVECs ROS的产生。A,尿素和甘露醇负荷HUVECs后ROS产生的变化;比例尺,100μm;B,相对荧光强度统计学分析;与0h组相比:*,0.01<P<0.05;**,P<0.01;n=3Fig.3 ROS produced in HUVECs induced by high concentration urea.A,change of ROS production in HUVECs after urea treatment and mannitol treatment.Scale bar,100 μm;B,statistical analysis of the relative fluorescence intensity;compared with the 0h group;*,0.01<P<0.05;**,P<0.01;n=3
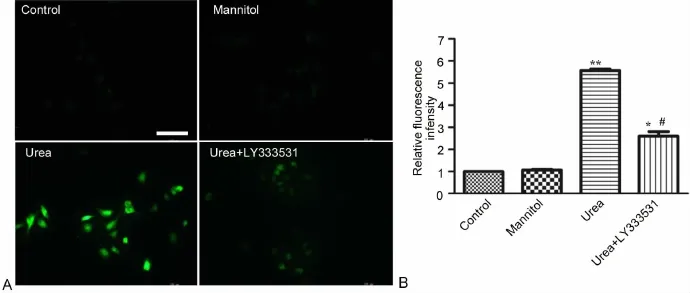
图4 PKCβ抑制剂对尿素诱导HUVECs ROS产生的影响。A,DCFH-DA法检测HUVECs中ROS;比例尺,100μm;B,DCFH-DA法检测HUVECs中ROS的统计学分析;与对照组相比:*,0.01<P<0.05;**,P<0.01;#,与尿素组比较,0.01<P<0.05;n=3Fig.4 Effect of PKCβ inhibitor on ROS production induced by urea in HUVECs.A,DCFH-DA detection of ROS production in HUVECs,scale bar,100 μm;B,statistical analysis of ROS production detected by DCFH-DA in HUVECs;compared with the control group:*,0.01<P<0.05;**,P<0.01;#,compared with the urea group,0.01<P<0.05;n=3
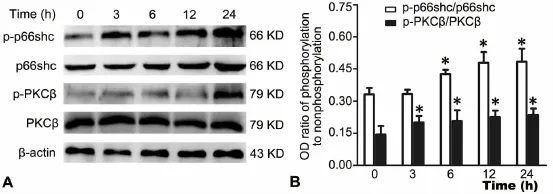
图5 高浓度尿素对 HUVECs中p66Shc、p-p66Shc、PKCβ和p-PKCβ水平的影响。A,p66Shc、p-p66Shc、PKCβ和p-PKCβ的Western blot检测;B,p66Shc/p-p66Shc和PKCβ/p-PKCβ Western blot检测的统计学分析,与0h组相比:*,0.01<P<0.05;n=3Fig.5 Effect of high concentration urea on the levels of p66Shc,p-p66Shc,PKCβ and p-PKCβ in HUVECs.A,Western blot detection of p66Shc,pp66Shc,PKC and p-PKC;B,statistical analysis of p66Shc/p-p66Shc;C,statistical analysis of PKCβ/p-PKCβ;*,0.01<P<0.05,compared with the 0h group;n=3
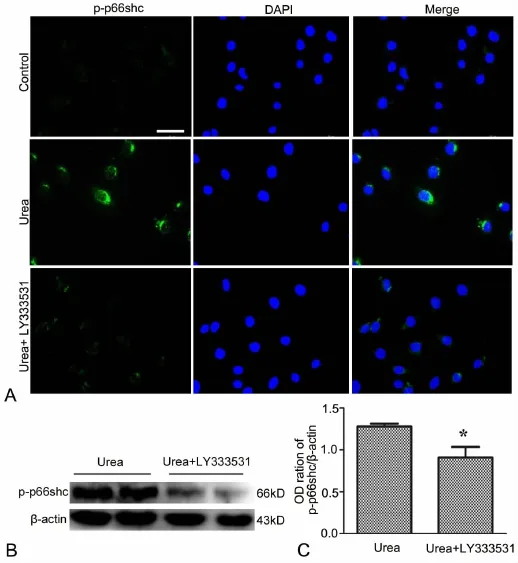
图6 PKCβ抑制剂对高浓尿素上调HUVECs中p-p66Shc水平作用的影响;A,HUVECs中p-p66Shc水平的免疫荧光检测;比例尺,50 μm;B,HUVECs中p-p66Shc水平的 Western blot检测;*,与尿素组相比:0.01<P<0.05;n=3Fig.6 Effect of PKCβ inhibitor on urea-induced up-regulation of p-p66Shc level in HUVECs.A,immunofluorescent detection of the level of p-p66Shc in HUVECs;scale bar,50 μm;B,Western blot detection of the level of p-p66Shc in HUVECs;*,0.01<P<0.05,compared with the urea group;n=3
讨 论
尿素是体内氮质潴留的主要形式。尽管尿素本身相对无毒,但目前的研究发现,高浓度的尿素可引发ROS大量产生,通过氧化应激导致肾髓质细胞损伤、胰岛素抵抗等多种病理改变的发生[12]。正常人体内尿素水平约为 5mmol/L,而ESRD患者血浆尿素水平可升至80mmol/l;心血管系统作为尿素运输的主要途径,高浓度的尿素可能直接作用于血管内皮,引起细胞损伤而触发动脉粥样硬化的发生发展。本实验通过细胞活性检测发现,25mmol/L尿素能明显的抑制HUVECs活力,并可引起细胞数量减少,出现细胞间隙增大、排列紊乱等形态学改变,证实了高浓度尿素却可引起血管内皮细胞的损伤。
活性氧是指含有氧分子的自由基,包括超氧阴离子、过氧化氢、羟自由基、烷氧基和O2衍生的原子种类。生理条件下的活性氧作为重要的信号分子参与了体内多种生理活动的调控;而异常堆积的ROS可能会导致脂质过氧化和DNA的损伤,引起细胞或组织的损伤[13]。本研究中,对照组和25mmol/L甘露醇组未见ROS产生,采用甘露醇组作对照排除了渗透压改变引起ROS产生的可能;25mmol/L尿素引起HUVECs细胞内ROS水平随时间延长明显升高,6 h达到峰值,但12 h仍高于对照组,这可能与后期线粒体内抗氧化系统的激活有关,与临床报道ESRD患者体内ROS水平的结果相符[14]。因此,高浓度尿素诱导ROS产生的机制是值得探讨的问题。
线粒体是ROS产生的主要场所。在高血糖、肿瘤等不同病理因素刺激下,p66Shc(衔接蛋白SHC的一个亚型)在ROS产生过程中具有关键作用,其通过S36位点的磷酸化引起蛋白由胞浆转位进入线粒体,氧化细胞色素C而诱导ROS大量产生及氧化应激的发生。本研究采用25mmol/L尿素负荷 HUVECs后,出现胞浆内p66Shc的磷酸化表达上调,提示高浓度尿素可能通过p66Shc引起线粒体ROS的产生。
蛋白激酶C(PKC)作为一种钙磷脂依赖性磷酸化酶,是应激状态下细胞生理功能的主要调节器,其因同工酶结构、特性以及激活剂的不同大致分为4类,PKCβ是其中的一个亚型。PKCβ作为p66Shc上游的信号分子在多种病理生理过程中发挥作用。氧化型低密度脂蛋白可通过PKCβ激活p66Shc促进内皮的吸收,导致动脉粥样硬化的发生[15]。在小肠缺血再灌注损伤中,PKCβ抑制剂LY333531可抑制p66Shc的磷酸化以及随后的线粒体易位氧化细胞色素C等病理过程,从而缓解缺血再灌注引起的氧化应激和细胞凋亡[16],而PKCβ/p66Shc信号通路在高浓度尿素引起HUVECs损伤的过程中的作用还未见报道。本研究PKCβ抑制剂LY333531可明显阻断高浓度尿素上调HUVECs内p66Shc磷酸化水平的作用,提示PKCβ是p66Shc的上游信号分子,调控其表达水平及磷酸化过程可影响尿素诱导HUVECs细胞ROS的产生。
我们的研究表明,高浓度尿素可能通过激活PKCβ,增加p66Shc蛋白水平及磷酸化水平,经p66Shc线粒体转位而诱导ROS的大量产生和氧化应激的发生,引起HUVECs细胞损伤。而高浓度尿素诱导的氧化应激是否引起后续的炎症反应及其机制还需要进一步的研究。
[1]Kendrick J,Cheung AK,Kaufman JS,et al.FGF-23 associates with death,cardiovascular events,and initiation of chronic dialysis.J Am Soc Nephrol,2011,22(10): 1913-1922.
[2]Zhang Z,Dmitrieva NI,Park JH,et al.High urea and NaCl carbonylate proteins in renal cells in culture and in vivo,and high urea causes 8-oxoguanine lesions in their DNA.ProcNatlAcadSciUSA,2004,101(25): 9491-9496.
[3]D'Apolito M,Du X,Zong H,et al.Urea-induced ROS generation causes insulin resistance in mice with chronic renal failure.J Clin Invest,2010,120(1):203-213.
[4]王琦,王洪凯,刘丽君等.高浓度尿素诱导人脑微血管内皮细胞系产生炎性因子.基础医学与临床,2015,35(2):152-156.
[5]Shi Y,Lüscher TF,Camici GG,et al.Dual role of endothelial nitric oxide synthase in oxidized LDL-induced, p66Shc-mediated oxidative stress in cultured human endothelial cells.PLoS One,2014,9(9):e107787.
[6]Edwards NA,Watson AJ,Betts DH,et al.P66Shc,a key regulator of metabolism and mitochondrial ROS production, is dysregulated by mouse embryo culture.Mol Hum Reprod,2016,22(9):634-647.
[7]Liang L,Zhang Z.Gambogic Acid inhibits malignant melanoma cell proliferation through mitochondrial p66shc/ROS-p53/Bax-mediated apoptosis.Cell Physiol Biochem,2016, 38(4):1618-1630.
[8]Yang SK,Xiao L,Li J,et al.Oxidative stress,a common molecular pathway for kidney disease:role of the redox enzyme p66Shc.Ren Fail,2014,36(2):313-320.
[9]Zhu DD,Tang RN,Lv LL,et al.Interleukin-1β mediates high glucose induced phenotypic transition in human aortic endothelial cells.Cardiovasc Diabetol,2016,15(42): 1-12.
[10]Mehta NK,Mehta KD.Protein kinase C-beta:An emerging connection between nutrient excess and obesity.Biochim Biophys Acta,2014,1841(10):1491-1497.
[11]Wang YH,Zhao JJ,Li WM,et al.High-dose alcohol in-duces reactive oxygen species-mediated apoptosis via PKC-β/p66Shc in mouse primary cardiomyocytes.Biochem Biophy Res Commun,2014,456(2015):656-661.
[12]Topanurak S,Ferraris JD,Li J,et al.High NaCl-and ureainduced posttran-slational modifications that increase glycerophosphocholine by inhibiting GDPD5 phosphodiesterase.Proc Natl Acad Sci USA,2013,110(18):7482-7487.
[13]Popolo A,Autore G,Marzocco S,et al.Oxidative stress in patients with cardiovascular disease and chronic renal failure.Free Radic Res,2013,47(5):346-356.
[14]Coaccioli S,Standoli ML,Biondi R,et al.Assessment of the oxidative stress markers in patients with chronic renal insufficiency undergoing dialysis treatment.Clin Ter,2010, 161(5):441-444.
[15]Shi Y,Cosentino F,Camici GG,et al.Oxidized low-density lipoprotein activates p66Shc via lectin-like oxidized lowdensity lipoprotein receptor-1,protein kinase C-β,and c-Jun N-terminal kinase kinase in human endothelial cells. Arterioscler Thromb Vasc Biol,2011,9(31):2090-2097. [16]Wang G,Chen Z,Zhang F,et al.Blockade of PKCβ protects against remote organ injury induced by intestinal ischemia and reperfusion via a p66shc-mediated mitochondrial apoptotic pathway.Apoptosis,2014,9(19):1 342-1353.
《中国组织化学与细胞化学杂志》2017年度征订启事
《中国组织化学与细胞化学杂志》(Chinese Journal of Histochemistry and Cytochemistry)是由中国科学技术协会主管,中国解剖学会和华中科技大学同济医学院主办,中国组织化学与细胞化学杂志编辑委员会编辑出版,国内外公开发行的国家级刊物。国际标准刊号为ISSN1004-1850,国内标准刊号为CN42-1300/Q。本刊为中国科技论文统计源(核心)期刊、中国生物学文献数据库收录期刊,全文入编《中国科学引文数据库》(CSCD)、中国学术期刊全文数据库(CNKI)、中国核心期刊(遴选)数据库、中文科技期刊数据库、美国《化学文摘》(CA)。
本刊涵盖领域为:应用组织化学与细胞化学、酶组织化学、免疫荧光组织化学、超微结构细胞化学、放射自显影、原位杂交组织化学、体视学及图像分析等形态学相关技术、细胞及分子生物学技术、流式细胞术进行基础及临床研究的相关论著。刊登研究范围包括但不限定于细胞、组织、器官的形态及功能研究;炎症、肿瘤、遗传性疾病的病理改变及相关机制探讨;感染性疾病的医学检验;免疫细胞治疗、干细胞治疗、肿瘤疫苗等生物学治疗的相关研究。本刊辟有"论著"、"综述"、"研究通讯"、"新技术交流"、"教学改革"等栏目,将会及时报道基础医学、临床医学及其他生命科学领域应用组织化学与细胞化学技术的最新研究成果。
本刊为双月刊,逢双月末出版,每期30元,全年180元。现已开始办理征订。欢迎全国各省、市、自治区图书馆,大专院校,科研单位及个人订阅。
订阅方法:本刊实行自办发行,请各位作者读者在本刊网站http://www.cjhc.org.cn/的"信息公告"里下载并填写《中国组织化学与细胞化学杂志2017年度征订单》,将杂志订阅费由邮局汇至本刊编辑部或汇至本刊银行账户,然后将汇款凭证拍照连同《中国组织化学与细胞化学杂志2017年度征订单》一起发给编辑部邮箱,编辑部会根据相关信息建立读者档案并按时向读者邮寄杂志(订阅费发票会随首期杂志同时寄出)。
1.邮局汇款:
收款人:《中国组织化学与细胞化学杂志》编辑部
湖北省武汉航空路13号华中科技大学同济医学院内邮政编码430030
2.银行汇款:
收款人户名:《中国组织化学与细胞化学杂志》社有限公司
账号:3202120509060032443
开户银行:中国工商银行武汉分行广源支行
《中国组织化学与细胞化学杂志》编辑部2016年10月
PKCβ/p66Shc pathway mediates the production of ROS induced by high concentration urea in human umbilical vein endothelial cells
He Fei1,2,Fan Chunhua1,2,Guo Pei1,2,Wang Hongkai1,2,Zhou Hongyu1,2,Chen Yi1,2,Li Jinfang3,Ran Jianhua1,2*
(1Department of Anatomy,College of Basic Medicine,2Neuroscience Research Center,3Department of Neurology,the 2nd Affiliated Hospital,Chongqing Medical University,Chongqing,400016,China)
Objective To investigate the role of PKCβ/p66Shc pathway in the production of reactive oxygen species(ROS)in human umbilical vein endothelial cells(HUVECs)treated with urea.Methods HUVECs cultured in vitro were randomly divided into normal control group,mannitol group,urea group,and urea+LY333531(PKCβ inhibitor)group.The activities and morphological changes of the cells treated with high concentration urea were detected by the CCK 8 assay and observed under an inverted microscope. ROS content was measured by DCFH-DA method.The levels of p66Shc,p-p66Shc,PKCβ and p-PKCβ were detected by Western blot.Immunofluorescence assay was used to observe the level of p-p66Shc in the HUVECs.Results The vitality of HUVECs in culture was inhibited greatly by urea at the concentration of 25 mmol/L with morphological changes including disordered arrangement,enlarged cell gap and destructive cobblestone appearance.Compared with the control group,the fluorescence intensity of ROS in the cytoplasm was enhanced significantly in HUVECs treated with 25 mmol/L urea and reached peak at 6h treatment,while decreased obviously with the addition of PKCβ inhibitor LY333531.Western blot results showed the levels of p66Shc,p-p66Shc,PKCβ and p-PKCβ were increased by by 25mmol/L urea treatment,and enhanced gradually with time extension.The immunoreactivity of p-p66Shc in the cytoplasm increased significantly after 6h of 25 mmol/L urea treatment,and LY333531 could block this effect;western blot results also showed that increased expression of p-p66Shc induced by high concentration of urea was inhibited by LY333531.Conclusion PKCβ/p66Shc signaling pathway plays an important role in the excessive production of ROS in HUVECs treated with high concentration urea.
Urea;HUVECs;PKCβ/p66Shc;ROS
R363.1
A
10.16705/j.cnki.1004-1850.2016.05.001
2016-07-28
2016-10-09
重庆市科技计划项目(cstc2015jcyjA10036);重庆市卫生局项目(2012-1-038);重庆市教委项目(KJ120330,KJ120314);重庆医科大学大学生科学研究与创新实验项目(201403,201609);国家(市)级大学生创新创业训练计划项目(201410631003)
何菲,女(1990年),汉族,硕士研究生
(To whom correspondence should be addressed):ranjianhua@cqmu.edu.cn

