一株苦马豆素降解菌的分离与鉴定
贾琦珍,陶大勇,邓 利,陈根元,王 帅
(塔里木大学 动物科学学院,新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
一株苦马豆素降解菌的分离与鉴定
贾琦珍,陶大勇,邓 利,陈根元,王 帅
(塔里木大学 动物科学学院,新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
旨在从小花棘豆(OxytropisglabraDC)生长环境中分离可降解其主要毒性成分苦马豆素(Swainsonine,SW)的微生物。通过富集驯化培养,以SW为唯一碳源,从埋置小花棘豆的土壤中分离得到1株SW降解菌。形态学观察表明该降解菌为革兰氏阴性短小杆菌,无荚膜,无鞭毛;生理生化检测发现该降解菌氧化酶阳性,不产吲哚,不水解淀粉;16S rDNA 序列比对分析表明该降解菌属于假单胞菌科假单胞菌属微生物,序列比对发现与恶臭假单胞菌(Pseudomonasputida)同源性最高。在SW无机盐液体培养基中培养24 h,菌株对100 mg/L SW的降解率为30.12%,延长培养时间不能提高其降解SW的能力,但可在高质量浓度SW(1 000 mg/L)的处理下生长;该降解菌在无SW刺激的条件下转接 50 代,对100 mg/L SW的降解率无明显影响。
苦马豆素;小花棘豆;生物降解;假单胞菌
疯草是豆科棘豆属、黄芪属和苦马豆属等有毒植物的总称,广泛分布于世界各地,具有繁殖系数高、抗逆性强、返青早、根系发达等特点,严重危害草地畜牧业的发展[1]。国内外研究[2-3]表明,因疯草大量蔓延导致草场生态平衡受到破坏,天然草地退化严重,目前每年有700多万只放牧家畜因采食疯草中毒,严重的可导致死亡。苦马豆素(Swainsonine,SW)是疯草的主要毒性成分[4],通过影响动物的繁殖系统、神经系统等导致动物中毒;但疯草具有丰富的氨基酸、微量元素和能量物质,可作为潜在的牧草资源,如能有效利用,既可促进畜牧业的可持续发展,又有利于环境保护[5]。目前疯草的防除主要有物理方法(人工挖除、焚烧等)、化学方法(除草剂灭除)和生物方法(以草治草、以虫治草、以菌治草、以畜治草)等[6],研究最多、最有成效的方法是SW的微生物降解,从而使疯草去除毒性得到利用。本试验拟从埋置疯草的土壤中富集筛选,找到高效稳定降解 SW 的菌株,为疯草的开发利用提供借鉴。
1 材料与方法
1.1 材 料
小花棘豆于2014年9月采自新疆克州阿合奇县色帕巴依乡,由塔里木大学动物科学学院草业科学学科组鉴定,气相色谱内标法测定小花棘豆样品中SW质量分数为(19.52±2.78) mg/kg,确定为疯草[5];采集小花棘豆生境地下0~30 cm土壤,密封后带回。
SW标准品(质量分数>99%,生产批号0B003616),甲基-α-D-吡喃甘露糖苷(me-gal,质量分数>99%,生产批号M7257),美国Sigma-Aldrich公司;双(三甲基硅烷基)三氟乙酰胺+三甲基氯硅烷(BSTFA+TMCS,二者体积比为99∶1,生产批号LB62404),美国Supelco公司;吡啶,色谱纯,天津市光复精细化工研究所;TaqⅠ DNA聚合酶(1189A)、DL2000 DNA Marker(3591A)、IPTG(9030)、X-Gal(9031)等均购自TAKARA宝生物工程(大连)有限公司;细菌基因组提取试剂盒、DNA片段快速回收纯化试剂盒,北京天根生化科技有限公司。其余试剂均为国产分析纯。
Carry 100型紫外-可见分光光度计,美国Varian公司;CX31型生物显微镜, 奥林巴斯(中国)有限公司;Direct-Q3型超纯水系统,美国Millipore公司;DYY-Ⅱ型电泳仪,北京六一生物科技有限公司;GC-C14气相色谱仪,岛津(中国)有限公司。
1.2 主要培养基
无机盐培养基:NH4NO31.0 g,(NH4)2SO40.5 g,MgSO40.15 g,NaCl 0.5 g,K2HPO41.5 g,KH2PO40.5 g,蒸馏水1 000 mL ,pH 7.0~7.2;固体培养基每100 mL再加入1.8 g琼脂。
牛肉膏蛋白胨培养基(NA):胰蛋白胨1.0 g,牛肉浸膏 0.5 g, NaCl 0.5 g,K2HPO40.1 g,蒸馏水1 000 mL ,pH 7.0~7.2 ;固体培养基每100 mL再加入2.0 g琼脂。
普通肉汤培养基(LB):胰蛋白胨 10 g,酵母浸膏 5.0 g,NaCl 10 g,蒸馏水1 000 mL ,pH 7.0~7.2。
1.3 SW降解菌的筛选
称取小花棘豆鲜样10 g,埋置于采集的土壤中60 d。去除植物残渣和砂砾等,称取土壤10 g,加入90 mL灭菌蒸馏水,200 r/min振荡混匀10 min。静置后取上清液10 mL接种于90 mL液体NA培养基,37 ℃,200 r/min培养24 h。取10 mL上述培养基接种于90 mL 含50 mg/L SW的无机盐培养基中,37 ℃ 200 r/min振荡培养。每隔3 d按10%的接种量接种于新鲜的无机盐培养基中,并逐步提高SW的质量浓度,直至1 000 mg/L。然后涂布接种于SW无机盐固体培养基,37 ℃培养24 h后根据菌落形态进行分离纯化。挑取纯化菌种置于含50 mg/L SW的无机盐液体培养基中,37 ℃、200 r/min振荡培养3 d,然后接种于斜面培养基,4 ℃保存。
1.4 SW降解菌降解能力的测定
将获得的SW降解菌接种于含不同质量浓度(50、100、200、400、800和1 000 mg/L)SW的无机盐液体培养基中,37 ℃培养24 h。参照文献[7]方法,分别取100 μL培养前和培养后的培养基,加入去离子水100 μL和丙酮600 μL,超声处理15 min 以去除培养基中的蛋白质等杂质,然后12 000 r/min离心10 min取上清液;重复3次后合并上清液,冷冻干燥得到待测样。将待测样与内标物甲基-α-D-吡喃甘露糖苷溶于吡啶,再与衍生剂双(三甲基硅烷基)三氟乙酰胺+三甲基氯硅烷反应5 h后,采用气相色谱内标法检测SW质量浓度。其色谱条件为:进样口温度300 ℃,柱温200 ℃,FID温度280 ℃,分流比60∶1,载气为高纯H2,压力200 kPa,进样量为1 μL。降解率计算方法参照文献[8]。
1.5 SW降解菌降解SW稳定性的测定
将该降解菌接入无 SW 刺激的 LB 斜面上,每隔48 h转接1次,连续转接50次,每隔10代按“1.4”方法检测对100 mg/L SW的降解率。
1.6 SW降解菌的鉴定
将分离得到的SW降解菌在普通琼脂培养基中培养48 h,依据《伯杰细菌鉴定手册》[9],通过形态观察、革兰氏染色和生理生化试验进行初步鉴定;然后提取降解菌DNA,采用细菌16S rDNA通用引物进行PCR扩增,引物为27f-1492r,并转入E.coliDH5α,蓝白斑筛选后,挑取白色克隆培养送TAKARA(大连)有限公司测序、拼接。将得到的序列用NCBI在线BLAST进行同源性比对。用MEGA6.0软件进行序列比对,并进行同源性和系统学分析,构建进化树并判断其分类。
1.7 数据分析
试验数据使用SPSS 16.0软件中One-Way ANOVA方法进行单因素方差分析。
2 结果与分析
2.1 SW降解菌的筛选
根据菌落形态,试验初步分离得到28株菌。以SW为唯一碳源,细菌在无机盐培养液中培养3 d后,通过气相色谱法测定得到1株具有降解SW能力的菌,命名为XJAHQ26菌株。
2.2 降解SW能力的测定
由表1可知,当SW质量浓度处于50~1 000 mg/L时,菌株XJAHQ26均具有一定的降解能力。其中,在37 ℃、200 r/min条件下培养24 h,对质量浓度为100 mg/L SW的降解率(30.12%)最高,显著高于对质量浓度为50 mg/L SW的降解率(P<0.05),极显著高于对质量浓度为400、800和1 000 mg/L SW的降解率(P<0.01),但与对质量浓度200 mg/L SW的降解率差异不显著(P>0.05)。表明菌株XJAHQ26对低质量浓度(≤200 mg/L)SW的降解效果较好,但对较高质量浓度SW(≥400 mg/L)的降解效果较差。
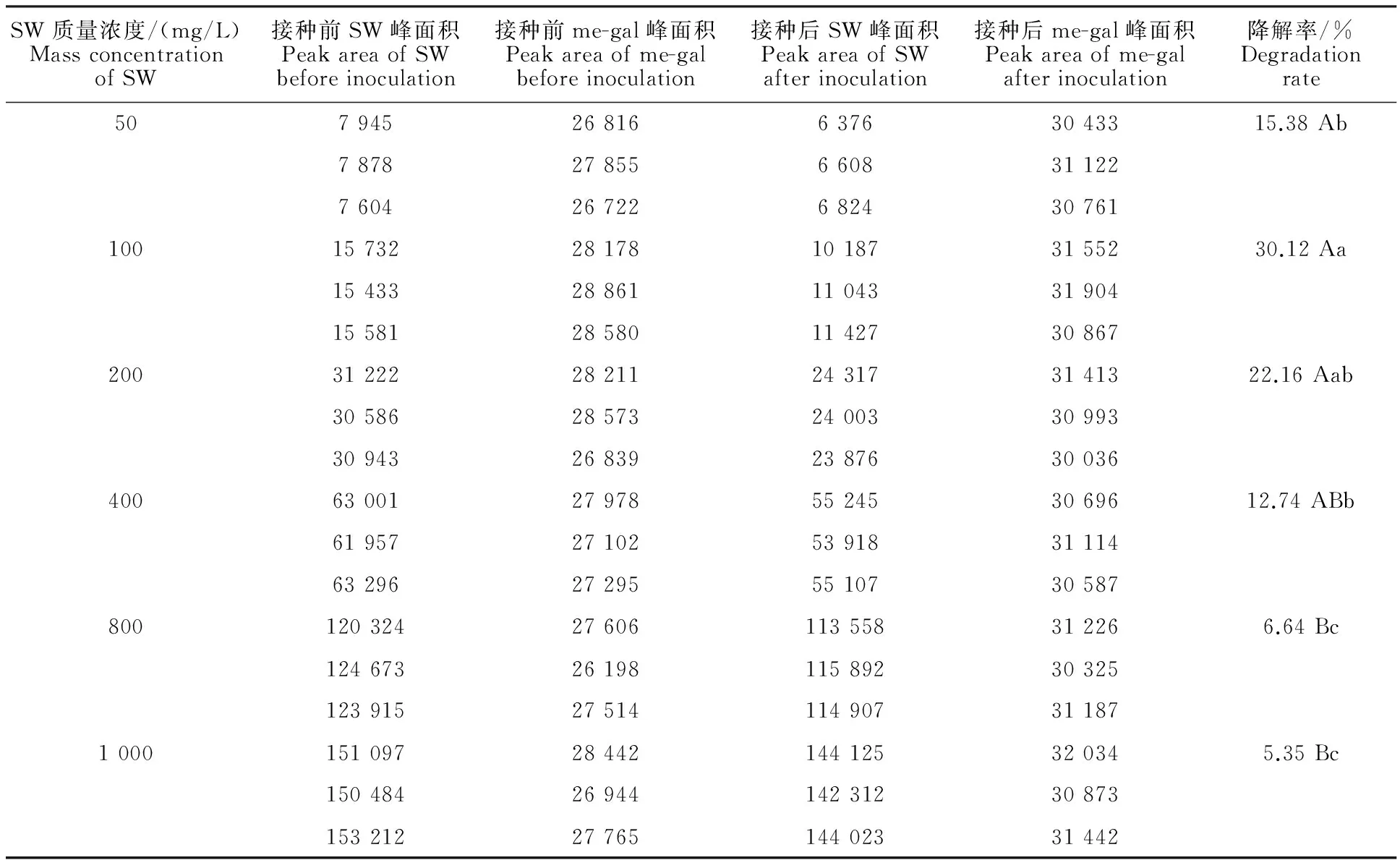
表1 不同SW质量浓度下菌株的降解率
2.3 培养时间对菌株降解SW能力的影响
由表2可知,培养24、48、72、96和144 h时,菌株XJAHQ26对100 mg/L SW的降解率分别为30.12%、33.20%、33.87%、33.73%和33.84%,表明延长培养时间可提高菌株XJAHQ26对100 mg/L SW的降解率,但与培养24h时的降解率差异均不显著(P>0.05)。即延长培养时间并不能有效提高菌株XJAHQ26对100 mg/L SW的降解率,而且试验72 h后,XJAHQ26对SW的降解率趋于稳定。
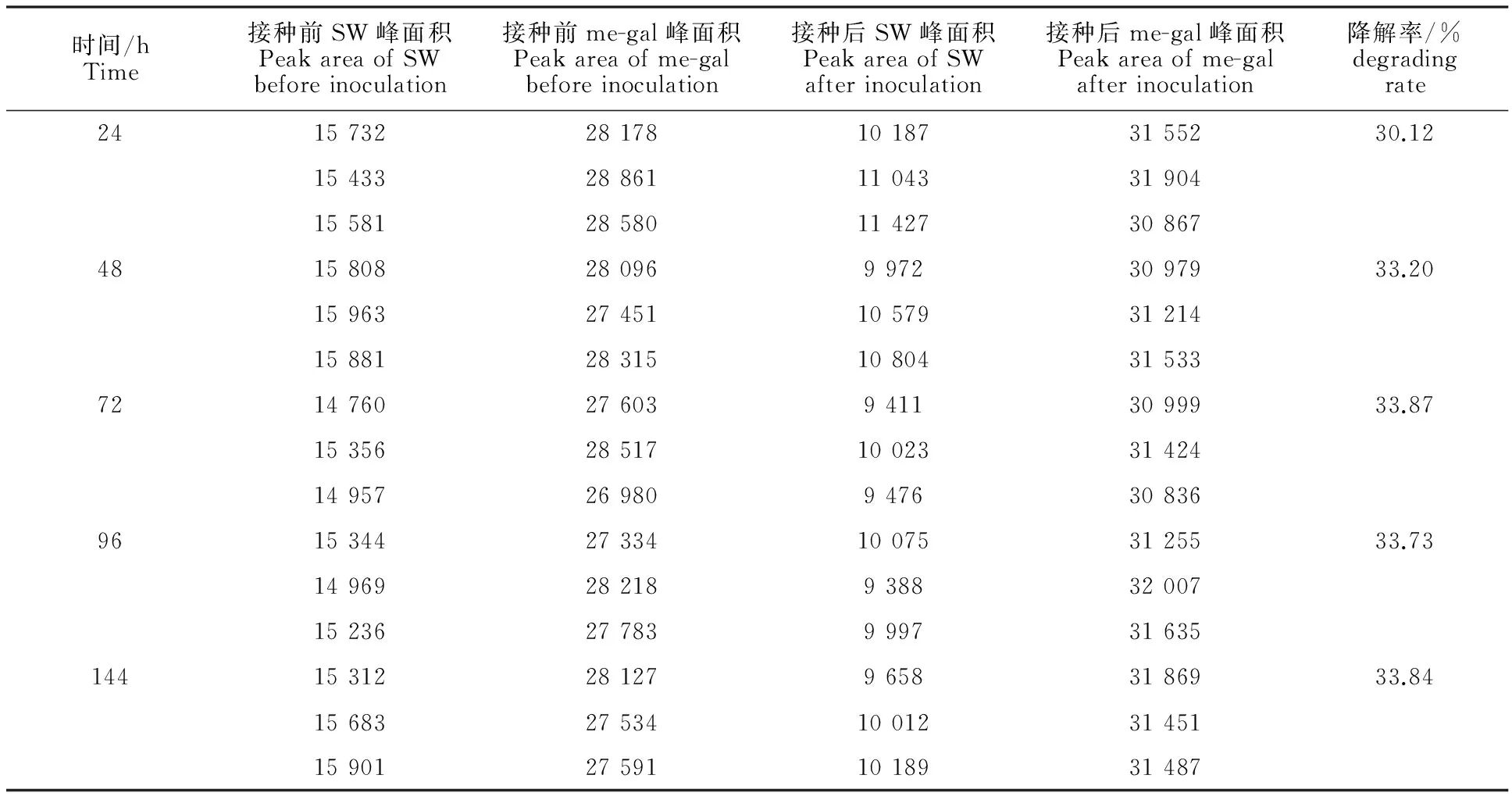
表2 不同培养时间下菌株对SW的降解率
2.4 SW降解菌降解SW的稳定性
如表3所示,转接10、20、30、40和50次时菌株XJAHQ26对100 mg/L SW的降解率分别为30.41%、31.25%、30.64%、30.13%和30.07%,5次测定的降解率差异均不显著(P>0.05)。表明菌株XJAHQ26具有较好的降解稳定性,在疯草的脱毒利用方面具有一定的研究价值。
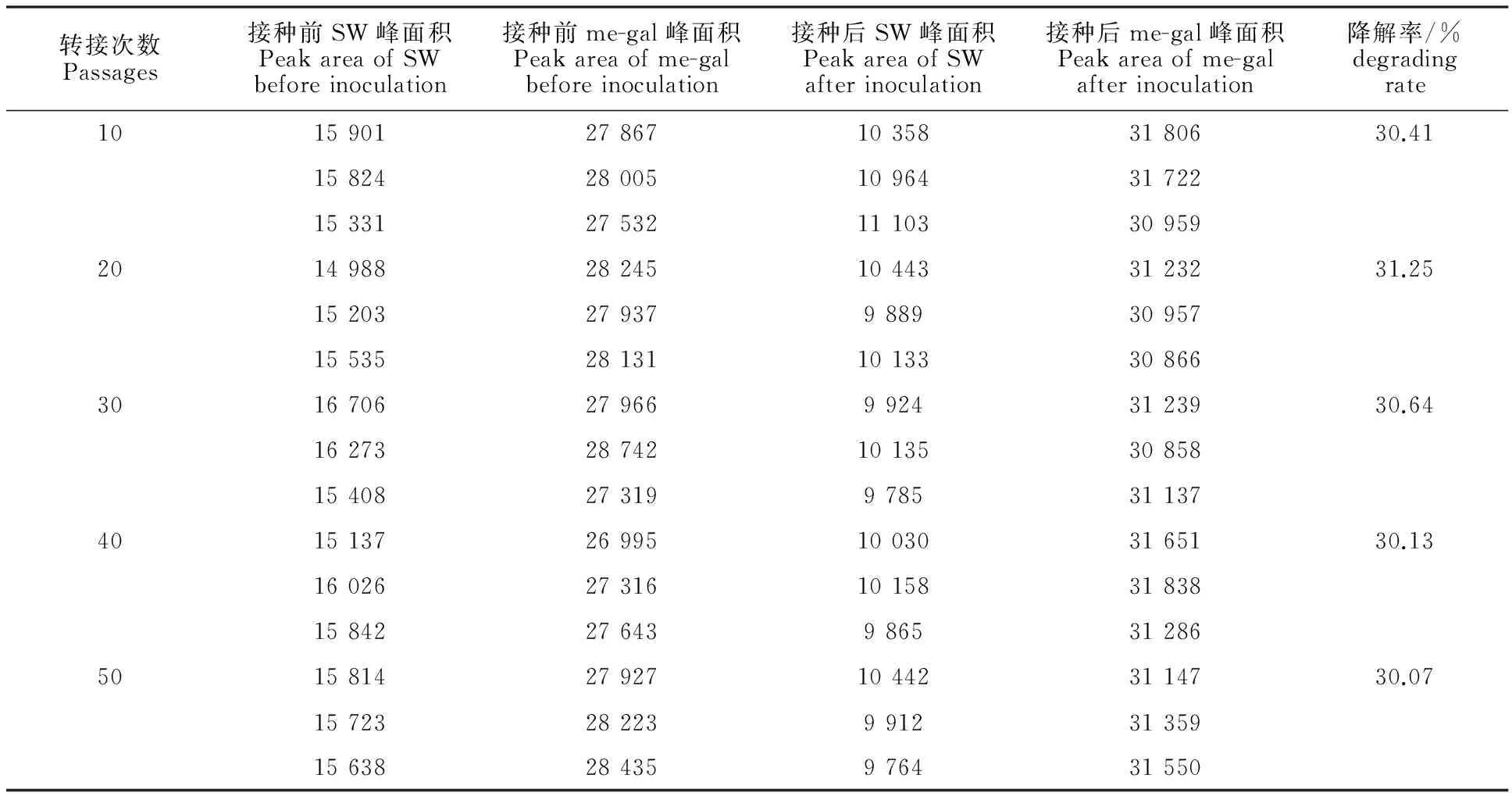
表3 不同转接次数的菌株SW降解率
2.5 降解菌的形态及生理生化鉴定结果
通过菌落形态观察和革兰氏染色,菌株XJAHQ26为革兰氏阴性短杆菌,无芽孢,无荚膜。在LB平板上为乳白色圆形菌落,边缘整齐,表面光滑,如图1和图2所示。
细菌的部分生理生化特征为:吲哚试验阴性、鞭毛染色阴性、葡萄糖发酵阴性、蔗糖发酵阴性、乳糖发酵阴性、甘露醇发酵阴性、淀粉水解阴性、硝酸盐还原阴性、硫化氢生成阴性、过氧化氢酶反应阳性、接触酶反应阴性、明胶水解试验阴性、甲基红试验阴性、苯丙氨酸试验阳性、精氨酸试验阳性、脯氨酸试验阳性。参照《伯杰细菌鉴定手册》[9],初步判断为假单胞菌属(Pseudomonas)。

图1 菌株XJAHQ26菌落形态
2.6 降解菌的分子鉴定结果
图2 菌株XJAHQ26的革兰氏染色
测序结果表明菌株XJAHQ26的16S rDNA序列长度为1439bp,将菌株的16S rDNA序列与NCBI中核酸16S rDNA序列进行BLAST比对,发现其与假单胞菌属(Pseudomonas)恶臭假单胞菌(Pseudomonasputida)的一致性为100%。选取与其相近的部分菌株16S rDNA序列利用 MEGE 6.0 软件建立无根进化树(图3),确定该菌株为恶臭假单胞菌(Pseudomonasputida)。

图3 基于菌株XJAHQ26和亲源关系相近菌株的16S rDNA序列的无根系统发育树
3 讨 论
中国现有黄芪属植物278种,棘豆属植物120种,苦马豆属植物1种,其中新疆分布黄芪属植物81种,约占全国总种数的29%;棘豆属植物97种,约占中国总种数的81%,苦马豆属植物1种[4]。新疆牧区草原分布的疯草(主要毒性成分为SW)共20种,其中优势种8种,分布面积已超过100万hm2,并且每年还在以3.3%~3.5%的速度蔓延,现已严重影响新疆草原畜牧业的可持续发展[6]。疯草的防除方法目前主要有人工挖除、化学灭除和生物防除等,其中,生物防除是通过生物间的互相制约关系进行防除,具有较好的防除效果与生态效应。比如在疯草滋生的地段,通过改变土壤氮、磷水平及补播一些适宜的优良牧草,或采用封滩育草和草地施肥及灌溉等措施,使草地上优良牧草增多,疯草减少;还可利用家畜或昆虫对疯草的专嗜性进行灭除;也可在疯草含毒量较低的生长阶段适时适度放牧,即可减少疯草数量,又可利用疯草中的营养物质。应用生物降解手段如培育SW降解菌也为解决家畜疯草中毒提供一条新的途径。
利用微生物进行毒素降解具有成本低、对环境影响小、可最大限度降低污染物浓度、可用于其他技术难以应用的场地等优点。国内研究人员对SW的微生物降解已进行大量的前期工作。李勤凡[10]从冰川棘豆生长的环境土壤中分离得到1株能降解SW的菌,其对50 mg/L SW的降解率为14.2%。Zhao等[11]通过富集驯化培养,从甘肃棘豆生长环境中的土壤中分离出4株SW降解菌,对SW的降解率分别为100%、100%、99.03%和 97.80%,鉴定发现1株为醋酸钙不动杆菌,1株为多食鞘氨醇杆菌,其余2株为嗜麦芽寡养单胞菌;但4株菌降解 SW 的稳定性均较差,不便于对 SW 降解机制及应用的研究。Wang等[12]从埋置黄花棘豆的土壤中分离得到1株SW降解菌,经鉴定与解硝基邻甲氧基苯酚节杆菌同源性最高,最终命名为ArthrobacternitroquajacolicusHW08;该菌连续在无SW刺激的条件下转接100次,仍能在4 h内降解300 mg/L的SW。胡延春等[8]从甘肃棘豆内生细菌中筛选到1株SW降解菌,鉴定为缺陷短波单胞菌,命名为BrevundimonasdiminutaAb,但其对100 mg/L SW的降解率仅为11.577 1%。本试验获得1株可降解SW的恶臭假单胞菌(Pseudomonasputida),对200 mg/L 以下质量浓度的SW均具有较高的降解率,而且该株菌在无SW刺激的条件下转接50次,SW降解能力无显著下降,表明具有较好的稳定性。目前,假单胞菌主要应用于有机物污染和重金属污染的生物修复,尚未有假单胞菌属降解生物碱的报道,本试验首次发现恶臭假单胞菌具有降解SW的能力,为SW降解菌的筛选提供新的方向。
SW的降解途径、降解产物及是否对动物具有毒性已有部分结论,SW降解菌的实验室培养、降解酶的分离、结构测定及编码酶基因的测序等方法也趋于完善。在此基础上,可以进一步构建出基因工程菌或开发出酶制剂,应用到生产实践中解决疯草中毒问题。Wang等[13]认为菌株YLZZ-2降解SW的能力与质粒有关,质粒消除则降解能力就丧失。但胡延春等[14]制备节杆菌ArthrobacternitroquajacolicusHW08的质粒,检测发现无质粒存在,表明其降解SW的功能基因存在于基因组中。国内外研究[13-15]表明,假单胞菌降解有机污染物质的基因多数是在质粒上,但其降解SW的功能基因存在于质粒还是基因组中,仍有待于进一步研究。
4 结 论
从小花棘豆生境土壤中筛选得到1株SW降解细菌,通过形态学、生理生化及分子生物学方法鉴定,初步判断该菌为恶臭假单胞菌(Pseudomonasputida),命名为XJAHQ26。该菌在37 ℃、200 r/min条件下培养24 h,对质量浓度为100 mg/L SW的降解率为30.12%,延长培养时间并不能明显提高其降解SW的能力,但该菌能耐受高质量浓度(1 000 mg/L)的SW,而且具有较好的降解稳定性。
Reference:
[1]夏晨阳,刘建枝,王敬龙,等.西藏自主研发预防剂对疯草中毒藏山羊血液生化指标影响研究[J].西南农业学报,2015,28(1):419-422.
XIA CH Y,LIU J ZH,WANG J L,etal.Study on effect of Tibet locally researched and developed prophylactic on blood biochemical indexes of goats with locoweed toxicosis[J].SouthwestChinaJournalofAgriculturalSciences,2015,28(1):419-422(in Chinese with English abstract).
[2]YANG G D,GAO R,WANG Y,etal.Determination of swainsonine in the endophyticUndifilumfungi by high-performance liquid chromatography with evaporative light-scattering detecto[J].Toxicon,2012,60(1):44-49.
[3]陈根元,贾琦珍,潘伊微,等.家兔苦马豆素多克隆抗体的制备及其对小花棘豆中毒的治疗效果[J].西北农业学报,2014,23(1):23-29.
CHEN G Y,JIA Q ZH,PAN Y W,etal.Preparation of rabbit polyclonal antibody against swainsonine and its effects on poisoning byOxytropisglabraDC[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(1):23-29(in Chinese with English abstract).
[4]吴晨晨,赵宝玉,路 浩,等.中国主要疯草中苦马豆素的动态变化规律[J].西北农业学报,2014,23(5):51-58.
WU CH CH,ZHAO B Y,LU H,etal.Dynamic change of swainsonine in major locoweed spieces in China [J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(5):51-58(in Chinese with English abstract).
[5]张蕾蕾,余永涛,何生虎,等.不同因素对疯草内生真菌合成苦马豆素的影响[J].畜牧兽医学报,2015,46(1):163-173.
ZHANG L L,YU Y T,HE SH H,etal.Influence of different factors on swainsonine production in fungal endophyte from locoweed[J].ActaVeterinariaetZootechnicaSinica,2015,46(1):163-173(in Chinese with English abstract).
[6]邓 利,谢 丽,何 雯,等.小花棘豆防除方法的研究进展[J].新疆畜牧业,2015(2):10-12.
DENG L,XIE L,HE W,etal.Research progress of methods of control inOxytropisglabraDC[J].XinjiangHusbandry,2015(2):10-12(in Chinese).
[7]王 帅,陈根元,胡建军,等.气相色谱内标法测定南疆地区小花棘豆中苦马豆素含量[J].新疆农业科学,2011,48(4):723-728.
WANG SH,CHEN G Y,HU J J,etal.Determination of Swainsonine inOxytrpisglabraDC in South Xinjiang by internal standard gas chromatography[J].XinjiangAgriculturalSciences,2011,48(4):723-728(in Chinese with English abstract).
[8]胡延春,刘 鹏,赵春蕊,等.甘肃棘豆中降解苦马豆素内生细菌的筛选与鉴定[J].浙江大学学报(农业与生命科学版),2011,37(5):521-526.
HU Y CH,LIU P,ZHAO CH R,etal.Screening and identification of endophytic bacteria ofOxytropiskansuensisBunge for swainsonine degradation[J].JournalofZhejiangUniversity(Agricultural&LifeSciences),2011,37(5):521-526(in Chinese with English abstract).
[9]GARRITY G M,BELL J A,LILBUM T G.Taxonomic outline of the prokaryotes[M]//Bergey’s Manual of Systematic Bacteriology,2nd ed,Release 5.0.New York:Springer-Verlag,2004:567-590.
[10]李勤凡.冰川棘豆毒素的毒性及细菌降解研究[D].陕西杨凌:西北农林科技大学,2005.
LI Q F.Studies on toxicity and bacteria degradation ofOxytropisglacialistoxins[D].Yangling Shaanxi:Northwest A&F University,2005(in Chinese with English abstract).
[11]ZHAO X H,HE X,WANG J N,etal.Biodegradation of swainsonine byAcinetobactercalcoaceticusstrain YLZZ-1 and its isolation and identification[J].Biodegradation,2009,3(20):331-338.
[12]WANG Y,HU Y C,WANG J H,etal.Isolation and characterization ofArthrobactersp.HW08 capable of biodegrading swainsonine[J].AfricanJournalofMicrobiologyResearch,2010,4(15):1635-1638.
[13]WANG Y,HU Y C,WANG J H,etal.Ultrasound-assisted solvent extraction of swainsonine fromOxytropisochrocephalabunge[J].JournalofMedicinalPlantsResearch,2011,5(6):890-894.
[14]胡延春,王 妍,杨国栋,等.节杆菌HW08降解SW相关基因的筛选与鉴定[C]// 中国畜牧兽医学会2010年会会议论文集.长春:中国畜牧兽医学会,2010:1550-1554.
HU Y CH,WANG Y,YANG G D,etal.Screening and identification of related genes for degrading SW fromArthrobactersp. HW08[C]// China Clinical Veterinary Meeting.Changchun:Chinese Association of Animal Science and Veterinary Medicine,2010:1550-1554(in Chinese).
[15]IMRE A,OLASZ F,KISS J,etal.A novel transposon-based method for elimination of large bacterial plasmids[J].Plasmid,2006,55:235-241.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Isolation and Identification of Swainsonie Degrading Bacteria
JIA Qizhen,TAO Dayong,DENG Li,CHEN Genyuan and WANG Shuai
(Key laboratory of Tarim Animal Husbandry Science and Technology, Xinjiang Production & Construction Corps,College of Animal Science, Tarim University, Alar Xinjiang 843300,China)
The aim of this study is to investigate the major toxin swainsonine(SW) degrading bacterial strain isolated from soil whereOxytropisglabraDC grows. Using traditional enrichment procedure, this bacterial strain was screened when SW was used as a sole carbon source, and this strain of SW-degrading bacteria was isolated from soil whereO.glabraDC embed. Morphological investigation showed that bacterial strain was Gram negative, bacillus pumilis, capsule-free and flagella-free. Physiological and biochemical results showed that bacterial strain was positive for oxidase, and negative for indoltheticum and amylolysis. 16S rDNA sequencing and blasting indicated that bacterial strain was taxonomically classified asPseudomonas. And the homology exhibited highest compared withPseudomonasputida. Its degradation rate reached to 30.12% under the circumstance of incubation on a shaker at 200 r/min and temperature at 37 ℃ within 24 hours when the concentration of SW was 100 mg/L in inorganic salt liquid medium, the capability of degrading SW could not be improved by extending cultivation time, while it could tolerate high concentration SW up to 1 000 mg/L, this strain was characteristic of degrading 100 mg/L SW after re-inoculating 50 times without stimulus of SW, Its degradation rate had no significant change. one bacterial stain was found resist to SW in this test, this bacterial stain couldbe made use for detoxification and utilization inO.glabraDC.
Swainsonine;OxytropisglabraDC ; Biodegradation;Pseudomonas
JIA Qizhen, female,master,assistant research fellow.Research area:animal pathology. E-mail:xiaxue1984521@126.com
WANG Shuai, male, master, experimentingist. Research area:forage development and utilization. E-mail:wangshuaidky@126.com
2015-07-17
2015-09-15
国家自然科学基金(31460678,31260026);国家星火计划(2015GA891015)。
贾琦珍,女,硕士,助理研究员,研究方向为动物病理学。E-mail:xiaxue1984521@126.com
王 帅,男,硕士,实验师,研究方向为牧草资源开发利用。E-mail:wangshuaidky@126.com
日期:2016-10-20
S859.8
A
1004-1389(2016)10-1554-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1655.040.html
Received 2015-07-17 Returned 2015-09-15
Foundation item National Natural Science Foundation of China (No.31460678,31260026) ; National Sparking Plan Project of China (No. 2015GA891015).

