非小细胞肺癌中Twist通过TGF-β/Smad3信号通路促进EMT的发生
第四军医大学唐都医院胸腔外科(西安 710038)
崔 凯 王武平△ 孙 盈 赵 芳 高贵洲 王晓东 倪云峰 张 涛 卢 强 李小飞
非小细胞肺癌中Twist通过TGF-β/Smad3信号通路促进EMT的发生
第四军医大学唐都医院胸腔外科(西安 710038)
崔 凯 王武平△孙 盈 赵 芳 高贵洲 王晓东 倪云峰 张 涛 卢 强 李小飞
目的:探讨非小细胞肺癌(NSCLC)组织转录因子Twist调控TGF-β/Smad3的表达,促进上皮间质转化(EMT)的发生机制。方法:采用免疫组织化学法检测NSCLC组织样本中Twist、TGF-β/Smad3以及EMT中代表性分子E-cadherin和Vimentin蛋白表达,并统计分析二者表达之间的相关性。结果:Twist、Smad3、Vimentin蛋白阳性着色定位于细胞质和细胞核内,E-cadherin蛋白阳性着色定位于细胞膜。Twist、Smad3、E-cadherin、Vimentin蛋白在NSCLC中阳性率分别为72.3%(120/166)、71.1%(118/166)、54.2%(90/166)、69.9%(116/166),显著高于癌旁组织,差异有统计学意义。Twist与Smad3、Smad3与E-cadherin、Vimentin在NSCLC不同分化程度及不同TNM分期均呈显著相关。结论:NSCLC中Twist可能通过TGF-β/Smad3信号通路促进EMT的发生。
Twist基因,一种碱性螺旋-环-螺旋转录调节因子,正常情况下主要表达于胚胎中胚层、胎盘和成人的某些中胚层来源的未分化组织[1],但在某些肿瘤组织中如胃癌[2]、前列腺癌[3]、乳腺癌也出现高表达[4],提示其可能与肿瘤形成相关。随后研究学者发现Twist还是影响上皮间质转化(Epithelial mesenchymal transition, EMT)过程中的重要分子,即能够抑制E-cadherin的转录而使得上皮细胞不能形成具有粘附特性的成熟上皮细胞,进而促使其向间质细胞转化[5],而EMT的形成能够影响肿瘤细胞的侵袭和迁移[6],由此推测Twist是一种癌基因。Twist基因作为一个高度保守的转录因子,通过何种分子调控肺癌EMT发生并不明确。
根据文献报道,可诱导EMT发生的分子信号通路主要有TGF-β/SMAD3信号通路[7-8]、IL-6/STAT3信号通路[9-10]等。在细胞内,各种信号通路之间并不是孤立存在的,而是通过相互调控、相互制约作用形成一个复杂有序的网络[11]。因此,本研究采用免疫组织化学法检测非小细胞肺癌(Non-small cell lung cancer, NSCLC)组织样本中Twist、TGF-β/Smad3以及EMT中代表性分子E-cadherin和Vimentin蛋白表达,并统计分析这几者表达之间的相关性,初步探讨NSCLC中Twist调控EMT发生的分子机制,为阐明NSCLC侵袭转移的分子机制提供依据。
材料与方法
1 材料选择
1.1 病理资料和组织标本: 研究所用的石蜡包埋标本取自第四军医大学唐都医院胸腔外科实验室的组织标本库。标本选取的对象为2006年1月至2009年1月在我院连续收治的行根治性切除手术的NSCLC患者,共计166 例,有以下情形之一者予以排除:术前曾接受过化疗、放疗或者同步放化疗;术前曾接受过TKIs类药物如吉非替尼、厄洛替尼等靶向药物的治疗。所有患者的术后病理结果均被证实为NSCLC。所有癌组织标本均有配对的正常肺组织标本作为对照。对应的166肺癌患者临床资料信息保存完整,包括:年龄、性别、临床表现、手术方式、肿瘤的大小、组织学类型、分化程度、淋巴结状态等。另外,选取与实验组相对应的50例癌旁正常肺组织标本作为对照组。该研究已通过第四军医大学临床研究伦理委员会批准,所有患者临床信息资料的获得和肿瘤组织样本的使用均得到患者或家属的书面同意。
1.2 主要试剂、仪器及来源: Twist兔单克隆抗体(Abcam公司),Smad3兔单克隆抗体(Abcam公司),E-cadherin兔多克隆抗体(Gene tex公司),Vimentin兔单克隆抗体(Gene tex公司),β-actin单克隆抗体(Abcam公司),兔Streptavidin-HRP试剂盒(带DAB显色液,北京康为世纪公司),恒温水浴箱(北京医疗设备厂),移液器(赛默飞公司),低温冰箱(赛默飞公司),漩涡混合仪(北京同方公司),高速控温离心机(贝克曼库尔特有限公司)。
2 研究方法
2.1 免疫组化步骤:石蜡包埋的组织块被切成厚度约为4μm切片经载玻片捞上后在烤片机上进行烤干。之后将石蜡切片在二甲苯中进行脱蜡,通过一系列的酒精梯度溶液进行再水化;用3mol/L的尿素进行消化30min,以暴露组织内的靶点抗原;加柠檬酸盐溶液进行抗原修复;3%过氧化氢溶液避光条件下封闭30min,以消除过氧化物酶的活性;组织切片于山羊血清中封闭30min,以减少抗体与组织内其它抗原的非特异性结合;孵育一抗,置于4℃冰箱内过夜;次日37℃水温箱内复温45min;孵育二抗,37℃水温箱内反应45min;加入C液,37℃条件下50min;采用DAB法显色;苏木素中浸泡90s,再用盐酸酒精分化液中浸泡7s,脱水后树胶封片。
2.2 免疫组织化学结果的判定:用光学显微镜放大200倍进行免疫组化染色切片的观察,每张切片随机选取5个光镜下视野进行评分。染色面积和着色强度的乘积作为蛋白的免疫组化评分结果。其中染色面积的评分标准:51%~100%的染色面积比率记为3分、11~50%的染色面积比率记为2分、1%~10%的染色面积比率记为1分、1%以下染色面积或没有染色的记为0分。染色强度的评分标准:无染色记为0分 、弱阳性记为1分、中等阳性记为2分、强阳性记为3分。乘积得分分别为0分、1分、2分、3分、4分、6分和9分。其中蛋白的染色结果≥ 4分者被判定为过表达,小于3分者被判定为阴性表达,介于两者之间的被判定为弱表达。弱表达和过表达者均被认为是阳性表达。每张切片均由来自不同医院的经验丰富的2位病理科专家进行双盲观察并打分,最终结果求其平均值。
2.3 统计学方法:采用SPSS 17.0统计学软件(SPSS, Inc.Chicago, IL)。组织中待测蛋白在临床病理特点中的表达差异采用Kruskal Wallis H(三组以上)及 Mann-Whitney U(两组之间)检验法进行秩和检验,当P<0.05时为有统计学意义。待测蛋白表达之间的相关性采用Spearman秩和相关检验,以r表示相关系数(以P<0.05,r>0.3定为有正相关性)。
结 果
1 NSCLC组织中Twist、Smad3、E-cadherin和Vimentin的表达 Twist、Smad3、Vimentin蛋白阳性着色定位于细胞质和细胞核内,呈棕黄色或深黄色颗粒样(附图A、B、D);E-cadherin蛋白阳性着色定位于细胞膜(附图C)。 癌组织Twist蛋白阳性率显著高于癌旁组织(P<0.001);癌组织Smad3蛋白阳性率显著高于癌旁组织(P<0.001);癌组织E-cadherin蛋白阳性率显著低于癌旁组织(P<0.001);癌组织Vimentin蛋白阳性率显著高于癌旁组织(P<0.001),见表1。
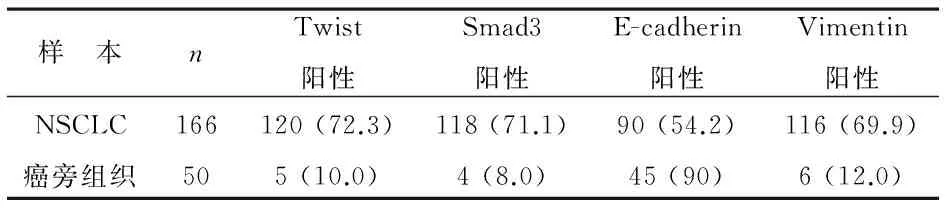
表1 Twist、Smad3、E-cadherin和Vimentin在NSCLC组织样本中的表达 [n (%)]
2 Twist和Smad3在NSCLC中的表达相关性 Spearman相关分析结果显示,Twist与Smad3表达呈正相关,在高、中、低分化中Twist与Smad3有很好的相关性(P值均<0.001,r值均>0.459);Twist与Smad3在TNM I-II和III-IV分期中有很好的相关性(P值均<0.01,r值均>0.806),见表2。
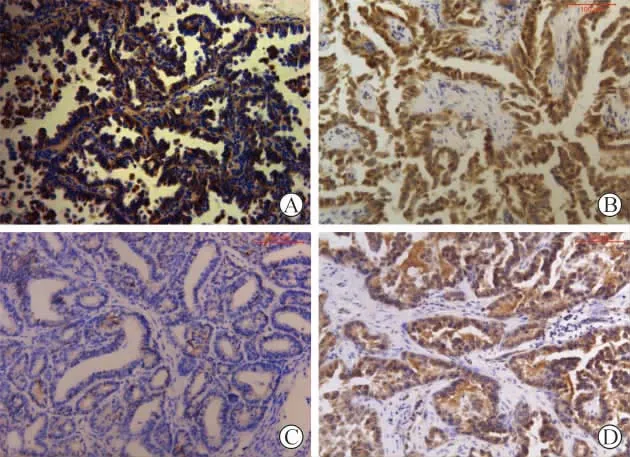
附图 Twist、Smad3、E-cadherin和Vimentin在NSCLC中的表达 (A:Twist 阳性表达;B:Smad3阳性表达;C:E-cadherin阳性表达;D:Vimentin阳性表达)
3 Smad3和E-cadherin、Vimentin在NSCLC中的表达相关性 Spearman相关分析结果显示,Smad3与E-cadherin表达呈负相关,在高、中、低分化中Smad3与E-cadherin有很好的相关性(P值均<0.01,r值均<-0.335);Smad3与E-cadherin在TNM I-II和III-IV分期中有很好的相关性(P值均<0.001,r值均<-0.471),见表3。
Spearman相关分析结果显示,Smad3与Vimentin表达呈正相关,在高、中、低分化中Smad3与Vimentin有很好的相关性(P值均<0.001,r值均>0.798);Smad3与Vimentin在TNM I-II和III-IV分期中有很好的相关性(P值均<0.001,r值均>0.893),见表3。

表2 Twist与Smad3在NSCLC中的表达相关性
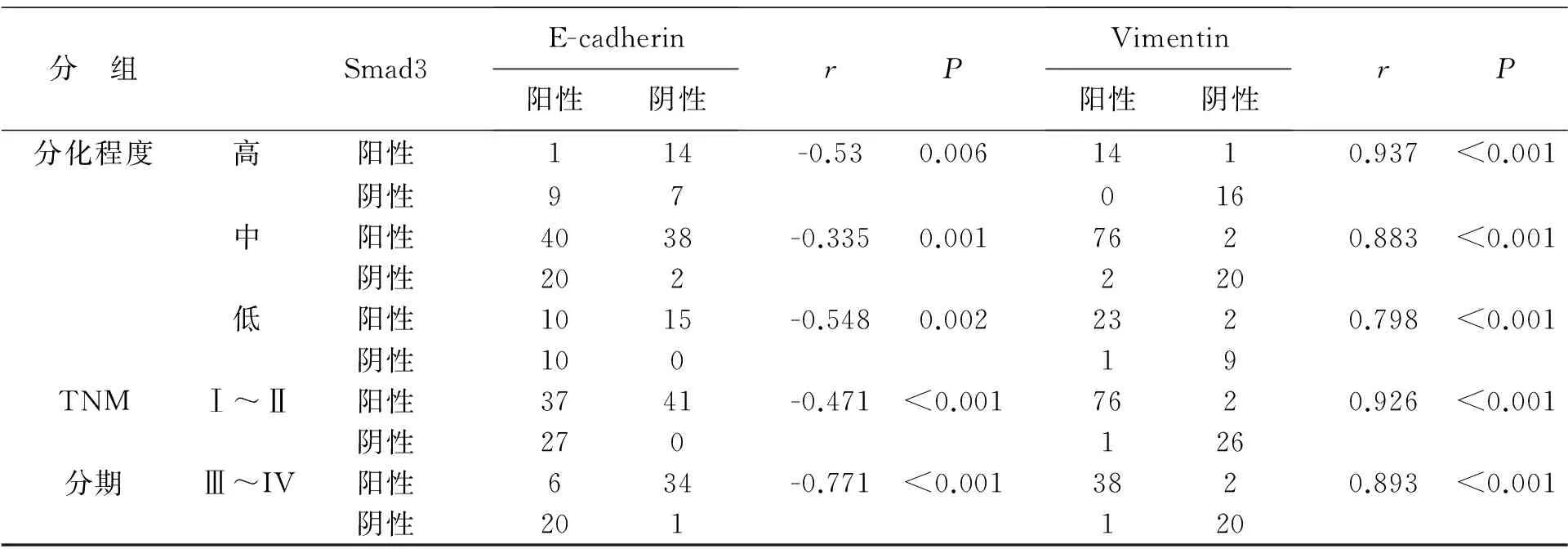
表 3 Smad3与E-cadherin、Vimentin在NSCLC中的表达相关性
讨 论
肺癌是目前国内外发病率和病死率最高的恶性肿瘤之一,其中,NSCLC约占肺癌的85%左右[12]。肿瘤转移是影响肺癌患者生存期短的最主要问题,但其转移机制并不明确。只有深入研究肺癌的转移机制,找到调控其转移的关键靶基因,并对其进行有效的抑制,才能从根本上控制肺癌的转移。
EMT是多细胞生物胚胎发育的基础过程,也存在于多种慢性疾病的发病过程以及肿瘤形成中。其主要特征为:E-钙黏素表达的下调、N-钙黏素表达的上调;角蛋白为主的细胞骨架转化为波形蛋白为主的细胞骨架;以及形态上由上皮细胞转化为具有间充质特征的细胞等。这些特征使肿瘤细胞丧失细胞与细胞之间的连接,从而表现得更具侵袭性[13]。孙菊杰等[14]研究显示,NSCLC中E-cadherin表达降低、Vimentin表达升高,二者的表达均与NSCLC的分化程度、淋巴结转移及临床病理分期密切相关,提示EMT发生于NSCLC发生发展及转移密切相关。另外,还有其它学者研究表明EMT能够参与肿瘤细胞的转移[15]。由此,EMT现象在恶性肿瘤组织中的发生是引起肿瘤转移的关键过程,但调控肺癌EMT发生的机制尚不清楚,急需深入研究。
Twist是近年来倍受关注的癌基因之一,参与EMT过程,使肿瘤细胞通过适应周围基质环境获得新的上皮特性,形成转移病灶,且这种转移灶中的肿瘤细胞迁移、增殖的活性较原发肿瘤更强,并出现抗肿瘤药物的活性[16]。本研究发现,与正常肺组织相比,Twist、Smad3和Vimentin在NSCLC组织中的表达明显增加,而E-cadherin表达明显降低。陈鲲等[17]研究了NSCLC组织中Twist、E-cadherin和Vimentin的表达及其临床意义,发现Twist蛋白在非小细胞肺癌组织及胸腔转移灶中过度表达,可能通过分别上调和下调Vimentin、E-eadherin的表达促进NSCLC的浸润和转移。在Twist高表达的肺癌细胞系中,Vimentin和E-eadherin的比值明显增高,且高表达Twist的肺癌细胞系的迁移能力也显著增强[18]。另外,Twist在别的肿瘤组织及癌细胞中的表达可能也与EMT相关,如胃癌组织及细胞系[19]等。但是Twist通过何种分子调控肺癌EMT发生目前并不明确。
本研究相关分析结果显示,Twist蛋白表达与Smad3在NSCLC组织中表达呈显著正相关性,Smad3蛋白表达与Vimentin在NSCLC组织中表达呈显著正相关性,而Smad3蛋白表达与E-cadherin在NSCLC中表达呈显著负相关性。强烈提示Twist可能通过TGF-β/Smad3信号通路促进NSCLC中EMT的发生。此结论与之前报道的TGF-β/SMAD3信号通路可能是诱导EMT发生主要的分子信号通路结论相符合[7-8]。
综上所述,本文采用免疫组化法初步探讨了NSCLC中Twist调控EMT发生的分子机制,提出了Twist可能通过TGF-β/Smad3信号通路促进NSCLC中EMT的发生这一结论,为阐明NSCLC侵袭转移的分子机制提供依据。
[1] Kang Y, Massagué J. Epithelial-mesenchymal transitions:twist in development and metastasis [J]. Cell, 2004, 118(3):277-279.
[2] Zhang H, Gong J, Kong D,etal. Anti-proliferition effects of Twist gene silencing in gastric cancer SGC7901 cells [J]. World J Gastroenterol, 2015, 21(10):2926-36.
[3] Kwok WK, Ling MT, Lee TW,etal. Up-regulation of TWIST in prostate cancer and its implication as a therapeutic target [J]. Cancer Res, 2005, 65(12):5153-5162.
[4] Watanabe O, Imamura H, Shimizu T,etal. Expression of twist and wnt in human breast cancer [J]. Anticancer Res, 2004, 24(6):3851-3856.
[5] Yang J, Mani SA, Donaher JL,etal. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis [J] .Cell, 2004, 117(7):927-939.
[6] Elias MC, Tozer KR, Silber JR,etal. TWIST is expressed in human gliomas and promotes invasion [J]. Neoplasia, 2005, 7(9):824-837.
[7] Yang H, Zhan L, Yang T,etal. Ski prevents TGF-beta-induced EMT and cell invasion by repressing SMAD-dependent signaling in non-small cell lung cancer [J]. Oncol Rep, 2015,34(1):87-94.
[8] Yi EY, Park SY, Jung SY,etal. Mitochondrial dysfunction induces EMT through the TGF-beta/Smad/Snail signaling pathway in Hep3B hepatocellular carcinoma cells [J]. Int J Oncol, 2015,47(5):1845-53.
[9] Rodriguez JA, Huerta-Yepez S, Law IK,etal. Diminished expression of CRHR2 in human colon cancer promotes tumor growth and EMT via persistent IL-6/Stat3 signaling [J]. Cell Mol Gastroenterol Hepatol, 2015, 1(6): 610-630.
[10] Rokavec M, Ner MG, Li H,etal. Corrigendum. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis [J]. J Clin Invest, 2015,125(3): 1362.
[11] Thiery JP, Sleeman JP. Complex networks orchestrate epithelial-mesenchymal taansitions [J]. Nat Rev Mol Cell Biol, 2006, 7(2):131-142.
[12] Jemal A, Bray F, Center MM,etal. Global cancer statistics [J]. Ca Cancer J Clin, 2011, 61(2): 69-90.
[13] Savagner P. Leaving the neighborhood:molecular mechanisms involved during epithelial-mesenchymal transition [J] .Bioessays, 2001, 23(10):912 -923.
[14] 孙菊杰, 魏 玲, 张德贤, 等. 非小细胞肺癌Twist表达与EMT相关性分析[J]. 中华肿瘤防治杂志, 2014, 21(16):1258-1261.
[15] Zhang H, Liu J, Yue D,etal. Clinical significance of E-cadherin, β-catentin, vimentin and S100A4 expression in completely resected squamous cell lung carcinoma [J]. J Clin Pathol, 2013, 66(11):937-945.
[16] Wang B,Lindley LE,Fernandez-Vega V,etal. The T box transcription factor TBX2 promotes epithelial-mesenchymal transition and invasion of normal and malignant breast epithelial cells [J]. PLoS One,2012,7(7):e41355-e41370.
[17] 陈 鲲, 李明珠, 李 淼, 等. Twist、E-cadherin和Vimentin在非小细胞肺癌中的表达及意义[J]. 辽宁大学学报, 2011, 38(3):235-240.
[18] Nakashima H, Hashimoto N, Aoyama D,etal. Involvement of the transcription factor twist in phenotype alteration through epithelial-mesenchymal transition in lung cancer cells [J]. Mol Carcinog, 2012, 51(5):400-410.
[19] 罗庚求, 文继舫, 李景和, 等. Twist对胃癌细胞系MKN28迁移和侵袭能力的影响[J]. 中南大学学报, 2008, 33(2):174-178.
(收稿:2016-04-20)
Twist induces epithelial-mesenchymal transition in NSCLC by regulating the TGF-β/Smad3 signaling pathway Department of Thoracic Surgery,Tang Du Hospital of Foruth Military University(Xi’an710038)
Cui Kai Wang Wuping Sun Ying et al
Objective: To investigate the role of Twist which may induce EMT through TGF-β/Smad3 pathway in NSCLC, the expression of Twist, Smad3, E-cadherin and Vimentin molecules were detected and the correlations were discussed. Methods: Twist, Smad3, E-cadherin and Vimentin expressions in tumor tissues were assessed using immunohistochemical (IHC) methods in patients with resected NSCLC, and the correlation of Twist with Smad3, Smad3 with E-cadherin and Vimentin expression were analyzed. Results: The expression of Twist、Smad3、Vimentin were mainly located in cytoplasm and cell nucleus, and the expression of E-cadherin was mainly located on cell membrane. The positive expression rates of Twist, Smad3, E-cadherin and Vimentin protein in NSCLC were 72.3% (120/166), 71.1% (118/166), 54.2% (90/166), 69.9% (116/166), which were higher than corresponding adjacent non-cancerous tissue with statistical difference (P<0.001). The correlation of Twist with Smad3, Smad3 with E-cadherin and Vimentin were obvious in pathological grads and TNM stages groups in NSCLC. Conclusion: Twist may induce EMT in NSCLC by regulating the TGF-β/Smad3 signaling pathway.
Lung neoplasms/immunology @Twist genes Transforming growth factor beta Smad3 protein Stromal cells Cell line,transformed
肺肿瘤/免疫学 @Twist基因 转化生长因子βSmad3蛋白 间质细胞 细胞系,转化
R
Adoi:10.3969/j.issn.1000-7377.2016.11.007
△通讯作者

