刺参体腔细胞类型及其死亡率与温度的关系
陈 庭 家, 田 景 玉, 丁 月, 隋 凌 云, 宋 亮,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心,辽宁 大连 116034 )
刺参体腔细胞类型及其死亡率与温度的关系
陈 庭 家1, 田 景 玉1, 丁 月1, 隋 凌 云1, 宋 亮1,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心,辽宁 大连 116034 )
应用光镜和透射电镜技术研究了刺参体腔细胞的类型,结合流式细胞术分析了刺参体腔细胞的亚群。光学显微镜下,根据细胞形态将体腔细胞分为球型细胞、变形细胞、淋巴样细胞和纺锤细胞;透射电镜下,根据细胞结构将体腔细胞分为颗粒细胞和无颗粒细胞。利用流式细胞仪通过测试前向角散射光(FSC)和侧向角散射光(SSC)两个参数,分别代表细胞的大小和细胞的颗粒度,绘制双参数(SSC×FSC)散点图和等高图,得出刺参体腔细胞可以分为颗粒细胞和无颗粒细胞两大群,其中无颗粒细胞是主要细胞类群,占体腔细胞总数的65%,而颗粒细胞占31%。采用流式细胞仪研究了刺参体腔细胞死亡率与温度的关系。结果表明,在0~20 ℃下海参体腔细胞死亡率变化不大,在高温条件下(20~30 ℃),细胞破裂解体速度加快,细胞存活时间较短。
刺参;体腔细胞;分类;温度;死亡率
0 引 言
刺参(Apostichopusjaponicus)是温带区海参主要种类,是一种自降解能力极强的海洋生物,在受到光照、温度等刺激后,经过表皮破坏、吐肠、溶解等过程[1]。水温作为重要的生态因子之一,对海参的生长以及其生理活动等都具有极其重要的作用。大部分棘皮动物如海参、海胆体腔内充满了体腔液,体腔液中悬浮着多种类型与红细胞相似的体腔细胞[2]。在刺参的生长过程中,病原体能够直接进入到海参的体腔中与其接触,其体腔细胞在抵御外来物质中发挥着重要的作用,因此刺参体腔细胞的功能研究一直是海洋无脊椎动物免疫学研究的热点问题。
本研究基于流式细胞检测技术并结合光镜和透射电镜技术对刺参体腔细胞进行分类;同时通过流式细胞仪测定刺参体腔细胞在不同温度下的死亡率,初步探讨了温度对刺参体腔细胞功能的影响,以期探索温度对刺参体腔细胞的免疫特性的影响,为解决刺参养殖水温控制及其保活、保鲜贮运过程中温度调控提供一些参考。
1 材料与方法
1.1 材 料
刺参,产自大连金州周边海域。
流式细胞仪,BD FACSVerseTM;透射电子显微镜,日本电子株式会社;多功能光学显微镜,OLYMPUS 公司。
1.2 试验方法
1.2.1 刺参体腔细胞的光镜观察
取鲜活刺参50 μL体腔液注入培养皿,通过光学显微镜观察刺参体腔细胞,放大1 000倍。
1.2.2 刺参体腔细胞的透射电镜观察
取鲜活刺参体腔液800 μL,2 700 r/min离心5 min,弃去上清液,向沉淀中加2.5%戊二醛,固定,用0.1 mol/L,pH 7.5磷酸缓冲溶液漂洗待测样品。用1%锇酸溶液固定,梯度浓度乙醇对待测样品进行脱水、包埋,超薄切片,铀铅双染观测。
1.2.3 流式细胞仪分析
取鲜活刺参体腔液500 μL经300目滤布过滤,加入上样管。检测前向角散射光(FSC)和侧向角散射光(SSC)。结果用双参数(SSC×FSC)点图和等高图、FSC和SSC单参数直方图表达。每个样本取10 000个细胞。
1.2.4 刺参体腔细胞死亡率试验
取鲜活刺参体腔液,离心后去除上清液,磷酸盐缓冲溶液重悬,经300目滤布过滤后分装于1.5 mL离心管;置于不同温度(0、10、20、30、35、40 ℃),孵育2、4 h,经PI试剂染色,测定死亡率。
2 结果与讨论
2.1 基于光镜观测技术的刺参体腔细胞类型及形态
刺参体腔细胞的形态变化较大,形状不固定,其分类与其采用的观测方法紧密相关,因此,对海参体腔细胞的分类存在多种观点尚未统一。Canicatti[3]最早在海参体内观察发现了3种细胞; 廖玉麟[4]把海参的体腔细胞分为6种细胞。利用光镜观察参考廖玉麟[4]、Eliseikina等[5]的研究结果,本实验将刺参体腔细胞分为4类:球形细胞、变形细胞、淋巴样细胞、纺锤细胞,如图1所示。其中球形细胞与其他细胞区别较大,形态呈球形且内部含有大量的小颗粒,细胞核被胞质中大量的颗粒遮住,大小为6~12 μm;变形细胞形状不定,大小为6~8 μm。细胞核呈球形,活体从细胞外质伸出多个叶状丝状或花瓣状的伪足,胞质内含有一定量的颗粒;淋巴样细胞相对于其他体腔细胞较小,大小为4~5 μm,呈球形或卵圆形,带有1~3个长3~6 μm的丝状伪足;纺锤细胞两端尖,呈纺锤形,大小5~7 μm,细胞核圆形,胞质内偶有少量颗粒。

a) 球形细胞

(b) 变形细胞

c) 淋巴样细胞

(d) 纺锤细胞
图1 光镜下不同的刺参体腔细胞
Fig.1 Different coelomocytes from sea cucumberA.japonicasobserved by light microscopy
2.2 基于透射电镜观测技术的刺参体腔细胞类型
利用透射电镜观察刺参体腔细胞有两大类,如图2所示。一类是细胞质内基本没有或有少量颗粒的无颗粒细胞(图2(a));另一类是细胞质内充满较多的颗粒的颗粒细胞(图2(b))。无颗粒细胞的形状不规则,常有各种形状的细胞突起,直径4~6 μm。胞质内含内质网、线粒体、高尔基器和液泡等细胞器,细胞核大。颗粒细胞的直径6~10 μm,胞内充满1.5~3 μm 的颗粒,由高电子密度的微粒组成。颗粒之间的胞质中有少量内质网及高尔基体细胞器,其他细胞器较少。由于细胞的颗粒较多,容易遮掩细胞核,通常难以观察到细胞核。透射电镜观察的是细胞的内部形态,推测可能是淋巴样细胞、纺锤细胞和变形细胞的体积和颗粒度大小相近,在透射电镜下表现为相似的内部形态。参考刘晓云等[6]的研究结合光学显微镜观察结果,球形细胞的大小与其他种类细胞差别较大,且内部存在较多的电子云颗粒,因此将该类细胞归类为颗粒细胞;淋巴样细胞、纺锤细胞和变形细胞归类为无颗粒细胞。

图2 透射电镜下不同的刺参体腔细胞
Fig.2 Different coelomocytes from sea cucumber A. japonicas observed by transmission electron microscopic
2.3 基于流式细胞检测技术的刺参体腔细胞类型
目前有关海参体腔细胞的研究主要集中在形态和分类方面,且多是利用光镜和电镜技术对其进行形态学分类,有其局限性。流式细胞检测技术能够迅速精确地对细胞的大小和颗粒度进行定量定性分析。应用流式细胞术于水生生物的研究中,大部分是研究其细胞的分类[7],且多集中在甲壳类[8]和贝类[9]。孙敬峰等[10]发现虾的血细胞可分为颗粒细胞与透明细胞两个亚群,许秀芹等[11]研究了4种双壳贝类的血细胞也发现类似结果。本实验通过流式细胞仪测定结果发现刺参的体腔细胞明显地分成两个细胞群体,如图3所示,P1细胞群的FSC和SSC信号都较强,表明细胞较大,细胞颗粒度较高,结合透射电镜观察结果归为颗粒细胞;P2细胞群的FSC和SSC信号相对较弱,表明细胞较小,细胞颗粒度较低,结合透射电镜观察结果归为无颗粒细胞。统计分析结果表明,刺参体腔细胞中无颗粒细胞群为主要类型的细胞,所占比例较大,为65%;颗粒细胞所占比例为31%。
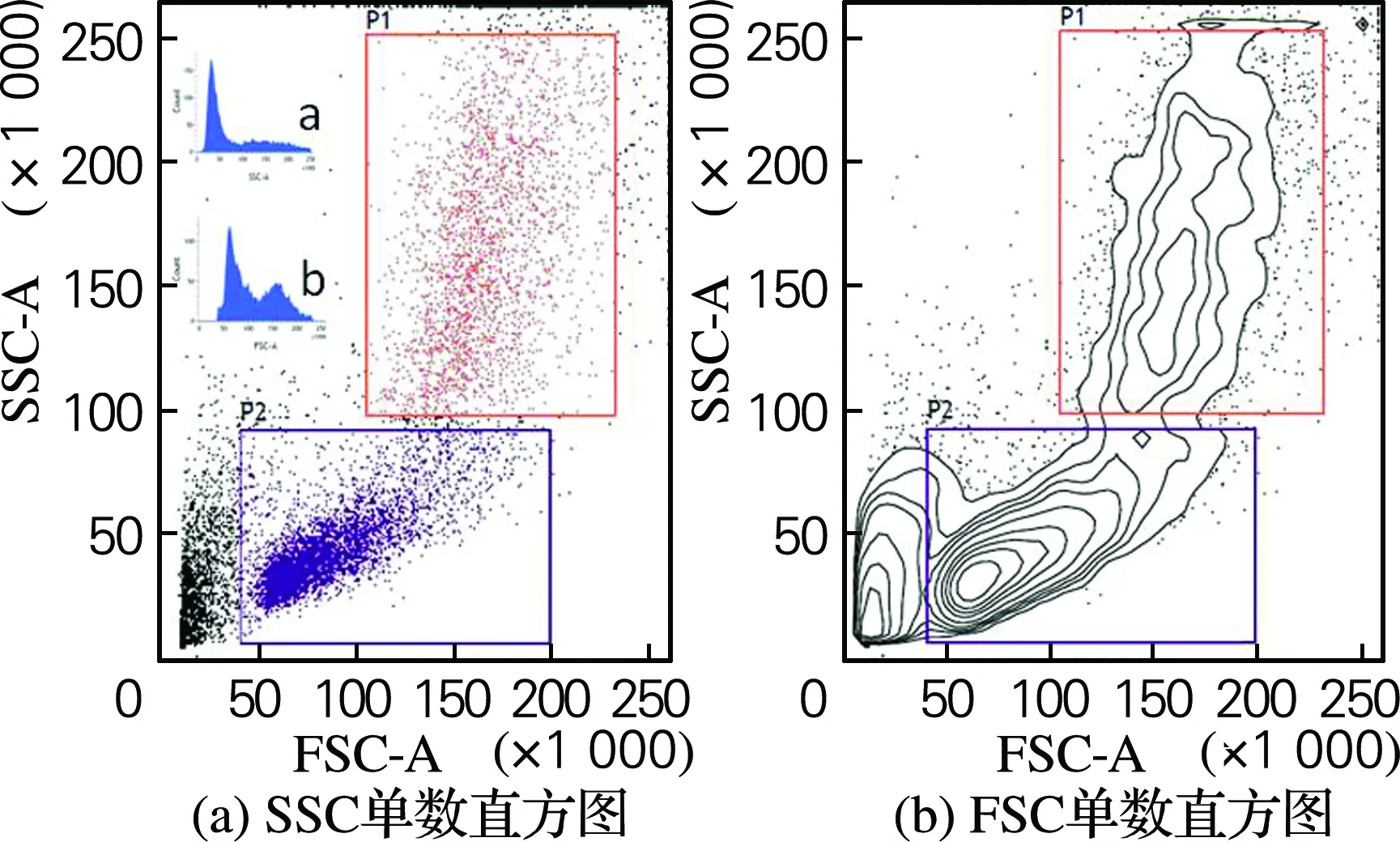
图3 流式细胞仪分析刺参体腔细胞的类群
Fig.3 Population of coelomocytes in sea cucumber A. japonicas by flow cytometric analysis
2.4 温度对刺参体腔细胞死亡率的影响
刺参生长的环境温度过高会抑制其生长,使发病率上升。特别是夏季,水温升高,刺参为适应高温,会进入夏眠状态,停止摄食,体重减轻,自身生长发育缓慢且与生理免疫相关刺参体液的免疫因子也会发生变化[12]。温度作为海参生长过程中最为重要的环境因子,与海参细胞的免疫功能关系密切。
利用流式细胞仪测试温度对体腔细胞死亡率的影响,与传统的台盘蓝染色显微镜人工计数相比,统计速度快、样本量大且结果准确客观。根据PI染剂的激发波长和发射波长选择PE荧光通道,如图4所示。在图4(a)中,左侧的峰为活细胞的吸收峰,右侧为死细胞的吸收峰;在图4(b)中,位于UL象限内的细胞为死细胞,位于LL为活细胞,统计死细胞数量占总细胞数量的百分比为细胞死亡率。
由图5可以看出,刺参体腔细胞的死亡率在不同温度下存在较为明显的差异。在0~20 ℃下孵育2和4h,刺参体腔细胞的死亡率无明显差异(P>0.05);温度为30 ℃时,其死亡率急剧增加(P<0.05),细胞死亡率超过30%。随着孵育时间的延长,体腔细胞的死亡率也明显增加(P<0.05)。结果与文献[13]报道的刺参自然生长温度条件相符。刺参正常生长水温约为0~30 ℃,但是其生长最适温度为15~18 ℃。不适宜的生长水温可能导致刺参体内的自由基代谢紊乱,而自由基在刺参体内大量的沉积,使刺参体内免疫系统的防御功能下降,进而影响刺参的生长及发育。刺参生长的环境温度过高,体腔细胞会发生大面积死亡,使其停止生长,发育延缓,发病率上升。
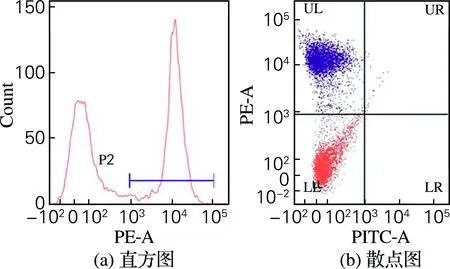
图4 流式细胞仪测定死亡率结果
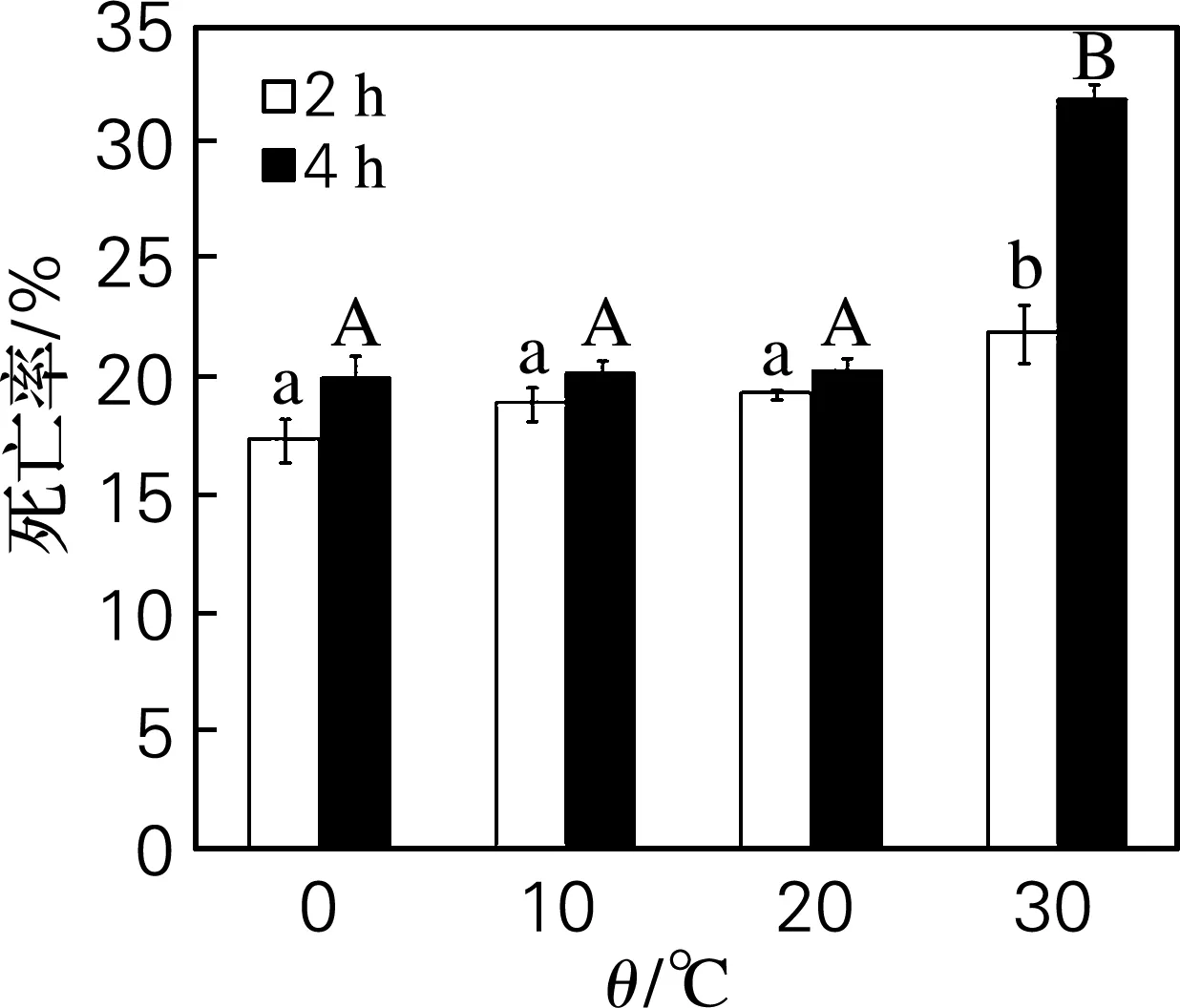
字母表示数据间具有显著性差异(P<0.05)
3 结 论
流式细胞术能快速地分辨刺参体腔液细胞的大小和颗粒性。本实验基于流式细胞术将刺参体腔细胞进行类群分析,结果发现刺参体腔细胞可以明显地分为两大类群,即细胞体积和颗粒度较小的一群为无颗粒细胞(占65%),而细胞体积和颗粒度较大的一群为颗粒细胞(占31%)。
本实验结果证实了刺参体腔细胞的死亡率在不同温度下存在较为明显的差异。在低温条件下(0~20 ℃),刺参体腔细胞的死亡率无明显变化;但当温度升至30 ℃时,其死亡率急剧增加。表明温度对刺参体腔细胞具有较强的免疫应激作用。其原因可归结为:低温条件下,刺参体腔细胞活力较高,免疫防御能力较高,其死亡率较低;在高温条件下,细胞破裂解体速度加快,细胞存活时间较短,高温对刺参体腔细胞产生了应激性刺激。
[1] 姜健,杨宝灵,邰阳.海参资源及其生物活性物质的研究[J].生物技术通讯,2004,15(5):537-540.
[2] 王淑娴,叶海斌,于晓清,等.海参的免疫机制研究[J].安徽农业科学,2012,40(25):12553-12555.
[3]CANICCATTIC,MIGLIETTAA.Arylsulphataseinechinodermimmunocompetentcells[J].HistochemicalJournal, 1989, 21(7): 419-424.
[4] 廖玉麟.中国动物志(一卷)[M].北京:科学出版社,1997.
[5]ELISEIKINAMG,MAGARLAMOYTY.CoelomocytemorphologyintheHolothuriansApostichopus japonicus (Aspidochirota:Stichopodidae)andCucumaria japonica (Dendrochirota:Cucumariidae)[J].RussianJournalofMarineBiology, 2002, 28(3): 197-202.
[6] 刘晓云,谭金山,包振民,等.刺参体腔细胞的超微结构观察[J].电子显微学报,2005,24(6):613-615.
[7]DONAGHYL,KIMBK,HONGHK,etal.FlowcytometrystudiesonthepopulationsandimmuneparametersofthehemocytesoftheSuminoeoyster, Crassostrea ariakensis[J].FishandShellfishImmunology, 2009, 27(2): 296-301.
[8] 徐海圣,徐步进.甲壳动物细胞及体液免疫机理的研究进展[J].大连海洋大学学报,2001,16(1):49-56.
[9] 周永灿,潘金培.贝类细胞和体液的防御机制研究进展[J].水产学报,1997,12(4):449-454.
[10] 孙敬锋,冼健安,张铁军,等.流式细胞术比较研究三种对虾血细胞的分群[J].淡水渔业,2008,38(3):18-22.
[11] 许秀芹,王宜艳,孙虎山.流式细胞术比较研究4种双壳贝类血细胞的分群[J].海洋湖沼通报,2006(1):46-50.
[12] 陈勇,高峰,刘国山,等.温度、盐度和光照周期对刺身生长及行为的影响[J].水产学报,2007(5):687-691.[13] WANG F Y, YANG H S, GAO F, et al. Effects of acute temperature or salinity stress on the immune response in sea cucumberApostichopusjaponicus[J]. Comparative Biochemistry and Physiology, 2008, 151(4): 491-498.
徐涛,董天飞,陈明,范胜男,史超.海洋真菌Schizochytriumsp.DP-16发酵产DHA油脂过程的优化[J].大连工业大学学报,2016,35(6):411-415.
Analysis on categories of coelomocytes in sea cucumberApostichopusjaponicusand its mortality with relation to temperature
CHEN Tingjia1, TIAN Jingyu1, DING Yue1, SUI Lingyun1, SONG Liang1,2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China; 2.National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034, China )
The types of coelomocytes in Apostichopus japonicas were determined by light microscopy and transmission electron microscopy, and the subsets of coelomocytes were analyzed by flow cytometry. Coelomocytes could be divided into spherical cell, amoebocytes, lymphoid cell and spindle cell according to the morphology under light microscopy; besides, the coelomocytes could be identified as granulosa cell and agranulocytes based on the cellular structure under the transmission electron microscopy. The population of coelomocytes in sea cucumber Apostichopus japonicas was further analyzed by flow cytometry. Two parameters of light-scatter were set up such as light-scatter (FSC) and side light-scatter (SSC). The analysis results were expressed as the dot and the contour plots of two parameters (FSC & SSC), the single parameter (FSC & SSC) histogram of coelomocytes for Apostichopus japonicas. Apostichopus japonicas coelomocytes were divided into two populations of granulocytes and agranulocytes by flow cytometry, and agranulocytes were major population accounting for 65% whereas granulocytes accounted for 31%. The relationship between mortality of coelomocytes and temperature was invested based on flow cytometry analysis. Results showed that the mortality of sea cucumber coelomocyte did not change significantly at low temperature range (0-20 ℃), while higher temperature (20-30 ℃) accelerated cell rupture sharply, leading to the shorter cell survival duration.
Apostichopusjaponicas; coelomocytes; classification; temperature; mortality
2015-09-30.
国家自然科学基金青年科学基金资助项目(31401562);辽宁省农业领域青年科技创新人才培养计划项目(2015002);辽宁省教育厅科学研究一般项目(L2014220).
陈庭家(1989-),男,硕士研究生;通信作者:宋 亮(1980-),男,讲师.
TS254.9
A
1674-1404(2016)06-0407-04
CHEN Tingjia, TIAN Jingyu, DING Yue, Sui Lingyun, SONG Liang. Analysis on categories of coelomocytes in sea cucumberApostichopusjaponicusand its mortality with relation to temperature[J]. Journal of Dalian Polytechnic University, 2016, 35(6): 407-410.

