秦巴山区石斛属亲缘关系及金钗石斛遗传多样性ISSR分析
江爱明,曹 俊,蔡高磊
(1 汉江师范学院 生物化学与环境工程系,湖北十堰 442000;2 十堰市农业科学院,湖北十堰 442000)
秦巴山区石斛属亲缘关系及金钗石斛遗传多样性ISSR分析
江爱明1,曹 俊1,蔡高磊2*
(1 汉江师范学院 生物化学与环境工程系,湖北十堰 442000;2 十堰市农业科学院,湖北十堰 442000)
为研究秦巴山区石斛属亲缘关系,利用5条ISSR引物对秦巴地区石斛属植物12个居群的遗传多样性进行了初步探讨。结果表明:(1)UPGMA聚类分析结果显示,金钗石斛(DendrobiumnobileLindl)、曲茎石斛(D.flexicauleZ. H. Tsi)和细叶石斛(D.hancockiiRolfe)分别聚为三支,在分子水平上出现了明显的分化,揭示三者是独立物种。(2)金钗石斛种下6个居群可明显分为2支,LJ、MT、YP和WF遗传一致度较近聚为一支;YJ和PT遗传高度一致,遗传距离最近聚在一起。(3)金钗石斛种下居群间Nei’s总基因多样性(Ht)为0.388,基因分化系数(Gst)为0.934,显示金钗石斛居群间存在较高的遗传分化。研究结果揭示了秦巴山区石斛属植物的亲缘关系,从分子水平上为其鉴定提供了依据,并为金钗石斛的资源利用和遗传改良奠定理论基础。
金钗石斛;ISSR;遗传多样性
石斛属(DendrobiumSw.)植物多为附生植物,约1 000种,广泛分布于亚洲热带和亚热带地区至大洋洲。中国有74种和2变种,主要分布在秦岭以南诸省区。国内种类中具细茎而花小的类群,如细茎石斛、铁皮石斛、梳唇石斛、美花石斛、钩状石斛、霍山石斛和金钗石斛等,这其中以金钗石斛(DendrobiumnobileLindl)尤为珍贵[2],以秦巴山区产量较多,质量最好[3]。因其含有石斛碱及多糖类物质,具有较高的药用价值而名列“中华九大仙草”之首[4]。由于近年来过度开采、生态环境破坏及自身生长缓慢等原因,野生金钗石解愈来愈少。近几年研究人员主要进行野生金钗石斛资源的保护,但是对该地区金钗石斛遗传多样性研究还很欠缺。
ISSR(inter-simple sequence repeat,简单重复序列间扩增)是由Zietkiewicz[5]等于1994年创建的一种基于聚合酶链式反应(PCR)的新型分子标记,该技术具有DNA用量小、成本低、重复性好、操作简便等特点,而被广泛应用于品种鉴定、遗传关系及遗传多样性、基因标记、指纹图谱的建立等多方面的研究[6-7]。马佳梅等[8]建立并优化了流苏石斛ISSR反应体系;卢家仕等[9]采用ISSR技术对云南及广西地区石斛属亲缘关系进行了研究,将24份不同产地石斛样品划分为 6个类群,揭示了居群间丰富的遗传多样性,为石斛属亲缘关系的鉴定提供了依据。本研究采用ISSR标记,对秦巴山区不同海拔、不同地点12个居群的石斛属进行基因组多态性研究,分析石斛样品的遗传多样性和亲缘关系,为更好地保护和利用本地区的石斛资源提供理论依据。
1 材料和方法
1.1 材 料
实验材料12个居群,共计514个个体,其中金钗石斛、曲茎石斛(图1)和细叶石斛的居群数分别为6、4、2个。各居群的样地信息和采样个体数见表1,居群采样时,每个个体间隔50 m以上,并将野外采集的个体引种栽培于实验室备用。
1.2 ISSR标记
称取新鲜石斛叶片5 g于研钵中液氮研磨,采用MiniBEST Plant Genomic DNA Extraction Kit(TaKaRa公司提供)提取基因组DNA,最后加入100μL×1TAE Buffer(pH8.0)溶解DNA。用紫外分光光度计检测DNA样品的浓度和纯度,-20℃下贮存备用。根据哥伦比亚大学(UBC)公布的引物序列,从中筛选出稳定性好,重复性强且条带清晰的引物作为本次实验引物,引物编号及序列见表2。
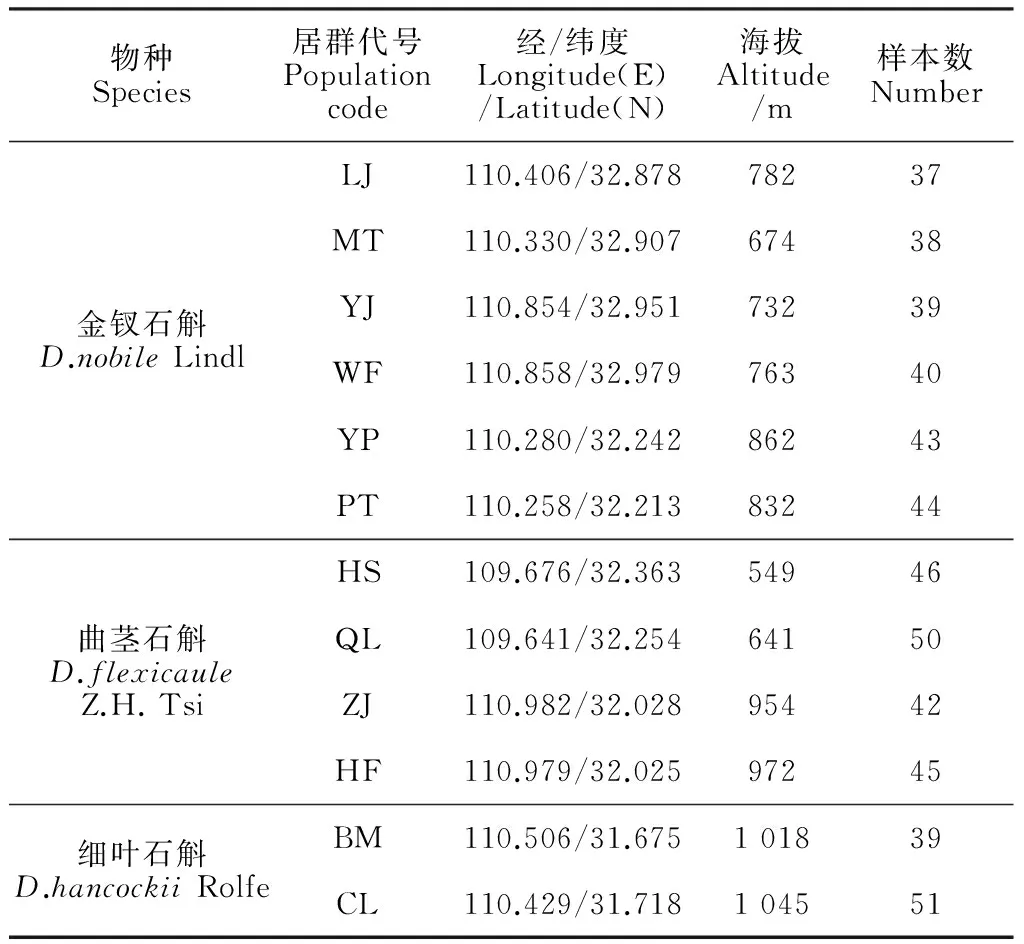
表1 石斛属采样基本数据

图1 石斛属植物形态Fig.1 The morphology of Dendrobium
从每个居群选取4个个体进行预实验,最终确定PCR扩增反应体系总体积为25 μL:包含1 μL Tks Gflex DNA Polymerase(TaKaRa公司提供),12 μL 2×Gflex Buffer(TaKaRa公司提供),1 μL基因组DNA,1 μL SSR引物,10 μL ddH2O。反应条件:94 ℃预变性5 min; 94 ℃变性45 s,53 ℃~57 ℃(视引物Tm而定)退火45 s,72 ℃延伸1 min,共30个循环;72 ℃延伸7 min,最后4 ℃保存。用含有Gold view的1.5%琼脂糖凝胶于120 V恒压电泳45 min。最后在凝胶成像系统(北京六一WD-9413B)上进行拍照并保存,用于后续分析。
1.3 数据统计与分析
当三喜突然扑出将那只呆头呆脑的肥大野兔死死摁住的时候,他心里兴奋的不是如何将它做成清蒸、红烧或者烹炒的种种兔肉,与全家人一番大快朵颐,而是心里迅速就坚定了一个信念:我必须用枪来把它射杀,对,就是用枪,而不是其它的任何一种方式,以此给全村人一个说法:我三喜不但会打枪,而且枪法相当相当的准。不是说眼见为实吗,那你们就好好看看吧,这,就是我三喜打死的兔子!
ISSR作为显性分子标记视每一个多态位点为一个等位基因。在同一相对迁移位置出现清晰条带的计为1,没有或模糊的条带记为0,将条带数据信息构建成0和1的原始数据矩阵。使用POPGENE1.32软件分析遗传变异的各项参数:Nei’s基因多样度指数(H)、平均每个位点上的观察等位基因数(Na)、平均每个位点的有效等位基因(Ne)、Shannon多样性信息指数(I)、居群间遗传分化系数(Gst)、居群内基因多样度(Hs)、总的基因多样度(Ht)、基因流(Nm)等。利用NTSYS2.1软件计算供试材料之间的遗传距离,采用非加权类平均法(UPGMA)对遗传距离进行聚类分析。
2 结果与分析
2.1 基因组DNA纯度检测
用TaKaRa 9770A试剂盒提取12份石斛基因组DNA后,经1% Agarose 电泳检测,结果显示:12个泳道都出现一条清晰的DNA条带,无拖尾现象,表明蛋白质和 RNA的含量极少(图2)。用紫外分光光度法检测所有DNA的OD260/OD280值,均在1.85~1.98,质量浓度在 350~360 ng/μL。以上结果表明提取的DNA纯度较高,质量浓度均匀,符合PCR模板的要求。
2.2 ISSR结果分析
图3为引物UBC 900对12个石斛属材料的PCR扩增产物琼脂糖凝胶电泳图谱。其它引物都达到很好的扩增效果,表明选定的反应体系和PCR扩增程序效果较好,扩增产物可用于下一步的数据分析。
用ISSR引物UBC840、UBC 841、UBC 842、UBC 899、UBC 900对全部石斛属样本进行扩增检测,扩增条带清晰,如图3中引物UBC 900对样品扩增结果所示。表2分析表明,5条引物扩增共检测到80个清晰的条带,每条引物平均扩增出16个片段。采用POPGENE1.32软件进行分析,5条引物在12个石斛属居群中扩增的遗传多样性参数(表3)显示:共检测到13个等位基因,观测的等位基因数(Na)3.4~8.2,平均等位基因数为5.38。有效等位基因(Ne)1.633~1.982,平均值为1.852。Nei’s基因多样度指数(H)0.388~0.495,平均值为0.457。Shannon多样性信息指数(I)0.576~0.689,平均值为0.649,表明5条引物扩展产物均具有多态性,可用于石斛属各居群的遗传多样性分析。

M.DL2000;1.LJ;2.MT;3.YJ;4.WF;5.YP;6.PT;7.HS;8.QL;9.ZJ;10.HF;11.BM;12.CL;居群编号同表1;图3同图2 提取石斛DNA电泳图M.DL2000;1.LJ;2.MT;3.YJ;4.Wsame as Table 1;The same as Fig.3Fig.2 DNA electrophoresis of Dendrobium Sw extracted with kit

图3 引物UBC900对样品的扩增结果Fig.3 ISSR bands of Dendrobium Sw amplified with primer UBC900

表2 ISSR引物序列及其PCR扩增的多态性
Note:Y=C/T

表3 石斛居群遗传多样性

表4 石斛属居群多样性Nei’s分析
2.3 石斛居群遗传分化分析
石斛属居群多样性Nei’s分析(表4)显示,金钗石斛6个居群Ht为0.388,Hs为0.158,Gst为0.934,即93.4%的变异存在于居群之间,6.6%的变异存在于居群内,结果显示居群间的遗传分化大于居群内的分化。居群间的基因流(Nm)为0.214,表明居群之间的基因流水平较低。曲茎石斛4个居群Ht为0.254,Hs为0.083,Gst为0.772,居群间的基因流(Nm)为0.136,说明遗传变异主要来自于居群间。细叶石斛2个居群Ht为0.171,Hs为0.111,Gst为0.533,居群间的基因流(Nm)为0.214。物种间Nm为0.035,表明物种之间的基因交流几乎不发生。
2.4 石斛属聚类分析
采用POPGENE1.32软件分析得出,石斛属12个居群两两间的Nei’遗传一致度(Hi)范围为0.593 3~0.911 8,遗传距离(D)为0.092 3~0.522 0(表5)。YJ与PT居群间遗传一致度最高(Hi=0.911 8),遗传距离最近(D=0.092 3);通过NTSYSpc-2.1聚类分析软件构建各居群间亲缘关系系统树,并计算表5金钗石斛居群间遗传相似系数(Gs)(图4)。各材料间UPGMA聚类结果显示,Gs范围0.36~0.88,平均值为0.62。Gs最低值存在于细叶石斛和金钗石斛之间为0.36,这表明其亲缘关系最远;最高值0.88为金钗石斛YJ和PT居群之间,说明其亲缘关系最近。金钗石斛6个居群按照遗传距离远近以及遗传一致度高低聚为2个大支。其中YJ和PT遗传高度一致,遗传距离最近,首先聚在一起为CladeⅡ;LJ、MT、YP和WF遗传一致度与地理距离较近聚为CladeⅠ。通过聚类分析也表明,细叶石斛与曲茎石斛先聚为一支,二者亲缘关系较近;金钗石斛单独聚为一支,与曲茎石斛、细叶石斛亲缘关系较远。

表5 石斛属各个居群间的Nei’s遗传一致度(对角线上方)和遗传距离(对角线下方)

图4 石斛属UPGMA聚类图Fig.4 UPGMA dendrogram of the genetic relationship of Dendrobium Sw
3 讨 论
3.1 秦巴山区石斛属遗传多样性与种间亲缘关系
遗传多样性是生物多样性的重要组成部分,一个居群遗传多样性越高或遗传变异越丰富,表明其对环境变化的适应能力就越强。因此对遗传多样性的研究可以揭示物种或居群的进化历史,也能为进一步分析其进化潜力和未来的命运提供重要的资料,尤其有助于物种稀有或濒危原因及过程的探讨。秦巴山区地处中国北亚热带向暖温带过渡地带并对中国植物区系的演化与分化研究具有重要意义,该区域地貌类型丰富、气候温暖湿润,是中国生物多样性分布的中心地区之一[10]。本研究中,通过 ISSR标记显示金钗石斛(D.nobileLindl)、曲茎石斛(D.flexicauleZ.H.Tsi)具有较高的遗传多样性。金钗石斛6个居群聚为2个大支,且CladeⅠ和CladeⅡ的遗传分化明显。曲茎石斛4个居群也聚为2类,但是HS居群和金钗石斛CladeⅡ的遗传距离较近,究其原因可能是种群间还存在一定程度的基因流,针对石斛属植物的特点而言,花粉的扩散可能是植物基因流主要形式。这一发现说明,居群内和居群间存在基因交流,秦巴山区石斛属品种遗传多样性丰富,也为今后研究秦巴山区石斛属种质资源进化发展提供依据。
3.2 秦巴山区金钗石斛遗传多样性及居群间遗传分化
根据ISSR分析结果显示,金钗石斛种下居群间Nei’s总基因多样性(Ht)为0.388,基因分化系数Gst为0.934,这说明金钗石斛居群间存在较高的遗传分化。这一较高的遗传多样性一方面可能与秦巴山区复杂的地质地貌有较大关联[11-13]。山地的温度、湿度、光照和土壤等环境因子较复杂,生活环境多变,可能会使物种的分布展现出较高的遗传多样性。这种现象在秦巴山区药用植物群落物种多样性的研究中也有发现[14]。另一方面,长期的地理隔离导致各居群间适应不同的环境,从而产生较大的遗传变异,从NTSYSpc-2.1聚类分析来看CladeⅠ和CladeⅡ正好处在秦岭山脉的两侧,居群间基因之间正常的交流可能被山脉所阻断,基因流(Nm)较小为(0.214)也验证了这一假设。
3.3 金钗石斛可持续利用与保护策略
金钗石斛是中国传统的名贵中药,在“神农本草经”中列为上品。现代医学和中医药理研究表明,石斛在提高人体免疫能力、抗衰老、抑制肿瘤、补五脏虚劳等方面有明显的效果,具有很高的药用价值[15]。同时它还含有丰富的蛋白质和氨基酸,并含有丰富的Ca、Mg、P等无机元素,具有较高的营养价值[16-17]。秦巴山区是金钗石斛主要分布区之一,存在大量保存良好的野生资源。近年来,由于环境的破坏和人为掠夺性采挖,导致野生金钗石斛数量急剧下降。本研究通过石斛属形态、经纬度及海拔生长特性结合ISSR分子标记,把同名异种、同种异名或不同地方来源的品种资源进行客观的种质鉴定,弄清它们之间的遗传变化及亲缘关系,从而更好地指导科研和实践生产工作,更好地开发、利用和保护秦巴山区石斛属植物种质资源。通过聚类分析显示,金钗石斛6个居群可明显分为2支,居群间93.4%变异,居群内6.6%变异,居群间变异远大于居群内,说明具有很高的遗传分化。通过野外实地调查发现,金钗石斛各居群所处生境有很大不同。LJ、MT和YP居群位于自然保护区内,居群生境破坏较少,但也遭到了人们过度的采挖。WF、YJ和PT居群多位于非自然保护区,处于荒山野岭,人类开垦、砍伐等因素干扰较明显,导致这些居群的数量锐减,因此,对有巨大药用价值的金钗石斛野生资源以及遗传多样性的保护意义重大。对现存金钗石斛居群应该采取一些有效的保护措施,针对LJ、MT和YP居群,其生境破坏较少,应主要采取就地保护,禁止人们过度采挖措施;针对WF、YJ和PT居群,应采取保护居群的生存环境的措施,同时在一些具有优良种质库的地区进行育种繁殖,增加居群的数量。
[1] 任志远,李 晶.陕南秦巴山区植被生态功能的价值测评[J].地理学报,2003,58(4):503-511.
REN Z Y,LI J.The valuation of ecological services from the vegetation ecosystems in the Qinling-Daba mountains[J].ActaGeographicaSinica,2003,58(4):503-511.
[2] 郎楷永,陈心启,吉占和.中国植物志(17~19卷)[M].北京:科学出版社,1999.
[3] 刘 霞,胡志刚,杜 巍,等.神农架中药资源保护现状与可持续利用策略[J].世界科学技术-中医药现代化,2014,16(11):2 331-2 335.
LIU X,HU Z G,DU W,etal.Conservation status of Shennongjia traditional Chinese medicine resource and its sustainable utilization strategy [J].WordScienceandTechnology/ModernizationofTraditionalChineseMedicineandMateriaMedica,2014,16(11):2 331-2 335.
[4] 陆礼和,杜艳妮,张 艳,等.金钗石斛营养成分分析研究[J].云南师范大学学报(自然科学版),2013,33(1):60-63.
LU L H,DU Y N,ZHANG Y,etal.Analysis of nutrients inDendrobiumnobileLindl[J].JournalofYunnanNormalUniversity(Nat.Sci.),2013,33(1):60-63.
[5] ZIEKIENLCZ E,RAFASHL A,LABUDA D.Genome fingerprinting by simple sequence repeats (SSR) anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[6] 杨 梅,周颂东,何兴金,等.中国假百合属亲缘关系及假百合遗传多样性的ISSR分析[J].西北植物学报,2016,36(3):449-457.
YANG M,ZHOU S D,HE X J,etal.Genetic relationships ofNotholirionand genetic diversity ofN.bulbuliferumin China revealed by ISSR markers[J].ActaBotanicaBoreali-OccidentaliaSinica,2016,36(3):449-457.
[7] 刘洪博,范源洪,陆 鑫,等.29份云南甘蔗创新种质的ISSR遗传多样性分析和指纹图谱构建[J].西北植物学报,2015,35(12):2 414-2 421.
LIU H B,FAN Y H,LU X,etal.Genetic diversity and construction of fingerprint of 29 Yunnan germplasms of sugarcane innovation by SSR[J].ActaBotanicaBoreali-OccidentaliaSinica,2015,35(12):2 414-2 421.
[8] 马佳梅,殷寿华.流苏石斛ISSR - PCR 反应体系的优化[J].云南大学学报(自然科学版),2008,30 (S1):406-410.
MA J M,YIN S H.Optimization of ISSR-PCR reaction system inDendrobiumfimbriatumHook[J].JournalofYunnanUniversity(Natural Science),2008,30 (S1):406-410.
[9] 卢家仕,卜朝阳,吕维莉,等.不同产地石斛属种质资源的ISSR遗传多样性分析[J].中草药,2013,44(1):96-100.
LU J S,BU C Y,LU W L,etal.ISSR analysis on genetic diversity of germplasms resources inDendrobiumSW from different habitats[J].ChineseTraditionalandHerbalDrugs,2013,44(1):96-100.
[10] 江爱明,曹 婷.秦巴山区及毗邻地区野生金钗石斛组织培养与快速繁殖[J].华中师范大学学报(自然科学版),2016,50(3):417-422.
JIANG A M,CAO T.Tissue culture and rapid propagation of wildDendrobiumnobilein Qinba Mountain and its adjacent areas[J].JournalofCentralChinaNormalUniversity(Nat.Sci.),2016,50(3):417-422.
[11] YAN W J,DING X Y.Isolation and characterization of 10 microsatellite markers forDendrobiumnobile.,a traditional Chinese tonic medicine[J].ConservationGeneticsResources,2015,7(1):303-304.
[12] PAROMIKB,SUMANK.Molecular characterization ofDendrobiumnobileLindl., an endangered medicinal orchid,based on randomly amplified polymorphic DNA[J].PlantSystematicsandEvolution,2015,301(1):201-210.
[13] LU S,DING X Y.Confirming the genetic identity ofDendrobiumfimbriatumusing an amplification refractory mutation system (ARMS)[J].PlantMolecularBiologyReporter,2010,28(4):712-716.
[14] 乔亚玲,刘政鸿,郝文芳,等.陕南秦巴山区药用植物群落物种多样性研究[J].植物科学学报,2016,34(2):200-210.
QIAO Y L,LIU Z H,HAO W F,etal.Species diversity of the medicinal plant community in the Qin-Ba Mountainous area of southern Shaanxi[J].PlantScienceJournal,2016,34(2):200-210.
[15] 包英华,白 音,田新波.束花石斛种质资源的ISSR分析[J].广西植物,2008,28(4):447-450.
BAO Y H,BAI Y,TIAN X B.Studies on germplasm resources ofDendrobiumchrysanthumusing ISSR marker[J].Guihaia,2008,28(4):447-450.
[16] DING G,DING X Y,SHEN J.Genetic diversity and molecular authentication of wild populations ofDendrobiumofficinaleby RAPD[J].ActaPhamSic,2005,40(11):1 028-1 032.
[17] 江金兰,叶 炜,李永清,等.福建泰宁野生铁皮石斛种群的 ISSR 亲缘关系分析[J].热带亚热带植物学报,2016,24(3):259-266.
JIANG J L,YE W,LI Y Q,etal.Genetic relationships among wildDendrobiumofficinalepopulations in Taining,Fujian by ISSR[J].JournalofTropicalandSubtropicalBotany,2016,24(3):259-266.
(编辑:宋亚珍)
Genetic Relationship of Dendrobium and Genetic Diversity of Dendrobium nobile in Qinling-Daba Mountains Revealed by ISSR
JIANG Aiming1,CAO Jun1,CAI Gaolei2*
(1 Faculty of Biochemistry and Environmental Engineering,Hanjiang Normal University, Shiyan,Huibei 442000, China;2 Shiyan Academy of Agricultural Science, Shiyan,Huibei 442000, China)
To understand the genetic relationship ofDendrobiumin Qinba,the genetic diversity of 12 populations was analyzed using five inter-simple sequence repeat(ISSR) markers.(1) The UPGMA analysis exhibited significant genetic differentiation amongD.nobileLindl,D.flexicauleZ. H. Tsi andD.hancockiiRolfe,which revealed that they are independent species.(2) Six populations ofD.nobilewere obviously divided into two branches,the populations of LJ, MT, YP and WF are classified as Clade I because of the close genetic consistency among them;the populations of YJ and PT are classified as CladeⅡdue to the highest degree of genetic consistency and genetic distance. (3) The Nei’s gene diversity (Ht) and coefficient of gene differentiation (Gst) ofD.nobilewere 0.388 and 0.934, respectively, which indicated that there were high diversity and gene differentiation among the populations ofD.nobile.Our findings clearly evidenced the genetic diversity ofD.nobilein different areas of Qinba, which will be used in identification and intellectual property protection.
Dendrobiumnobile;inter-simple sequence repeat(ISSR);genetic diversity
1000-4025(2016)10-1977-07
10.7606/j.issn.1000-4025.2016.10.1977
2016-04-10;修改稿收到日期:2016-10-08
湖北省教育厅(Q20156001)
江爱明(1982-),男,硕士,讲师,主要从事药用植物育种研究。E-mail:jiangaiming2003@126.com
*通信作者:蔡高磊,硕士,农艺师,主要从事植物遗传育种研究。E-mail:caigaolei@163.com
Q346+.5; Q789
A

