盐度、pH对文蛤肌肉、鳃、外套膜HSP70基因表达的影响
杨杰青,沈新强,蒋 玫,李 磊,徐夏芳,董 冉
( 1. 中国水产科学研究院 东海水产研究所,上海 200090; 2. 上海海洋大学 海洋科学学院,上海 201306; 3. 国家海洋局 宁波海洋环境监测中心站,浙江 宁波 315012 )
盐度、pH对文蛤肌肉、鳃、外套膜HSP70基因表达的影响
杨杰青1,2,沈新强1,蒋 玫1,李 磊1,徐夏芳3,董 冉1,2
( 1. 中国水产科学研究院 东海水产研究所,上海 200090; 2. 上海海洋大学 海洋科学学院,上海 201306; 3. 国家海洋局 宁波海洋环境监测中心站,浙江 宁波 315012 )
为探讨池塘养殖文蛤的适宜盐度和pH范围,以β-actin为内参基因,采用实时荧光定量聚合酶链式反应技术,检测不同盐度(16、18、20、22、24)和pH(6.7、7.7、8.7、9.7、10.7)梯度下文蛤肌肉、鳃、外套膜中HSP70基因mRNA的表达水平。结果显示,盐度16、18、22、24处理组肌肉中HSP70基因的表达量显著高于盐度20的对照组(P<0.05);除盐度18组鳃和盐度24组外套膜HSP70基因的表达量与对照组差异不显著外(P>0.05),16、18、22、24盐度组鳃和外套膜中HSP70基因的表达量均显著高于对照组(P<0.05)。pH 6.7、7.7、9.7、10.7处理组肌肉、鳃、外套膜中HSP70基因的表达量与pH为8.7的对照组差异显著(P<0.05)。试验结果表明,超出一定盐度、pH范围,可显著诱导文蛤肌肉、鳃、外套膜中HSP70基因的过量表达,研究结果可为池塘文蛤的健康养殖提供参考。
文蛤;环境因子;肌肉;鳃;外套膜;HSP70
文蛤(Meretrixmeretrix)隶属于真瓣鳃目、帘蛤科、文蛤属,是我国沿海地区经济价值较高的一种贝类[1-2]。其生长受环境因子变化影响较为显著[3-4],盐度、pH等作为决定滤食性贝类生存与分布的主要环境因子[5],对池塘文蛤的健康养殖尤为重要,但受自然或人为活动影响,其波动也较为明显,如连续暴雨天气、池塘自身消毒投放过多的漂白粉、繁殖饵料生物以及养殖过程中不合理的投放药物等。养殖过程中合理控制环境因子变化范围,有利于文蛤快速生长。
热休克蛋白(Heat Shock Proteins,HSPs)又称热应激蛋白,广泛存在于从低等原核生物到高等哺乳动物细胞内且含量丰富的多肽类蛋白家族[6-8],是细胞或生物体受外界环境因子(高温、毒素、缺氧、重金属、有机物污染等)刺激后,产生的一类具有高度保守性和应激性并由热休克基因所编码的伴随性细胞蛋白[9-12]。HSP70是热休克蛋白家族中最保守、最重要、细胞内含量最丰富的一种,它能够使细胞或生物体从各种应激状态下自我恢复,改善细胞的生存能力和提高对环境胁迫的耐受性[13],因此通过检测生物体内HSP70基因的表达情况便可预知其生长环境的适宜程度。作为“分子伴侣”其在蛋白质的折叠、组装、转运、降解及调控中发挥重要作用,而且它在细胞周期调控、抗凋亡、抗氧化、免疫治疗等方面也具有重要功能[6,10,14-15],HSP70是国内外学者研究的热点。
迄今,关于环境因子胁迫对虾类[16-18]、蟹类[19]、贝类[20-22]、鱼类[23]等水生生物的HSP70基因表达已有诸多报道,盐度能够影响马氏珠母贝(Pinctadamartensii)外套膜HSP70基因的过量表达[24];高盐度刺激可致合浦珠母贝(P.fucata)肌肉、鳃、外套膜等组织内HSP70基因的表达量明显增加[25]; pH可以引起脊尾白虾(Exopalaemoncarinicauda)肝胰腺和肌肉中HSP70基因的高表达[16]。研究涉及的贝类虽多,但至今尚未见有关盐度和pH变化对文蛤HSP70基因表达的研究。研究盐度、pH的变化对文蛤HSP70基因表达的影响在阐明热休克蛋白调控机理及文蛤的实际生产应用中具有重要指导意义。
本研究采用室内试验的形式,利用实时荧光定量聚合酶链式反应对不同盐度、pH梯度下文蛤肌肉、鳃、外套膜中HSP70基因表达量进行测定,旨在了解盐度、pH的波动变化对文蛤肌肉、鳃、外套膜中HSP70基因表达量的影响,研究可为池塘养殖文蛤健康的生长提供参考数据。
1 材料与方法
1.1 材料来源及驯养
试验所用文蛤取自江苏启东外海滩涂,选择个体规格相近、外表完好、有活力的文蛤100枚,平均壳长(3.0±0.7) cm、平均壳宽(3.0±0.5) cm、全质量(8.00±1.70) g、鲜肉质量(3.50±1.00) g。试验前驯养7 d,所用海水为经沙滤后的天然海水,海水pH 8.7,盐度20,温度18~19 ℃,全量日换水一次,并投喂小球藻(Chlorellavulgaris)。
1.2 试验方法
1.2.1 盐度试验
针对池塘养殖过程中,可能出现的连续雨水天气导致盐度偏低的突发状况,同时依据相关研究结果[26-27],设置5个盐度试验梯度,依次为16、18、20、22、24,各盐度分3个平行组,对照组盐度为20,试验于2 L烧杯内进行,盐度配比采用经曝气的自来水和粗盐调节天然海水得到所需的盐度值,每日盐度升降不超过1,试验溶液pH8.7,温度为18~19 ℃,自然光照。试验开始2 h后,分别采集2枚文蛤的肌肉、鳃、外套膜组织加RNA保存液固定并迅速保存于-20 ℃冰箱,以备HSP70表达量的检测。
1.2.2 pH试验
针对池塘养殖过程中,繁殖饵料生物和底质消毒投放大量化肥和漂白粉导致pH波动较大的突发状况,同时依据相关研究结果[26,28],设置5个梯度的pH试验组,依次为6.7、7.7、8.7、9.7、10.7,各pH梯度分3个平行组,对照组pH为8.7,试验于2 L烧杯内分别采用1 mol/L NaOH和1 mol/L HCl调节过滤天然海水的pH值,并用pH计(HANNA HI98127型)进行校准。各梯度pH变化幅度为±0.2,每日pH升降不超过1,保持各试验溶液盐度为20,其他试验条件和试验步骤同上述盐度试验组。
1.2.3 HSP70基因表达水平的检测
1.2.3.1 引物的设计
β-actin在细胞中表达量相对恒定,受外界的刺激影响很小[29],因此以β-actin为内参基因。根据试验自文蛤肌肉、鳃、外套膜克隆分别获得HSP70基因序列以及β-actin基因。并按照实时荧光定量聚合酶链式反应引物设计要求获取文蛤HSP70基因cDNA序列实际荧光定量检测引物(表1)。

表1 荧光定量PCR分析基因表达所用的引物
1.2.3.2 总RNA的提取
按Trizol操作说明书提取RNA,1.5%琼脂糖凝胶电泳检测RNA的质量与完整性。用核酸蛋白测定仪测定RNA样品的浓度和纯度。
1.2.3.3 实时荧光定量聚合酶链式反应检测HSP70基因表达
以提取的文蛤总RNA为模板,依据反转录试剂盒PrimeScriptTMRT reagent Kit(Perfect Real Time)的说明合成cDNA。SYBR Green Ⅰ燃料法对目的基因进行相对定量,反应体系为20 μL:2×PowerSYBRRGreen PCR MasterMix(Applied Bio-system)10 μL,10 μmol/L上下引物各加1 μL,模板为0.5 ng的总RNA逆转录所得的cDNA 2 μL,用灭菌双蒸水定量至20 μL。每个时间点各处理组分别做3~4个平行样,每个样品再分别平行做3个重复。以总cDNA为模板,用β-action、HSP70基因引物和Taq DNA聚合酶进行PCR反应。Real-timePCR反应条件为94 ℃ 3 min,40个循环:94 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s。反应结束后对该反应体系做溶解曲线,分析聚合酶链式反应产物的特异性。所用仪器为ABI 7500型荧光定量PCR仪(美国ABI公司)。基于2-ΔΔCT原理[30]进行目的基因相对表达量的分析。
1.3 试验数据的处理
所得数据用SPSS 16.0做数据统计和单因素方差分析,P<0.05作为差异显著,利用Excel作图。
2 结果与分析
2.1 盐度对文蛤肌肉、鳃、外套膜中HSP70基因的表达
盐度对文蛤肌肉、鳃、外套膜中HSP70基因表达量见图1。盐度16、18、22、24处理组肌肉中HSP70基因的表达量显著高于盐度20的对照组(P<0.05);除盐度18处理组鳃中HSP70基因的表达量与对照组差异不显著外(P>0.05),盐度16、22、24处理组鳃中HSP70基因的表达量均显著高于盐度20的对照组(P<0.05);外套膜中HSP70基因的表达量,盐度24处理组与对照组相比差异并不显著(P>0.05),但盐度16、18、22处理组HSP70基因的表达量均显著高于对照组(P<0.05)。盐度16处理组鳃和外套膜中HSP70基因的表达量显著高于盐度18处理组(P<0.05),但肌肉中HSP70基因的表达量显著低于盐度18处理组(P<0.05)。盐度24处理组文蛤肌肉、鳃、外套膜中HSP70基因的表达量均显著低于盐度22处理组(P<0.05)。整体上盐度24处理组各组织中HSP70基因表达量相对低于盐度16、18处理组。

图1 不同盐度下文蛤HSP70基因相对表达量
2.2 pH对文蛤肌肉、鳃、外套膜中HSP70基因的表达
pH对文蛤肌肉、鳃、外套膜中HSP70基因的表达量见图2。pH 6.7、7.7、9.7、10.7处理组肌肉、鳃、外套膜中HSP70基因的表达量与pH8.7的对照组差异显著(P<0.05)。其中pH 6.7、7.7、9.7、10.7处理组鳃和外套膜中HSP70基因的表达量显著高于对照组(P<0.05);pH 6.7、7.7、9.7处理组肌肉中HSP70基因的表达量显著高于对照组(P<0.05),而pH 10.7处理组显著低于对照组(P<0.05)。pH 6.7处理组肌肉、鳃中HSP70基因的表达量虽显著低于pH 7.7处理组(P<0.05),但仍显著高于对照组(P<0.05);pH10.7处理组肌肉中HSP70基因的表达量显著低于pH 9.7处理组(P<0.05),pH 10.7处理组鳃中HSP70基因的表达量与pH 9.7处理组差异不显著(P>0.05)。外套膜中pH 6.7处理组HSP70基因的表达量显著高于7.7处理组(P<0.05),pH 10.7处理组显著高于9.7处理组(P<0.05)。
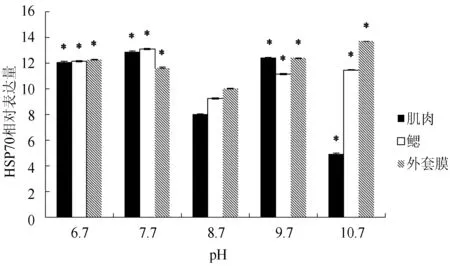
图2 不同pH下文蛤HSP70基因相对表达量
3 讨 论
HSP70作为细胞受外界应激作用后最早出现的保护蛋白,可以保护机体不受或少受伤害,并具有恢复变性蛋白和清除永久变性蛋白的作用[13]。作为水生生物生长过程中较为重要的环境因子,盐度的改变迫使生物体通过合成一些大分子物质来调节渗透压,以此来稳定细胞结构和功能[29]。本试验结果显示,相比于盐度20的对照组,盐度发生改变后,整体上文蛤肌肉、鳃、外套膜中HSP70基因的表达量均有所增加。盐度胁迫诱导机体HSP70基因表达量的升高,在马氏珠母贝[24]、合浦珠母贝[25]、企鹅珍珠贝(Pteriapenguin)[9]等研究中也取得了一致结果。
但与部分研究之间亦存在一定差异性,如仿刺参(Apostichopusjaponicus)[31]随盐度的逐渐降低和升高,体壁组织中HSP70基因的表达水平逐渐升高。而本研究各组织中HSP70基因的表达量并不随盐度持续下降或上升而逐渐升高,如肌肉中HSP70基因表达情况,盐度16处理组显著低于盐度18处理组(P<0.05),盐度24处理组显著低于盐度22处理组(P<0.05),盐度24处理组肌肉、鳃、外套膜中HSP70基因表达量均显著低于盐度22处理组(P<0.05)。首先这可能由于胁迫时间、受试生物的不同。受胁迫时间的影响,热休克蛋白基因的表达量一般呈先升后降的变化趋势。如0~48 h内罗非鱼(Oreochremis)肌肉、鳃、垂体和肾中HSP70基因的表达量整体上呈先升后降的变化趋势[32]。本研究中高盐度(24)和低盐度(16)处理组的文蛤受盐度变化胁迫时间相对大于盐度18、22处理组,采样检测时其表达量可能正处于下降阶段。但究竟多长时间后表达量达到峰值,或从何时开始表达量呈下降趋势,这也是本研究存在的不足之处,仍需对此做深入探讨。其次,文蛤长时间处于过高或过低盐度条件下,机体受到一定应激损伤,变性蛋白迅速增加,修复变性蛋白[33]的同时其表达量有所下降。再者,HSP70的表达受到负反馈调控[34-35],即盐度应激初期机体出现高含量HSP70,因转录水平需热激转录因子与热激元件共同参与,高含量的HSP70会与转录调节活性的蛋白热激转录因子结合,减少了热激转录因子与热激元件的特异性结合,控制了热休克基因的进一步转录,但随着应激时间的延长,部分组织受应激损伤限制,导致HSP70基因表达量表现出相对不高的特征。
另外,盐度18处理组肌肉和外套膜中HSP70基因的表达量显著高于盐度20处理组(P<0.05),而对于鳃中HSP70基因表达量与盐度20处理组差异并不显著(P>0.05)。这可能与不同组织中HSP70基因表达量的增加幅度、表达量的多少及表达量达峰值时间的不同有关,如盐度22条件下,罗非鱼[32]垂体中HSP70基因表达量在0~48 h内持续缓慢增加,48 h达峰值;而肌肉中表达量迅速升高,于24 h达峰值,且其达峰值的表达量显著高于垂体。另外也可能因文蛤喜欢生长有淡水注入的内湾或河口[1],因此对相对低盐度水体的抗胁迫能力优于高盐度,盐度18仍是处于文蛤适宜生长可接受范围内。从另一角度看,高盐度(24)各组织中HSP70表达量相对低于低盐度组(16、18),这也同样说明文蛤对低盐度水体的抗胁迫能力高于高盐度,姚国兴等[4]研究也证实了小规格文蛤对低盐度海水忍耐性较强。
pH作为另一重要环境因子对贝类生长具有重要作用,多种因素可导致池塘水体中pH的波动变化,例如连续性降雨、繁殖饵料生物、池塘底质消毒及浮游植物优势种的突然改变等。生物受应急刺激(重金属、缺氧、高温、有机污染等)可诱导体细胞合成热休克蛋白来保护机体免受伤害[36-37],其中pH的诱导致使生物体中热休克蛋白表达量显著增加,在其他生物中也得到一致结果,如韩俊英等[16,38]的研究表明,pH低于或高于对照组水平,脊尾白虾和中国明对虾(Fenneropenaeuschinensis)肌肉、肝胰腺组织中HSP70基因表达量均显著高于对照组。本试验结果显示,整体上文蛤受pH胁迫作用后,其肌肉、鳃、外套膜中HSP70基因的表达量显著增加(P<0.05)。
但与其他研究不同之处在于,超出机体所承受的pH范围后部分组织中HSP70基因表达量呈下降趋势。如pH 6.7处理组文蛤肌肉和鳃中HSP70基因的表达量显著低于pH 7.7处理组(P<0.05),pH 10.7处理组肌肉中HSP70基因的表达量显著低于9.7处理组和对照组(P<0.05)。主要因pH 6.7处理组与pH 7.7处理组、pH 8.7处理组相比,水体性质发生了改变,并且pH过低超出了文蛤适宜生活范围,一般文蛤最适生长pH为7.8~8.6[28],暴露于酸性条件下肌肉和鳃受到一定的应激损伤,而外套膜抗胁迫能力较强[39],肌肉和鳃中变性蛋白或永久性变性蛋白快速增加,HSP70修复变性蛋白和清除永久性变性蛋白的同时受应激损伤限制其表达量下降。pH过高(10.7)也超出了文蛤适宜生活范围,可能因pH过高造成机体有氧代谢异常,过量的活性氧引起机体氧化损伤[40-41],严重时能引起细胞凋亡或坏死,机体抗氧化能力明显降低,文蛤的肌肉关系到贝壳的张开和关闭,过高的pH引起肌肉氧化损伤,导致pH 10.7处理组中肌肉中HSP70基因的表达水平较对照组低。
另外,pH 10.7处理组肌肉和鳃中HSP70基因的表达量显著低于外套膜(P<0.05),pH 7.7处理组肌肉和鳃中HSP70基因的表达量显著高于外套膜(P<0.05)。可能因为不同的组织其表达具有差异性,其表达量达峰值的时间不同。如近江牡蛎(Crassostreahongkongensis)鳃中HSP70基因表达量于3 h达峰值,外套膜于6 h达峰值[42]。肌肉和鳃对高pH的刺激其表达量达峰值的时间早于外套膜而导致pH 10.7组肌肉和鳃中HSP70基因的表达量显著低于外套膜。与pH的改变组织敏感性具有差异也有关,如曲凌云等[22,43]认为,贝类鳃组织较其他组织对水环境的改变更为敏感,可能因文蛤肌肉和鳃对低pH的波动较外套膜更敏感,而导致pH 7.7处理组肌肉和鳃中HSP70基因的表达量相对高于外套膜。
[1] 赵莎莎,刘晨晨,杨最素,等.文蛤的研究进展[J].安徽农业科学,2014,42(9):2617-2618.
[2] 王如才,王昭萍,张建中.海水贝类养殖学[M].青岛:中国海洋大学出版社,2008:410-419.
[3] 栗志民,刘志刚,姚茹,等.温度和盐度对皱肋文蛤幼贝存活与生长的影响[J].生态学报,2010,30(13):3406-3413.
[4] 姚国兴,宋晓村,于志华,等.环境因子对文蛤幼苗生长的影响[J].水产养殖,2000(1):17-18.
[5] 栗志民,刘志刚,徐法军,等.温度、盐度、pH和饵料密度对皱肋文蛤清滤率的影响[J].渔业科学进展,2011,32(4):55-61.
[6] 王彦波,周绪霞,许梓荣.热应激蛋白70的研究进展[J].免疫学杂志,2003,19(3):79-82.
[7] Srivastava P. Roles of heat-shock proteins in innate and adaptive immunity[J]. Nature Reviews Immunology, 2002,2(3):185-194.
[8] Bukau B, Horwich A L. The Hsp70 and Hsp60 chaperone machines[J]. Cell, 1998,92(3):351-366.
[9] 黄桂菊,喻达辉,曲妮妮,等.企鹅珍珠贝热休克蛋白70基因的克隆与序列比较分析[J].热带海洋学报,2008,27(1):46-51.
[10] De Maio A. Heat shock proteins: facts, thoughts, and dreams[J]. Shock, 1999,11(1):1-12.
[11] Gordon N F, Clark B L. The challenges of bringing autologous HSP-based vaccines to commercial reality[J]. Methods, 2004,32(1):63-69.
[12] Robert J. Evolution of heat shock protein and immunity[J]. Development and Comparative Immunology, 2003,27(6/7):449-464.
[13] Feder M E, Ge H. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999,6(1):243-282.
[14] Ravaux J, Toullec J Y, Léger N, et al. First hsp70 from two hydrothermal vent shrimps,MirocarisfortunataandRimicarisexoculata: characterization and sequence analysis[J]. Gene, 2007,386(1/2):162-172.
[15] Carpenter C M, Ge H. Expression of 70 kDa heat shock proteins in Antarctic and New Zealand notothenioid fish[J]. Comparative Biochemistry Physiology Part A: Molecular Integrative Physiology, 2000,125(2):229-238.
[16] 韩俊英,李健,李吉涛,等.脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析[J].水产学报,2011,35(8):1130-1138.
[17] 王琦,李健,李吉涛,等.干露胁迫对脊尾白虾(Exopalaemoncarinicauda)HSP70和ferritin基因表达的影响[J].海洋与湖沼,2013,44(2):409-414.
[18] 孙勇,章力,雷腊梅,等.克氏原螯虾热休克蛋白70基因表达的定量研究[J].海洋科学,2009,33(8):21-25.
[19] 袁嘉恩.蟹类热休克蛋白70基因cDNA的克隆及热激前后组织表达量的初步研究[D].广州:暨南大学,2008:1-76.
[20] 李薇,张其中,张占会,等.近江牡蛎热休克蛋白70基因的原核表达研究[J].中国水产科学,2010,17(3):424-430.
[21] 李薇.近江牡蛎(Crassostreahongkongensis)HSP70蛋白原核表达、纯化、抗体制备及应用[D].广州:暨南大学,2010:1-56.
[22] 曲凌云.三种养殖扇贝热休克蛋白HSP70在逆境因子下的表达和相关基因的克隆[D].青岛:中国科学院研究生院海洋研究所,2004:1-39.
[23] 周鑫,董云伟,王芳,等.草鱼HSP70 和HSP90 对温度急性变化的响应[J].水产学报,2013,37(2):216-221.
[24] 王亚男.几种环境因子对马氏珠母贝生长、摄食及HSP70基因表达量联合效应的研究[D].湛江:广东海洋大学,2012:1-50.
[25] 黄桂菊,曲妮妮,喻达辉,等.合浦珠母贝热休克蛋白hsp70基因的克隆与表达分析[J].中国水产科学,2007,14(5):727-732.
[26] 曹伏君,刘志刚,罗正杰.海水盐度、温度对文蛤稚贝生长及存活的影响[J].应用生态学报,2009,20(10):2545-2550.
[27] 范建勋.文蛤能量代谢的研究[D].宁波:宁波大学,2010:1-32.
[28] 谭学群,乔英,张明,等.文蛤池塘养殖技术[J].水产科学,2005,24(3):22-23.
[29] 亢玉静.温度和盐度对西藏拟溞抗氧化酶及热休克蛋白HSP70基因表达的影响[D].大连:大连海洋大学, 2013:1-36.
[30] Kenneth J L, Thomas D S. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001,25(4):402-408.
[31] 于姗姗.刺参(Apostichopusjaponicus)热休克蛋白基因克隆及其对温度、盐度胁迫的响应[D].青岛:中国海洋大学,2012:1-64.
[32] 刘志刚,刘玉娇,卢迈新,等.4种罗非鱼不同组织中HSP70基因对盐胁迫的响应[J].上海海洋大学学报,2015,24(2):182-189.
[33] Kiang J G, Tsokos G C. Heat shock protein 70 kDa: molecular biology, biochemistry, and physiology[J]. Pharmacology &Therapeutics, 1998,80(2):183-201.
[34] 仲庆振,王丹,孙泽威,等.急性热应激对鹅血清激素水平及肝脏HSP70基因表达的影响[J].中国兽医杂志, 2015,51(6):42-43.
[35] 王美垚.急性低温胁迫及恢复对吉富罗非鱼血清生化、免疫以及应激蛋白HSP70基因表达的影响[D].南京:南京农业大学,2009:1-40.
[36] Parisa N, Kartik B, Dechamma M M, et al. Non-lethal heat shock induces HSP70 and HMGB1 protein production sequentially to protectArtemiafranciscanaagainstVibriocampbellii[J]. Fish & Shellfish Immunology, 2015,42(2):395-399.
[37] Long L L, Han Y L, Sheng Z, et al. Expression analysis of HSP70 in the testis ofOctopustankahkeeiunder thermal stress[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2015,187(9):150-159.
[38] 王芸,李健,张喆,等.pH、氨氮胁迫对中国对虾HSP90基因表达的影响[J].渔业科学进展,2013,34(5):43-50.
[39] 邢慧芳,李涌泉,杨慧珍,等.镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响[J].环境科学学报,2013,33(3):856-860.
[40] Franco R, Sanchez-olea R, Reyes E M, et al. Environmental toxicity, oxidative stress and apoptosis: menage a trois[J]. Mutation Research, 2009,674(1/2):3-22.
[41] Ryter S W, Kim H P, Hoetzel A, et al. Mechanisms of cell death in oxidative stress[J]. Antioxidants & Redox Signaling, 2007,9(1):49-89.
[42] 陈晨,张其中,张占会,等.近江牡蛎HSP70基因对溶藻弧菌感染的反应[J].生态科学,2011,30(3):295-300.
[43] Piano A, Asirelli C, Caselli F, et al. Hsp70 expression in thermally stressedOstreaedulis, a commercially important oyster in Europe[J]. Cell Stress Chaperones, 2002,7(3):250-257.
EffectsofSalinityandpHonExpressionofHSP70GeneinMuscle,GillandMantleofClamMeretrixmeretrix
YANG Jieqing1,2, SHEN Xinqiang1, JIANG Mei1, LI Lei1, XU Xiafang3, DONG Ran1,2
( 1. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China; 3. Marine Environmental Monitoring Center of Ningbo, SOA, Ningbo 315012, China )
As the main environmental factors affecting survival and distribution of shellfish, huge changes in salinity and pH bring massive death to clamMeretrixmeretrix. The housekeeping gene β-actin was used as control gene to study the suitable range of salinity and pH in pond clam farming. The transcription changes in HSP70 gene was quantified in muscle, gill and mantle under different salinity(16,18,20,22, and 24) and pH (6.7,7.7,8.7,9.7, and 10.7) by means of real-time fluorescence quantitative RT-PCR method. The results proved that the HSP70 gene was induced significantly in muscle, gill and mantle of the clam by salinity and pH. The expression of HSP70 gene was decreased significantly beyond a certain range of salinity and pH, but it still significantly higher than that in control group. The findings showed that there were significantly higher expression of HSP70 gene in salinity of 16,18,22, and 24 groups than in muscle in the control group of 20(P<0.05).Except in gill in the salinity group of 18 and in mantle in the group of 24, there were no significant difference in the expression of HSP70 gene with the blank group of 20(P>0.05),the salinity group of 16,18,22 and 24 in gill and mantle there were significantly higher the expression of HSP70 gene than that in the blank group of 20(P<0.05). However, the expression of HSP70 gene in the in muscle, gill and mantle in the pH group of 6.7,7.7.9.7 and 10.7 showed a significant difference with that in control group of 8.7(P<0.05).
Meretrixmeretrix; environmental factor;muscle;gill;mantle;HSP70
S968.31
A
1003-1111(2016)04-0398-06
10.16378/j.cnki.1003-1111.2016.04.015
2015-10-15;
2015-12-10.
农业部现代农业产业技术体系建设项目(CARS-48).
杨杰青(1990—),男,硕士研究生;研究方向:渔业生态学与环境保护.E-mail:513118751@qq.com. 通讯作者:沈新强(1951—),男,研究员;研究方向:渔业生态与环境.E-mail:xinqiang_shen@hotmail.com.

