纳氏试剂分光光度法测定水中氨氮的影响因素浅析
黄 亿, 张绍斌
(巴中市环境监测中心站,四川 巴中 636000)
· 环境监测 ·
纳氏试剂分光光度法测定水中氨氮的影响因素浅析
黄 亿, 张绍斌
(巴中市环境监测中心站,四川 巴中 636000)
纳氏试剂分光光度法测定水质氨氮受多种因素干扰,直接影响分析结果。针对此情况,结合环境监测工作实际,通过纳氏试剂配制、水样存放时间、稀释方式、显色条件4个方面对实验结果产生的影响进行了研究,并对这些干扰因素的消除进行了讨论,为确保纳氏试剂分光光度法测定水中氨氮结果的准确性提供了参考。
纳氏试剂分光光度法;氨氮;影响因素
1 引 言
氨氮是地表水环境监测的基本项目,是评价江河、湖库水体健康的重要指标之一。目前氨氮的测定方法包括纳氏试剂比色法[1]、水杨酸-次氯酸盐分光光度法[2]、蒸馏-滴定法[3]、氨气敏电极测定法[4]、气相分子吸收法[5]、离子色谱法[6]、吹脱-电导法[7]、离子选择性电极法[8]、酶法[9-10]等。其中,纳氏试剂分光光度法因其具有较高的灵敏度,试剂价格低廉,低温下可长时间保存[11],且简便快速已被广泛应用于地表水、地下水及工业废水中氨氮的检测。因此,本文就标准方法[1,12]并结合氨氮测定实际工作中的经验小结和体会,旨在与广大分析工作者进行交流和探讨,以期更好地指导今后的环境监测工作。
2 实验部分
2.1 实验原理
以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,此颜色在较宽的波长内强烈吸收。该络合物的吸光度与氨氮含量成正比,于波长420 nm处测量吸光度。
2.2 实验仪器
2.2.1 可见分光光度计
T6新世纪紫外可见分光光度计,北京普析通用仪器责任有限公司,配置20mm比色皿。
2.2.2 离心机
金怡台式TDL-5低速离心机,金坛市医疗仪器厂,离心管体积100mL。
2.3 实验试剂
实验试剂的配制参见HJ535-2009,水质氨氮的测定—纳氏试剂分光光度法[1]。
2.4 样品预处理与分析
2.4.1 样品预处理
为了去除水样的颜色或浑浊现象,本试验统一采用絮凝沉淀法对水样进行预处理。具体步骤如下:
在100mL水样中加入1mL硫酸锌,并加大约0.2mL氢氧化钠使之呈碱性,生成氢氧化锌沉淀(视样品的酸度逐滴加入,目视有微量絮状物产生为止)。此时pH值约为9~10之间(用pH试纸测定),混匀,静置2~3min后,离心(4 000r/min,5min)去除颜色和浑浊,取上清液待测。
2.4.2 工作曲线
在8个50mL比色管中,分别加入0.00mL、0.25mL、0.50mL、1.00mL、2.00mL、4.00mL、6.00mL、8.00mL、10.00mL氨氮标准液(10mg/L),其所对应的氨氮含量分别为0.0μg、5.0μg、10.0μg、20.0μg、40.0μg、60.0μg、80.0μg、100.0μg,加水至50mL标线。分别加入 1.0mL酒石酸钾钠溶液和纳氏试剂1.5mL,摇匀。放置10min后,在波长420nm下,用20mm比色皿,以水作参比,测量吸光度。斜率范围控制在7.0×10-3~8.0×10-3之间 。
2.4.3 样品测定
取离心后的上清液50mL,若样品氨氮浓度较高,则取少量上清液稀释后分析测定。分别加入1.0mL酒石酸钾钠溶液和纳氏试剂1.5mL,摇匀。放置10min后,在波长420nm下,用20mm比色皿,以水作参比,测量吸光度。
2.5 数据处理
浓度按公式计算:ρN=(As- A0-a)/(b×V)
ρN——水样中氨氮的质量浓度,mg/L,以氮计;
As——水样的吸光度;A0——空白试验的吸光度;
b ——校准曲线的斜率;a ——校准曲线的截距;
V ——试样体积,mL。
数据的统计分析及其图表制作采用Excel 2007。
3 结果与讨论
3.1 纳氏试剂的配制对空白值的影响
纳氏试剂配制的好坏是影响该分析方法灵敏度的关键,也是决定空白值大小的重要因素之一。标准[1,12]涉及到二氯化汞-碘化钾-氢氧化钾(HgCl2-KI-KOH)和碘化汞-碘化钾-氢氧化钠(HgI2-KI-NaOH)两种纳氏试剂配制方法,且都可产生显色基团[HgI4]2-。徐建芬等研究表明第二种方法配制的纳氏试剂空白值较高,比第一种方法高一倍[13],且第二种方法分析质控和考核样品的重现性、精密性远不如第一种方法[14]。因此本试验选用第一种方法配制纳氏试剂。
选用第一种方法配制纳氏试剂的关键在于正确把握HgCl2与KI的加入时间及条件,这决定着获得显色基团含量的多少,进而影响试剂显色的灵敏度,同时标准提出试剂空白吸光度As≤0.030,操作人员经验、试剂选择均会对纳氏试剂的显色效果造成影响。本试验配制了正常与非正常状态两类纳氏试剂,其中正常状态指颜色呈棕黄透明的纳氏试剂,非正常状态指外观为淡黄乳浊液和有微红沉淀两种纳氏试剂。
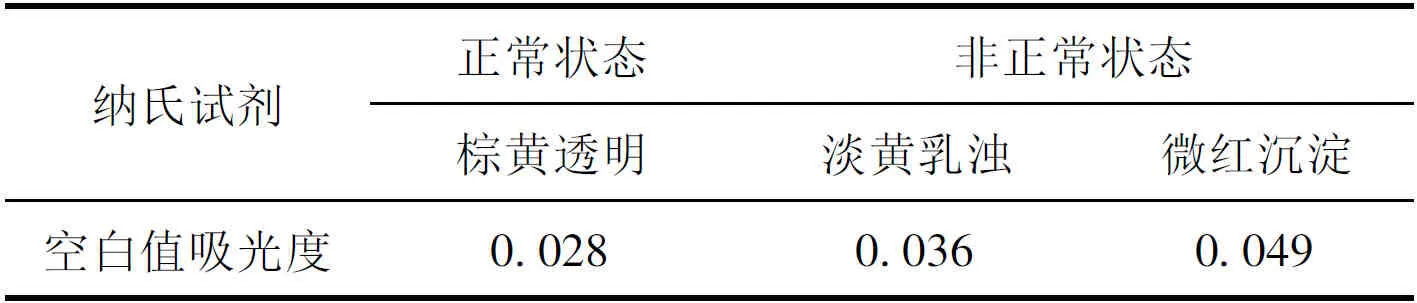
表1 纳氏试剂的配制对空白值的影响Tab.1 Effect of nessler’s reagent preparation on blank value
从表1可以看出,棕黄色透明状纳氏试剂空白值吸光度为0.028,符合空白值吸光度不超过0.030的实验要求,而纳氏试剂呈淡黄乳浊和有微红沉淀物时,空白值吸光度值偏高。导致这种现象的原因有以下两种可能:一是,在纳氏试剂配制过程中,未将氢氧化钠溶液全部溶解且未冷却至室温就加入二氯化汞和碘化钾的混合液;二是,纳氏试剂存放时间过长或未于2℃~4℃避光冷藏导致汞析出。
3.2 水样存放时间对氨氮测定的影响
本试验以3种水样为研究对象,采集生活废水、地表水和地下水样探讨水样存放时间对氨氮测定的影响。表2中编号为1、2的生活废水分别采自通江县城市生活污水处理有限公司出口和巴中市污水处理厂;编号为1、2的地表水分别采自巴州区金碑断面和平昌县白衣道河湾;编号为1的地下水为农户井水。从表2中可看出,井水随放置时间增加而氨氮含量降低,而地表水和废水水样随存放时间增加而增加。同时,随存放时间增加,水样中氨氮的含量的变化幅度表现为废水>地表水>地下水。造成这种现象可能是由于地下水常年深埋在地下,所含的氧含量原本就很少,水中微生物含量也较少,采样时水体与环境中的空气有一定的接触导致水体中氧浓度增加,大量微生物生长,在硝化细菌的作用下铵态氮大量转化为硝态氮,且随微生物大量繁殖,其转化速率也不断增加。相反,地表水和生活废水采样前与空气接触面积广,水中溶解氧较多,水样采集于聚乙烯瓶内后阻断了与空气的接触面积,水样中大量的微生物耗氧速率大于富养速率促成厌氧环境的形成,反硝化细菌大量生长,使得水中硝态氮转化为铵态氮,其转化的速率随水样存放时间的增加而减少[16-17]。

表2 不同保存时间对氨氮测定结果的影响Tab.2 Effect of different storage time on the determination results of ammonia nitrogen
3.3 稀释方式对氨氮测定的影响
纳氏试剂分光光度法测定氨氮的上限为2.0mg/L,当实际水样氨氮含量大于该值时就需要对水样进行稀释。然而就废水样品而言,在未做预备实验的前提下,水样的浓度范围是无法预知的。为了探讨稀释方式对氨氮测定结果的影响,本试验水样稀释分为两种方式,一种是比色前稀释,即发现实际浓度超出2.0mg/L时,重新取水样用无氨水进行稀释;另一种是比色后稀释,即对已经显色的水样溶液进行稀释,包括用无氨水和空白液稀释两种。

表3 不同稀释方式对氨氮测定结果的影响Tab.3 Effect of different dilution methods on the determination results of ammonia nitrogen
从表3分析可知,不同水样稀释方式对氨氮测定结果的影响不同。比色前无氨水稀释不同浓度标样的相对误差均小于5%,相对误差最低值可达0.26%。选用不同稀释水对样品进行比色后稀释,测定结果也有所差异。比色后无氨水稀释氨氮测定结果相对误差值偏高,最高值可达74.25%,远远超出水质监测实验室质量控制指标要求。而比色后空白液稀释氨氮测定结果的相对误差值均小于5%,相对误差最低值可达0.15%。同时,对于5.00mg/L低浓度样品,比色后空白液稀释氨氮测定结果的相对误差值低于比色前无氨水稀释的测定结果。可见,比色前无氨水稀释与比色后空白液稀释,氨氮测定结果的相对误差均能满足小于5%的分析要求。因此,针对大批量的氨氮分析时,若未知样品氨氮的浓度超过矫正曲线的最高浓度时,可采用空白液对比色后的溶液进行稀释再测定,不仅可以节约显色时间和分析时间,而且能避免重新取样水样不够的问题。
3.4 显色条件对氨氮测定的影响
3.4.1 显色温度
显色温度主要通过影响氨氮和纳氏试剂的反应速度来影响氨氮的测定结果。为了进一步研究显色温度对氨氮测定的影响,本试验分别配制了浓度为5.00、10.0、30.0、50.0、80.0、100mg/L的标准样品,再移取一定量的标样于50mL显色管,使其浓度控制在1.00mg/L,最后分别在5℃~35℃共计6个梯度温度进行显色。从表4可看出,显色温度增加,相同标样浓度下氨氮测定值呈单峰曲线变化。5℃~25℃下,同一标样浓度(5.00mg/L除外)下氨氮测定值逐渐增加,当温度增至30℃~35℃呈递减趋势。同时,从表中还可看出,显色温度在5℃~15℃时,不同标样浓度下氨氮测定值均小于1.00 mg/L,20℃~25℃时,氨氮测定值均接近于1.00 mg/L,当温度控制在30℃~35℃时不同标样浓度下氨氮测定值均小于1.00 mg/L。由此可见,温度5℃~15℃之间,显色不完全,20℃~25℃显色效果最好,温度高于30℃时,显色液逐渐褪色,吸光度降低。因此,在氨氮测定的过程中可控制显色温度在20℃~25℃之间,以提高氨氮监测结果的准确性和可靠性。

表4 不同显色温度对氨氮测定结果的影响Tab.4 Effect of different developing temperature on the determination results of ammonia nitrogen(mg/L)

图 不同显色时间对氨氮测定结果的影响Fig. Effect of different coloration time on the determination results of ammonia nitrogen
3.4.2 显色时间
标准[1,12]规定加入显色剂后放置10min后进行比色,然而实际分析过程中,经常会由于各种原因致使比色时间延后,因此确定一个合理的显色时间范围尤为重要。本试验显色温度为20℃,分别观察显色5、10、20、30、60、90、120min后,不同浓度(5.00、10.0、30.0、50.0、80.0、100mg/L)标准样品的显色结果。
从上图可看出,0~10min,不同浓度标准样品吸光度值较低,且随显色时间增加而增大,溶液显色不完全;10~30min,不同浓度标准样品吸光度值较大,且相对稳定;30~120min,各浓度标准样品吸光度值逐渐下降,且有红色沉淀析出。由此可见,0~10min时,溶液显色不完全,10~30min显色较为稳定,30min后显色效果逐渐下降。因此,在氨氮测定过程中,将显色时间控制在10~20min,且不超过30min,显色均能达到实验要求。
4 结 论
纳氏试剂分光光度法测定水中氨氮的准确性受多方面因素影响,本文从显色剂的配制、水样存放时间、稀释方式和显色条件4个方面浅析其对氨氮测定结果的影响,主要分析结论如下:
4.1 为了避免纳氏试剂出现淡黄乳浊液及存放时间过长而致的微红色沉淀物析出,降低试剂空白吸光度值,在纳氏试剂配制时应特别注意两点:一是,必须将氢氧化钠溶液全部溶解且冷却至室温后再加入二氯化汞和碘化钾的混合液;二是,纳氏试剂应置于2℃~4℃避光冷藏。
4.2 水样中氮形态极不稳定,随存放时间增加地下水氨氮含量逐渐下降而地表水氨氮含量却逐渐增加。水样采集后应尽快测定,避免存放过程中不同水样中各形态氮发生转化。
4.3 比色前无氨水稀释和比色后空白液稀释均能满足实验室质控要求,采用空白液对比色后的溶液进行稀释后再测定,不仅可节约显色时间和分析时间,而且能避免重新取样水样不够的问题。
4.4 显色条件对显色速度和效果有较大的影响,显色温度5℃~15℃之间,显色不完全,20℃~25℃显色效果最好,温度高于30℃时,溶液逐渐褪色,吸光度降低。显色时间0~10min时,溶液显色不完全,10~30min显色较为稳定,30min后显色效果逐渐下降。在氨氮测定过程中,将温度控制在20℃~25℃,显色10~20min,且不超过30min,以提高氨氮监测结果的准确性和可靠性。
[1] HJ535-2009, 水质氨氮的测定 纳氏试剂分光光度法[S].
[2] HJ536-2009, 水质氨氮的测定水杨酸分光光度法[S].
[3] HJ537-2009, 水质氨氮的测定蒸馏-中和滴定法[S].
[4] 陈雨艳, 钱 蜀, 张 丹, 等. 氨气敏电极法测定废水中的氨氮[J]. 辽宁化工, 2010,(7):783-785.
[5] 国家标准委员会. HJ196水质氨氮的测定气相分子吸收光谱法[S]. 北京:中国标准出版社,2005.
[6] 杨文英, 王艳春. 离子色谱法测定水中氨氮含量[J]. 中国卫生检验杂志,2005,(11):1338-1339.
[7] 王维德, 于宝祥, 梁秀凤. 吹脱-电导法测定水中氨氮及其自动分析仪[J]. 环境监测管理与技术, 2003,15(1):30-31.
[8] 刘并灶, 王领法, 王启涛, 等. 离子选择电极在线监测污水中氨氮和硝酸盐氮[J]. 中国给水排水,2009,25(10):106-108.
[9] 柳畅先, 华崇理, 孙小梅. 水中氨氮的酶法测定[J]. 分析化学,1999,27(6):712-714.
[10] Fumihiko yamaguchi, Yakashi Etoh, Mamoru Takahhashi, et al. A new enzumatic method for ammonia assay using NAD synthetase[J]. Clinica Chimica Acta,2005,352(1-2):165-173.
[11] 彭雨林. 氨氮监测分析方法研究进展[J]. 江苏科技信息, 2015,(11):19-20.
[12] 国家环境保护总局编委会. 水和废水监测分析方法(第四版增补版)[M]. 北京:中国环境科学出版社, 2006.279-280.
[13] 徐建芬, 陆树立. 纳氏试剂比色法测氨氮空白实验值的探讨[J]. 干旱环境监测, 2001, 15(4): 245.
[14] 左 芳, 张 剑, 张晓雯. 浅谈纳氏试剂分光光度法测水质中氨氮几点经验[J]. 科技风, 2010,(13):231.
[15] 李陈泽, 刘 彬, 刘璐鑫, 等. 不同存放条件及时间对水样“三氮”水平的影响[J]. 现代医药卫生, 2014,(23):3558-3560.
[16] 章 佳, 何建游. 水样存放时间对氨氮的测定的影响探究[J]. 农业与环境, 2015,(13):103.
[17] 袁 博, 单彩霞. 水样的存放时间对氨氮的测定的影响[J]. 水质监测, 2013,(12): 60-61.
Analysis of Influencing Factors of Ammonia Nitrogen Determination in Water by Nessler’s Reagent
HUANG Yi, ZHANG Shao-bin
(EnvironmentalMonitoringStationofBazhong,Bazhong,Sichuan636000,China)
Many factors can interfere the determination of ammonia nitrogen in water by nessler’s reagent spectrophotometry and will directly affect the results of the analysis. For this situation, this article studied the effects of experimental results from fours aspects of the nessler’s reagent preparation, storage time, dilution method and color condition and discussed the eliminations of these interference factors, combined with the practical environmental monitoring work. This study has provided a reference to ensure the accuracy of the determination results of ammonia nitrogen in water by nessler’s reagent spectrophotometry.
Nessler’s reagent spectrophotometry; ammonia nitrogen; influencing factors
2016-02-29
黄 亿(1987-),女,四川眉山市人,2014年毕业于四川农业大学土壤学专业,硕士研究生,现从事环境监测工作。
X832
A
1001-3644(2016)03-0023-05

