鞘磷脂合酶抑制剂对血管紧张素Ⅱ诱导的高血压小鼠心肌纤维化的影响
范一帆 齐 丹 刘佳馨 杨新春*
(1. 首都医科大学附属北京朝阳医院心脏中心 高血压病研究北京市重点实验室,北京 100020;2. 北京市顺义区医院心内科, 北京 101300)
· 心血管疾病的病理生理机制 ·
鞘磷脂合酶抑制剂对血管紧张素Ⅱ诱导的高血压小鼠心肌纤维化的影响
范一帆1齐 丹1刘佳馨2杨新春1*
(1. 首都医科大学附属北京朝阳医院心脏中心 高血压病研究北京市重点实验室,北京 100020;2. 北京市顺义区医院心内科, 北京 101300)
目的 研究鞘磷脂合酶抑制剂D609对血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导的心肌纤维化的影响。方法 将雄性野生型C57BL/6J小鼠28只,采用随机数字表区组分组法分为对照组、D609组、AngⅡ组和AngⅡ+D609组,每组7只。通过持续皮下灌注AngⅡ建立高血压模型,2周后观察小鼠的血压变化,行心脏超声评估心脏结构和功能。采用HE与Masson染色观察心肌纤维化。使用ELISA方法测定小鼠血浆中炎性反应因子、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)及白细胞介素(interleukin-6,IL-6)的浓度。结果 与对照组小鼠比较,AngⅡ组小鼠血压出现显著升高和心肌肥厚,而且心肌纤维化明显增加,血浆中TNF-α及IL-6的浓度显著增加。与AngⅡ组比较,AngⅡ+D609组小鼠血压降低,心肌肥厚明显减轻,心肌及血管组织的胶原纤维沉积显著减少,且血浆TNF-α及IL-6的浓度显著降低。结论 鞘磷脂合酶在高血压导致的心肌纤维化中可能发挥重要作用。
高血压;心肌纤维化;鞘磷脂合酶
高血压是临床最常见、最重要的心血管疾病之一,心肌纤维化是高血压导致心脏重塑的重要病理改变。心肌纤维化的发生机制非常复杂,研究[1-2]显示,压力负荷过重、炎性反应均与心肌纤维化的形成有关。研究[3]显示,磷脂作为一种具有血管活性的脂质,磷脂的代谢可能在高血压的发生发展过程中起到了重要的作用。鞘磷脂(sphingomyelin,SM)是构成细胞膜上脂筏结构的重要脂质之一,脂筏参与了许多信号转导途径的调控。鞘磷脂合酶(sphingomyelin synthase,SMS)是鞘磷脂合成的关键酶[4]。然而,SMS是否参与高血压心肌纤维化过程尚不清楚。本文将建立血管紧张素 Ⅱ(angiotensin Ⅱ,AngⅡ)诱导的小鼠高血压心肌纤维化模型,探讨SMS抑制剂D609对高血压小鼠心肌纤维化及炎性反应因子的影响。
1 材料与方法
1.1 动物与主要试剂
C57BL/6J雄性小鼠28只,10~12周,体质量22~26 g,购自北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京)2012-0001。SPF级动物房饲养。Alzet微量渗透泵(Durect Corporation公司,美国);小动物无创血压仪(BP98A,Softron公司,日本);D609(Tocris Bioscience公司,英国);血管紧张素 Ⅱ (angiotensin Ⅱ,Sigma公司,美国);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白介素6(interleukin-6,IL-6)Elisa试剂盒(R&D Biosystems公司,美国);Masson染色剂(Sigma公司,美国)。
1.2 动物分组及造模
小鼠采用随机数字表区组分组法随机分为4组,每组7只。分组方法如下:小鼠标记编号后分别称体质量并记录,按体质量从小到大的顺序排列,然后按体质量从小到大的顺序将小鼠编号填写到1至4组,下一轮按照顺序填写到4至1组,以此类推,按照“之”字形,将小鼠平均分配到各实验组。实验分组:对照组[0.9%(质量分数)氯化钠注射液灌注],D609组[0.9%(质量分数)氯化钠注射液灌注,10 mg·kg-1·d-1D609腹腔注射],AngⅡ组(1 000 ng·kg-1·min-1AngⅡ灌注)和AngⅡ+D609组(1 000 ng·kg-1·min-1AngⅡ灌注,10 mg·kg-1·d-1D609腹腔注射)。采用皮下埋植法进行微量渗透泵灌注,手术方法详见参考文献[5]。小鼠造模前与造模后隔日测血压,2周后应用HP SonoS 5500超声诊断仪进行心脏参数检测。
1.3 心肌组织HE及Masson染色
造模2周后取心室标本在4%(质量分数)多聚甲醛中固定,进行脱水、透明、浸蜡、石蜡包埋后制作石蜡切片。用HE染色法观察心脏炎性细胞的分布,用Masson染色观察胶原纤维的分布。
1.4 血浆炎性反应因子的检测
分离小鼠血浆冻存,具体操作按Elisa试剂盒说明书进行。
1.5 统计学方法
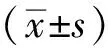
2 结果
2.1 各组小鼠尾动脉收缩压比较
4组小鼠基线血压相比差异无统计学意义。造模2周后,与Sham组相比,AngⅡ组小鼠的收缩压持续升高并维持在较高的血压水平。而Ang Ⅱ+D609组小鼠的收缩压显著低于Ang Ⅱ组(P<0.05)。详见表1。
表1 各组小鼠收缩压比较
Tab.1 Systolic blood pressure in four groups
*P<0.05vssham group,#P<0.05vsAngⅡ group,△1 mmHg=0.133 kPa.
2.2 各组小鼠超声心动图结果
二维超声心动图以左室长轴切面进行M型超声扫描,并运用脉冲多普勒超声从二尖瓣乳头肌切面进行扫描分析。AngⅡ微量泵灌注组小鼠的舒张期左室前壁厚度(left ventricular diastolic anterior wall thickness,LVAWd)及收缩期左室前壁厚度(left ventricular systolic anterior wall thickness,LVAWs)与对照组相比均显著增加(P<0.05),AngⅡ+D609组小鼠的LVAWd、LVAWs测量值与AngⅡ组相比显著降低(P<0.05)。其他测量指标组间差异均无统计学意义(P>0.05)。详见表2。
2.3 心肌组织病理观察
HE染色显示:Sham组小鼠心肌细胞体积较小,大小均一,饱满,排列较整齐。Ang Ⅱ组小鼠心肌细胞体积变大,大小不均一,形态不规则,排列紊乱,细胞壁不完全清楚,细胞相交处可见融合。Masson染色显示:心肌细胞核呈黑蓝色,胶原纤维呈亮蓝色,肌纤维、红细胞呈红色。光镜下观察,Ang Ⅱ组小鼠出现明显的心肌间质纤维化、血管周围纤维化。Ang Ⅱ+D609组小鼠心肌间质、血管周围纤维化与Ang Ⅱ组相比显著减轻(图1)。
表2 各组小鼠超声心动图结果
Tab.2 Echocardiography results of four groups of mice

ItemShamD609AngⅡAngⅡ+D609PHR/min-1458.70±17.16458.50±34.93446.63±27.91447.17±28.370.102LVIDd/mm4.14±0.194.37±0.163.86±0.183.58±0.40.083LVIDs/mm2.88±0.363.53±0.452.71±0.072.48±0.460.066LVPWd/mm0.69±0.050.65±0.130.72±0.120.79±0.170.059LVPWs/mm0.90±0.080.85±0.21.01±0.160.99±0.120.695LVAWd/mm0.61±0.110.63±0.081.07±0.09∗0.75±0.13∗#<0.001LVAWs/mm0.80±0.230.76±0.231.28±0.16∗0.91±0.14∗#<0.001EF/%57.90±11.0758.98±15.7657.06±7.5064.4±13.160.852FS/%30.55±7.0429.22±8.8529.56±5.1235.19±9.150.522E/A1.68±0.361.8±0.541.48±0.071.37±0.140.326
*P<0.05vssham group;#P<0.05vsAngⅡ group;AngⅡ: angiotensin Ⅱ; HR: heart rate; LVIDd: left ventricular diastolic internal dimension; LVIDs: left ventricular systolic internal dimension; LVPWd: left ventricular diastolic posterior wall thickness; LVPWs: left ventricular systolic posterior wall thickness; LVAWd: left ventricular diastolic anterior wall thickness; LVAWs: left ventricular systolic anterior wall thickness; EF: ejection fraction; FS: fractional shortening; E: early peak flow velocity; A: atrium peak flow velocity. Values were expressed as means ±SD.
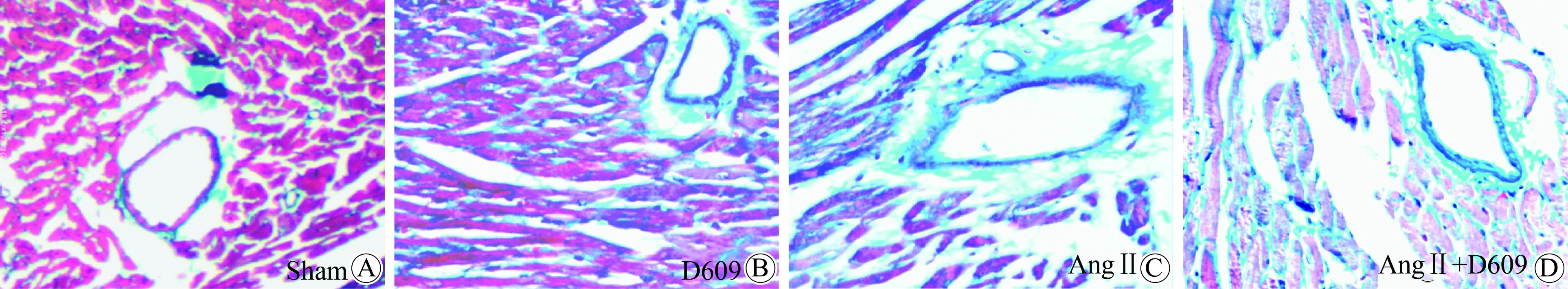
图1 心肌及血管组织Masson染色
Fig.1 Masson staining results of cardiac fibrosis(100×)
Light blue area showed interstitial and perivascular myocardial fibrosis. Sham group(A)and D609 group(B) showed normal myocardial cells in good order. AngⅡ group(C) and Ang Ⅱ+D609 group(D) showed disordered larger myocardial cells and increased cardiac fibrosis. Ang Ⅱ+D609 group(D) showed less cardiac fibrosis than AngⅡ group;AngⅡ: angiotensin Ⅱ.
2.4 小鼠血浆炎性反应因子的测定
ELISA检测小鼠血浆中炎性反应因子,通过单因素方差分析,结果发现各组小鼠血浆中TNF-α及IL-6的浓度差异均有统计学意义(P<0.001)。Ang Ⅱ处理组小鼠血浆中TNF-α及IL-6的浓度显著高于Sham组(P<0.05)(图2,3),而Ang Ⅱ+D609处理组小鼠血浆中TNF-α及IL-6的浓度与Ang Ⅱ组相比显著降低(P<0.05)(图2,3)。
3 讨论
本研究着眼于鞘磷脂合酶抑制剂在高血压发生发展中的作用,在Ang Ⅱ诱导的小鼠高血压模型中观察了鞘磷脂合酶抑制剂对血压、心血管重塑、炎性反应的影响。结果发现鞘磷脂合酶抑制剂作用于Ang Ⅱ诱导的高血压小鼠,能降低血压,减轻高血压所致的心室壁肥厚,减少心肌及血管组织胶原纤维的沉积,

图2 4组小鼠血浆TNF-α浓度测定
Fig.2 Plasma level of TNF-α in four groups of mice
*P<0.05vssham group;#P<0.05vsAngⅡ group;TNF-α:tumor necrosis factor-α.

图3 4组小鼠血浆IL-6浓度测定
Fig.2 Plasma level of IL-6 in four groups of mice
*P<0.05vssham group;#P<0.05vsAngⅡ group;IL-6:interleukin-6;AngⅡ: angiotensin Ⅱ.
并且对高血压所致的炎性反应有抑制作用。目前有证据[6]显示磷脂作为一种具有血管活性的脂质,对细胞的增生、凋亡有重要的调节作用。因此,磷脂代谢可能在高血压的发生发展过程中起着重要的作用。鞘磷脂合成途径中有多种代谢成分已经被证实与内皮细胞功能、血管的舒缩功能以及高血压的形成有关。Fenger等[7]通过对高血压患者的基因分析研究,证实磷脂类多种代谢成分的基因表达与高血压的形成有密切联系。Nogo-B抑制磷脂代谢途径中的丝氨酸棕榈酰转移酶,研究[8]显示Nogo-B敲除小鼠与野生型小鼠比较,不仅表现较低的基础血压,而且能降低AngⅡ诱导的高血压,改善内皮功能,增加一氧化氮(nitric oxide, NO)释放。1-磷酸鞘氨醇能调节动脉壁的弹性,并调节血管内皮细胞的通透性。在自发性高血压小鼠体内的研究[9]显示1-磷酸鞘氨醇的表达上调,1-磷酸鞘氨醇通过作用于表皮生长因子受体及血小板源性的生长因子,从而减轻炎性反应。鞘磷脂的合成原料神经酰胺则可通过上调血栓素A2的表达水平,进而调节内皮依赖性动脉收缩功能,导致血压升高[10]。多中心大规模临床试验[11]显示,血浆鞘磷脂浓度是心血管疾病的独立预测因子,而且与体质量指数、收缩压呈正相关。通过对高血压患者进行24 h动态血压监测,结果显示非杓型高血压患者的血浆鞘磷脂浓度显著高于杓型高血压患者[12]。本实验结果发现抑制鞘磷脂合酶能显著降低AngⅡ诱导的高血压,提示鞘磷脂合酶可能参与高血压的形成。
在心肌重塑的发展过程中, AngⅡ作为肾素-血管紧张素-醛固酮系统最重要的效应因子,可导致心肌功能障碍及炎性反应。研究[13]显示AngⅡ的刺激能诱导转化生长因子,血小板源性的生长因子以及内皮素-1的生成增加,促进心肌肥厚及纤维化进程,并导致左心室功能减低。抑制鞘磷脂合酶的表达使细胞中鞘磷脂的合成减少,进而导致细胞内及血液循环中SM的浓度减低[4]。研究[14]显示巨噬细胞中SMS具有促炎活性,通过调节NF-κB和MAPK的活性,从而影响巨噬细胞增生和脂质代谢。鞘磷脂合酶基因敲除能减少动脉粥样硬化斑块的面积,增加斑块内胶原的量,增强斑块的稳定性,具有抗动脉粥样硬化的作用。然而,鞘磷脂合酶对高血压心肌纤维化的作用及其机制尚无相关报道。本研究结果显示,AngⅡ组小鼠血浆中炎性反应因子增加,心肌细胞间质中胶原纤维大量沉积,因此,抑制鞘磷脂合酶能显著减少心肌细胞间质中胶原纤维的合成,可能与抑制炎性反应有一定关系。大量研究[2,15]显示,心肌纤维化的形成机制与炎性反应、氧化应激、心肌细胞凋亡等多种复杂因素相关。本研究初步证明鞘磷脂合酶参与AngⅡ诱导的高血压心肌纤维化,其中具体的作用机制有待进一步研究。
[1] Harvey A, Montezano A C, Lopes R A, et al. Vascular Fibrosis in aging and hypertension: molecular mechanisms and clinical implications[J]. Can J Cardiol, 2016, 32(5):659-668.
[2] Azibani F, Benard L, Schlossarek S, et al. Aldosterone inhibits antifibrotic factors in mouse hypertensive heart[J]. Hypertension, 2012, 59(6):1179-1187.
[3] Stegemann C, Pechlaner R, Willeit P, et al. Lipidomics profiling and risk of cardiovascular disease in the prospective population-based Bruneck study[J]. Circulation, 2014, 129(18):1821-1831.
[4] Jiang X C, Goldberg I J, Park T S. Sphingolipids and cardiovascular diseases: lipoprotein metabolism, atherosclerosis and cardiomyopathy[J]. Adv Exp Med Biol, 2011, 721:19-39.
[5] Wu Y, Li Y, Zhang C, et al. S100a8/a9 released by CD11b+Gr1+ neutrophils activates cardiac fibroblasts to initiate angiotensin Ⅱ-Induced cardiac inflammation and injury[J]. Hypertension, 2014, 63(6):1241-1250.
[6] Borodzicz S, Czarzasta K, Kuch M, et al. Sphingolipids in cardiovascular diseases and metabolic disorders[J]. Lipids Health Dis, 2015, 14:55.
[7] Fenger M, Linneberg A, Jorgensen T, et al. Genetics of the ceramide/sphingosine-1-phosphate rheostat in blood pressure regulation and hypertension[J]. BMC Genet, 2011, 12:44.
[8] Cantalupo A, Zhang Y, Kothiya M, et al. Nogo-B regulates endothelial sphingolipid homeostasis to control vascular function and blood pressure[J]. Nat Med, 2015, 21(9):1028-1037.
[9] Yogi A, Callera G E, Aranha A B, et al. Sphingosine-1-phosphate-induced inflammation involves receptor tyrosine kinase transactivation in vascular cells: upregulation in hypertension[J]. Hypertension, 2011, 57(4):809-818.
[10]Spijkers L J, van den Akker R F, Janssen B J, et al. Hypertension is associated with marked alterations in sphingolipid biology: a potential role for ceramide[J]. PLoS One, 2011, 6(7):e21817.
[11]Yeboah J, McNamara C, Jiang X C, et al. Association of plasma sphingomyelin levels and incident coronary heart disease events in an adult population: Multi-Ethnic Study of Atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2010, 30(3):628-633.
[12]Zheng H, Xie X, Xie N, et al. Sphingomyelin levels in nondipper and dipper hypertensive patients[J]. Exp Ther Med, 2014, 7(3):599-603.
[13]Yu L, Yang G, Weng X, et al. Histone methyltransferase SET1 mediates angiotensin Ⅱ-Induced endothelin-1 transcription and cardiac hypertrophy in mice[J]. Arterioscler Thromb Vasc Biol, 2015, 35(5):1207-1217.
[14]Liu J, Huan C, Chakraborty M, et al. Macrophage sphingomyelin synthase 2 deficiency decreases atherosclerosis in mice[J]. Circ Res, 2009, 105(3):295-303.
[15]Frieler R A, Mortensen R M. Immune cell and other noncardiomyocyte regulation of cardiac hypertrophy and remodeling[J]. Circulation, 2015, 131(11):1019-1030.
编辑 陈瑞芳
Effect of sphingomyelin synthase inhibitor on angiotensinⅡ-induced cardiac fibrosis in hypertensive mice
Fan Yifan1, Qi Dan1, Liu Jiaxin2, Yang Xinchun1*
(1.DepartmentofCardiology,BeijingChaoyangHospital,CapitalMedicalUniversity,BeijingKeyLaboratoryofHypertension,Beijing100020,China; 2.DepartmentofCardiology,TheHospitalofShunyiDistrict,Beijing101300,China)
Objective To study the role of sphingomyelin synthase inhibitor (D609) on angiotensin Ⅱ (AngⅡ)-induced cardiac fibrosis in hypertensive mice. Methods Totally 28 male C57BL/6J mice were randomly divided into 4 groups: Control group, D609 treatment group, AngⅡ-infusion group and AngⅡ+D609 treatment group. Two weeks later, blood pressure was measured and echocardiography was performed. Cardiac fibrosis was evaluated by HE and Masson staining. Plasma level of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) was measured by ELISA. Results Compared with control group, AngⅡ-infusion group showed increased blood pressure, myocardial hypertrophy, cardial fibrosis and decreased plasma level of TNF-α and IL-6. Compared with AngⅡ group, AngⅡ+D609 group demonstrated that D609 could significantly decrease the blood pressure, reduce myocardial hypertrophy and cardiac fibrosis, and also attenuate inflammatory responses by decreasing plasma level of TNF-α and IL-6. Conclusion Sphingomyelin synthase may play an important role in AngⅡ-induced cardiac fibrosis.
hypertension; myocardial fibrosis; sphingomyelin synthase
国家自然科学基金青年项目(81200194),北京市自然科学基金面上项目(7122072),中国博士后科学基金特别资助(2012T50115)。This study was supported by National Natural Science Foundation of China (81200194), Natural Science Foundation of Beijing(7122072),China Postdoctoral Science Foundation Funded Project (2012T50115).
时间:2016-12-14 20∶19
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2019.032.html
10.3969/j.issn.1006-7795.2016.06.003]
R 544.1
2016-10-03)
*Corresponding author, E-mail:yxc6229@sina.com

