气相色谱-质谱法测定橄榄油中8种脂肪酸含量
杜伟钊 盛灵慧 李保山 王 晶 向新乾 李秀琴
(北京化工大学1,北京 100029)(中国计量科学研究院2,北京 100029)
气相色谱-质谱法测定橄榄油中8种脂肪酸含量
杜伟钊1,2盛灵慧2李保山1王 晶2向新乾1李秀琴2
(北京化工大学1,北京 100029)(中国计量科学研究院2,北京 100029)
基于同位素稀释气相色谱-质谱(GC-MS)建立了同时检测橄榄油中8种脂肪酸的方法。对同位素内标物进行了筛选,确定了4种脂肪酸同位素标记物的组合模式。优化了酸碱结合法的样品衍生化条件:含有适量同位素稀释剂的8 mg橄榄油样品中加入2%的NaOH-CH3OH溶液2 mL,在80 ℃条件下皂化15 min。加入2%的H2SO4-CH3OH溶液10 mL,甲酯化10 min,随后加入10 mL水终止反应。8种脂肪酸在0.02~1.6 μg/mL的浓度范围内具有良好的线性,相关系数R2>0.99,定量限(S/N10)为0.07~0.54 μg/mL。本方法灵敏度高,测定结果准确可靠,可用于橄榄油中脂肪酸的测定。
橄榄油 气相色谱-质谱 同位素稀释 脂肪酸
橄榄油所含的不饱和脂肪酸最高可达88%,对人体具有多种保健作用[1-4]。由于橄榄树种植困难,并且存在地域和环境等气候限制以及压榨工艺复杂等因素,造成了橄榄油价格的居高不下。高品质橄榄油的掺假是一种比较常见的欺诈行为。传统的鉴别橄榄油优劣的方法主要是采取感官特征,但这种方法受到检验人员主观因素的干扰。据报道显示橄榄油中的脂肪酸组成可以有效的支撑橄榄油的质量评价,但脂肪酸含量的变化可能导致不同的判定结果,因此准确测定橄榄油的脂肪酸含量对于结果判定至关重要[5-7]。
目前关于脂肪酸的定量检测主要以气相色谱为主[8-11],也有采用液相色谱质谱联用法的报道,如Lerma-García等[11]采用液相色谱质谱法对橄榄油中的脂肪酸进行了测定。采用气相色谱质谱联用的方法,不仅涉及到脂肪酸的提取,同时需要对目标脂肪酸进行衍生化处理,样品前处理不可避免的对测定结果造成一定影响。本研究在样品前处理过程中通过引入目标脂肪酸的同位素标记物共同处理,消除了因为样品的衍生化、转移、定容等过程带来的影响。针对样品中不同丰度的脂肪酸采用分段检测的方式,实现了橄榄油中脂肪酸的准确测定。
1 材料与方法
1.1 试剂和仪器
四级杆气相色谱质谱仪(配EI离子源):美国赛默飞世尔公司;DK-8D型恒温水浴槽:上海一恒科技有限公司;MTN-2800D型氮吹仪:天津奥特赛恩斯仪器有限公司;xp56型电子天平:瑞士METTLER TOLEDO;10、100、1 000 μL移液枪:德国eppendorf公司。
正己烷、甲醇:J&T baker;98%H2SO4、NaOH:北京化工厂;棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、α-亚麻酸、花生酸、山嵛酸标准物质:中国计量科学研究院;棕榈酸同位素标记物(1-13C, 99%)、硬脂酸同位素标记物(1-13C, 99%)、油酸同位素标记物(1-13C, 99%)、花生酸同位素标记物(D39, 98%):美国剑桥同位素标准品公司。
1.2 试验方法
1.2.1 标准曲线的配制
准确称取棕榈酸20 mg,油酸120 mg,亚油酸10 mg,加入10 mL甲醇溶解记为母液A;棕榈油酸15 mg,硬脂酸45 mg,α-亚麻酸11 mg,花生酸5.6 mg,山嵛酸3 mg,加入35 mL甲醇溶液溶解记为母液B;棕榈酸同位素标记物20 mg,油酸同位素标记物120 mg,加入10 mL甲醇溶解记为母液C;硬脂酸同位素标记物60 mg,花生酸同位素标记物60 mg,加入35 mL甲醇溶解记为母液D;橄榄油样品160 mg,加入2 mL正己烷溶解记为母液E。所有母液样品在使用前均保存于-68 ℃冰箱保存,使用前平衡至室温。
1.2.2 标准曲线溶液和样本的配制
标准曲线溶液由母液A,B混合组成,使得曲线覆盖范围为样品中目标脂肪酸含量的0.5~1.5倍(分别为0.5,0.8,0.9,1.0,1.1,1.2,1.5),标准曲线各点中依次准确称取等量的500 μL母液C和200 μL母液D,用作同位素内标。
样品溶液由母液C,D,E混合组成,采用天平准确称量500 μL母液C,200 μL母液D,200 μL母液E混合均匀即为含有同位素内标物的待测样品。
1.2.3 样品前处理
向配制好的标准曲线溶液或样品溶液中加入2%的NaOH-CH3OH溶液2 mL,80 ℃水浴回流皂化15 min,随后加入浓度为2%的H2SO4-CH3OH溶液10 mL,回流甲酯化10 min,最后加入20 mL超纯水中止反应,并将体系冷却至室温,用10 mL正己烷振荡萃取。取上清液,氮气挥干,用1 000 μL正己烷复溶后上机检测。
1.2.4 GC-MS工作条件
气相色谱质谱:thermo ISQ;色谱柱:Agilent DB-225 MS(60 m,0.250 mm,0.25 μm);载气:高纯氦气;升温程序:柱温箱初始温度120 ℃,保持1 min,以2.5 ℃/min的速率升温至195 ℃,保持20 min,以5 ℃/min的速率升温至235 ℃,保持10 min;进样口温度:240 ℃;进样量:1 μL。
电子轰击离子源(EI);离子源温度:280 ℃;传输线温度:220 ℃;扫面范围:35~400 amu。
2 结果与讨论
2.1 皂化及甲酯化反应条件的优化
采用外标法对前处理过程中碱浓度(1%、2%、3%、4%)、皂化时间(10、15、20、25 min)、酸浓度(1%、2%、3%、4%)和甲酯化时间(2、5、10、15 min)分别进行单因素优化实验,以橄榄油中含量较高的不饱和脂肪酸油酸作为优化指标,优化结果如图1、图2所示。可以看出油酸的甲酯化转化率随着各优化条件的上升均有所增加,但达到某一峰值后均呈不同程度的下降趋势。可以发现碱浓度过高可能会过多的中和后续反应中的酸催化剂,因此降低了甲酯化效率;而皂化、甲酯化时间过长或是酸浓度过高均可能引发了副反应而降低了甲酯化效率。通过优化实验得到1.2.3中的前处理条件。
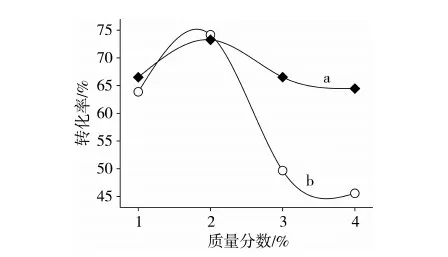
图1 碱浓度(a)和酸浓度(b)对甲酯化效率的影响

图2 皂化时间(c)和甲酯化时间(d)对甲酯化效率的影响
2.2 同位素标记物和特征离子峰的选择
为保证测定数据的准确性,考察了多种同位素标记物的出峰情况,发现当使用脂肪酸部分氘代标记物时,有可能会对目标脂肪酸本身造成干扰,影响色谱峰的对称性。如图3所示,C16∶0(2,2-D2)同位素标记物的加入使得棕榈酸峰形受到影响,而C16∶0(1-13C)同位素标记物的加入可以避免此现象的发生,如图4所示。同时当使用脂肪酸全氘代标记物时,同位素标记物的保留时间与目标脂肪酸的保留时间会出现偏移。如图5所示,花生酸C20∶0(D39)同位素标记物的出峰时间比花生酸的出峰有所提前,但结果显示保留时间不同并不会对测定结果产生影响。

图3 棕榈酸及其同位素标记物C16∶0(2,2-D2)色谱图
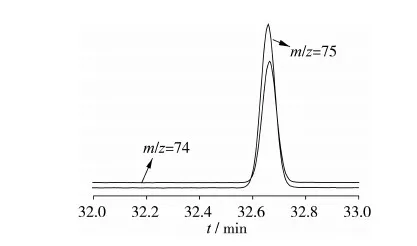
图4 棕榈酸及其同位素标记物C16∶0(1-13C)色谱图

图5 花生酸及其同位素标记物C20∶0(D39)色谱图
2.3 线性方程
试验中,内标所用同位素标记物与橄榄油中同一脂肪酸摩尔比在1∶1左右,标准曲线覆盖浓度范围为目标脂肪酸的0.5~1.5倍。以脂肪酸与其对应脂肪酸同位素标记物在样品中的摩尔比作为X轴,谱图中的脂肪酸与同位素标记物的面积比为Y轴作图,可获得如图6所示的标准曲线。

图6 脂肪酸与同位素比标准曲线
图6中RM为样品中脂肪酸与其对应脂肪酸标记物的摩尔比;RA为样品中脂肪酸与其对应脂肪酸标记物的出峰面积比;k与b分别为经过线性拟合所得标准曲线的斜率和截距。
8种脂肪酸的保留时间、特征离子、标准曲线方程见表1。通过分段检测的方法,调整分流比及待测样品浓度使不同含量的脂肪酸色谱峰信噪比(S/N)均在20以上,方法的检出限(S/N=3)为0.02~1.6 μg/mL,定量限(S/N=10)为0.07~5.4 μg/ml。

表1 8种脂肪酸的保留时间、特征离子、标准曲线
2.4 方法验证
准确称量NIST 3274-1标准物质及脂肪酸同位素标记物,对棕榈酸、棕榈油酸等8种脂肪酸进行测定,考察该方法的准确性。测定过程与1.2.3和1.2.4条件相同。根据脂肪酸含量的不同,采取分段检测的方法,将目标脂肪酸与其对应的脂肪酸同位素峰面积比值带入各自的线性方程中,计算出各脂肪酸的含量。表2为NIST 3274-1标准物质标准值及方法验证试验的测试结果。

表2 NIST 3274-1标物中脂肪酸参考及实测含量
验证试验结果显示该试验方法具有良好的准确性,测定结果全部落在标准值的区间内。同时发现当采用自身同位素标记物测定某一脂肪酸含量时,数据将更为准确,但是由于脂肪酸同位素内标的价格昂贵并难于获取等原因,在实际的检测过程中无法实现全部采用自身同位素进行定量,试验中通过采用碳数相近的脂肪酸同位素内标,同样取得了准确的结果。
2.5 橄榄油样品中脂肪酸的定量分析
准确称量一定量的橄榄油及同位素标记物样品,随后按1.2.3的条件进行样品前处理,按1.2.4的方法进行GC-MS分析,结果如表3所示。可以看出橄榄油中脂肪酸含量最高的为油酸,含量在741.71 mg/g左右,其次是棕榈酸、亚油酸和硬脂酸,含量分别在110.99,61.80和37.84 mg/g左右,其余4种脂肪酸(棕榈油酸、α-亚麻酸、花生酸和山嵛酸)含量均在1%以下,橄榄油中不饱和脂肪酸总量在80%以上。

表3 8种脂肪酸在橄榄油中的含量
3 结论
本试验建立了橄榄油中8种常见脂肪酸的定量检测方法,获取的最佳皂化、甲酯化条件为:样品8 mg,2%的NaOH-CH3OH溶液2 mL皂化15 min,2%的H2SO4-CH3OH溶液10 mL甲酯化10 min。采用同位素稀释质谱法可以实现橄榄油中8种脂肪酸的定量检测。通过对NIST 3274-1标准物质同样检测方法的比对,可知本方法具有良好的准确性,可比性和可溯源性。
志谢:本项目得到了国家质检总局食品安全项目“谷物、油脂类食品中脂肪酸、功能糖、蛋白过敏源标准物质研究”(32-ASPAQ1303)和质检行业公益项目子课题“双打中大豆油和橄榄油检验鉴定用标准物质研制”(32-211309GYH-2)的支持。
[1]Visioli F, Galli C. Biological properties of olive oilphytochemicals [J] .Critical Reviews in Food Science and Nutrition, 2002, 42:209-221
[2]Nadia Mekki, Monique Charbonnier, Patrick Borel, et al.Butter Differs from Olive Oil and Sunflower Oil in Its Effects on Postprandial Lipemia and Triacylglycerol-Rich Lipoproteins after Single Mixed Meals in Healthy Young Men [J] .The journal of nutrition, 2002, 132(12):3642-3649
[3]Menendez J A, Papadimitropoulou A, Vellon L, et al.A genomic explanation connecting “mediterranean diet”, olive oil and cancer: Oleic acid, the main monounsaturated fatty acid of olive oil, induces formation of inhibitory “PEA3 transcription factor-PEA3 DNA binding site ” complexes at the Her-2/neu(erbB-2) oncogene promoter in breast, ovarian and stomach cancer cells [J] .European Journal of Cancer, 2006, 42(15): 2425-2432
[4]Owen, R. W.,Giacosa, A., Hull, W. E., et al.Olive oil consumption and health: The possible role of antioxidants [J] .Lancet Oncology,2000, 1:107-112
[5]Maggio R M, Kaufman T S, Carlo M D, et al. Monitoring of fatty acid composition in virgin olive oil by fourier transformed infrared spectroscopy coupled with partial least squares [J] .Food Chemistry, 2009, 114(4): 1549-1554
[6]Tsimidou M, Karakostas K. Geographical classification of greek virgin olive oil by non-parametric multivariate evaluation of fatty acid composition [J] .Journal of the Science of Food and Agriculture, 1993, 62(3): 253-257
[7]Aguilera MP, Beltran G, Ortega D, et al. Characterisation of virgin olive oil of Italian olive cultivars: Frantoio and Leccino, grown in Andalusia [J] .Food Chemistry, 2005, 89:387-391
[8]汤富彬,沈丹玉,刘毅华,等.油茶籽油和橄榄油中主要化学成分分析 [J] .中国粮油学报,2013,28(7):108-113
[9]MahsaNaghshineh, Abdul Azisariffin,HasanahMohdGhazali, et al. Effect of Saturated/Unsaturated Fatty Acid Ratio on Physicochemical Properties of Palm Olein-Olive Oil Blend [J] . J Am Oil ChemSoc, 2010, 87:255-262
[10]M. Monfreda, L. Gobbi, A. Grippa. Blends of olive oil and sunflower oil: Characterisation and olive oil quantification using fatty acid composition and chemometric tools [J]. Food Chemistry, 2012, 134:2283-2290
[11]Lerma-García M J, Herrero-Martínez J M, Ramis-Ramos G, et al. Evaluation of the quality of olive oil using fatty acid profiles by direct infusion electrospray ionization mass spectrometry [J] .Food chemistry, 2008, 107(3): 1307-1313
[12]Gómez-González S, Ruiz-Jiménez J, de Castro M D L. Oil content and fatty acid profile of spanish cultivars during olive fruit ripening [J] . Journal of the American Oil Chemists' Society, 2011, 88(11): 1737-1745
[13]Yizhao Chen, Qinde Liu, Sharon Yong, et al. An improved reference measurement procedure for triglycerides and total glycerides in human serum by isotope dilution gas chromatography-mass spectrometry [J] . Clinica Chimica Acta, 2014, 428: 20-25
[14]王海波,李昌宝,吴雪辉,等.响应面方法优化罗汉果籽油提取工艺及脂肪酸组成分析 [J] .中国粮油学报,2013,28(7):46-49.
Determination of Eight Fatty Acids in Olive Oil by Gas Chromatography-Mass Spectrometry
Du Weizhao1,2Sheng Linghui2Li Baoshan1Wang Jing2Xiang Xinqian1Li Xiuqin2
(Beijing University of Chemical Technology1, Beijing 100029)(National Institute of Metrology2, Beijing 100029)
An isotope dilution method for simultaneous determination of eight fatty acids in olive oil has been established along with the gas chromatography-mass spectrometry (GC-MS) in the paper. After comparison among different isotope labeled fatty acids, four fatty acids were selected to be the internal standards. The conditions of fatty acid methyl esters preparation were optimized. The final procedures were as follows: 8 mg of sample oil, saponificated in 2 mL of NaOH-CH3OH (2%) for 15 min; methyl esterificated by 10 mL of H2SO4-CH3OH (2%) for 10 min. The limits of quantification (LOQ), linearity and accuracy were validated finally. The LOQs for analytes were proved to range from 0.07~0.54 g/mL (S/N10); the determination coefficients>0.99 within the tested concentration range (0.02~1.6 g/mL). The established method shall be successfully applied in the determination of target fatty acids in olive oil.
olive oil, GC-MS, isotope dilution, fatty acid
TQ646.4
A
1003-0174(2016)04-0104-05
国家质量监督检验检疫总局”双打”项目子课题(21130SGYH-2),中国计量科学研究院基本科研业务费(AKY1411-14)
2014-08-08
杜伟钊,男,1989年出生,硕士,化学工程与技术
盛灵慧,男,1978年出生,副研究员,脂质计量标准研究

