常规运动生化血液分析仪辅助校准方法的建立
李鹏飞,冯葆欣,张卫英,杨星雅
常规运动生化血液分析仪辅助校准方法的建立
李鹏飞,冯葆欣,张卫英,杨星雅
目的:使用运动员定值新鲜血建立常规血细胞分析仪和血生化分析仪的辅助校准方法。方法:根据比较实验的不同,总计采集213例(男155,女58)健将级及以上级别男、女运动员静脉血,取抗凝新鲜全血和混合血清。1)采血2 h内以参加全国室间质评工作的DIFF2血细胞分析仪作为参考仪器,给运动员抗凝新鲜全血定值,用新鲜抗凝全血辅助校准GEN.S血细胞分析仪,并通过重复性检验、偏差检验和离群值检验与参考仪器比对WBC、RBC、HGB、HCT、PLT等5个血细胞参数;2)取血4 h内以参加全国室间质评工作的7020生化分析仪作为参比仪器,把7020生化分析仪校准品的量值传递给1份混合运动员血清(由10份运动员新鲜血清等量混合而成),用新鲜混合血清辅助校准MD-100生化分析仪,并通过重复性检验、偏差检验和线性范围检验与参比仪器比较血清BUN、CK参数。结果:1)使用定值的新鲜抗凝全血辅助校准GEN.S血细胞分析仪后,重复性比对实验的5个血细胞参数的CV%值分别为1.4、0.6、0.4、0.6、2.3,符合测试精密度范围要求;偏差比对实验的5个血细胞参数的偏倚值(靶值±%)分别为-0.4、-0.5、1.8、-0.7、-4.1(男)和1.3、-0.8、1.5、-0.8、-4.2(女),远小于血细胞分析仪的最大允许误差范围;离群值比对实验显示,5个血细胞参数的异常高值离群值和异常低值离群值与参考仪器相比,没有出现显著差异(P>0.01)和偏离正态分布;2)使用定值的新鲜混合血清辅助校准MD-100血生化分析仪后,重复性比对实验的血清BUN、CK参数的CV%值分别为0.92、1.22,符合测试精密度范围要求;偏差比对实验的血清BUN参数的偏倚值(靶值±%)为0.2,血清CK参数的偏倚值(靶值±%)为0.9(男)、3.5(女),远小于血生化分析仪的最大允许误差范围;线性范围比对实验显示,与参考仪器比较,血清CK高值的非线性拐点在1 000 U/L附近。结论:1)使用控制时间的定值新鲜抗凝全血是建立运动生化常规血细胞分析仪辅助校准的可靠方法;2)使用控制时间的运动员新鲜混合血清是建立常规血生化分析仪辅助校准的可靠方法。建议:1)在GEN.S辅助校准后,对高水平运动员血细胞参数离群值的甄别还需扩大检测范围,并结合个体运动训练背景进行综合判断;2)对MD-100辅助校准后,对高水平运动员大于1 000 U/L的血清CK高值的检测可以采用样本倍比稀释使数值回落在线性范围内的方法。
运动生化;血液分析仪;校准方法
1 研究目的
实验室常用DIFF2和GEN.S血细胞分析仪检测运动员血细胞指标反映携氧和恢复能力,常用7020和MD-100生化分析仪检测运动员血清肌酸激酶(CK)和尿素氮(BUN)指标反馈训练负荷强度和负荷量。上述部分仪器有推荐的校准品,但普遍存在有效期短、进口试剂价格昂贵、预订和运输时间长等问题,而且,在非奥运会备战周期没有大量测试任务但又必须保证每日常规仪器间比对的严格质量控制时,建立其他辅助的、可信赖的校准方法显得尤为迫切、重要。
综合国际血液学标准化委员会(ICSH)新推荐指南和实验室前期实践探索,一般认为,定值新鲜血是生化实验室校准多系统、多仪器的最佳辅助校准品。因此,本研究拟通过使用运动员定值新鲜血建立常规运动生化血液分析仪的辅助校准方法。
2 研究对象与方法
2.1 研究对象
健将级及以上级别运动员,男155人,年龄23±3岁,身高176±4.28 cm,体重71±5.10 kg。女58人,年龄21±3岁,身高166.5±2.69 cm,体重61.4±4.98 kg(由于测试参数不同,各实验的统计样本量并不完全一致)。
2.2 实验方法
2.2.1 仪器
贝克曼库尔特公司DIFF2血细胞分析仪、贝克曼库尔特公司GEN.S血细胞分析仪、日立公司7020生化分析仪、美国MD公司MD-100生化分析仪。
2.2.2 试剂
贝克曼库尔特4C-ES细胞质控品、上海荣盛公司BUN试剂、科华公司CK试剂、罗氏C.F.A.S质控及校准品、EDTAK2 4 mL和2 mL真空抗凝管、3ml真空促凝管。
2.2.3 质量控制
1.操作规程
严格按照“质控和校准品准备、开机前检查、测试前保养、质控和校准、常规操作、测试后维护、关机程序”的标准程序进行实验。
2.测试人员
仪器固定人员,熟练掌握操作流程和评价规则,实验中任一校准方法确保为同一人开展取血和上机操作。
3.EQA控制
参比仪器连续8年获得卫生部临床检验中心组织的室间质量评价证书以确保系统误差可检验。
4.时间控制
分为血细胞分析仪的时间控制和血生化分析仪的时间控制。
2.2.4 方法
1.常规血细胞分析仪辅助校准方法的建立
以参加全国室间质评(external quality assessment,EQA)的DIFF2血细胞分析仪作为参考仪器,控制时间内给运动员抗凝新鲜全血定值,以新鲜全血辅助校准GEN.S血细胞分析仪,并通过重复性检验、偏差检验和离群值检验与参考仪器比对白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、血小板(PLT)等5个血细胞参数。
DIFF2血细胞分析仪的质控:选择贝克曼DIFF2血细胞分析仪作为参考仪器,使用配套贝克曼4C-ES细胞质控品进行低、中、高3个水平的室内质量控制。定期参加卫生部临检中心的血常规项目EQA工作,确保仪器测试结果的精密度。
血细胞分析仪的时间控制:取一份静脉血4 mL置于EDTAK2真空抗凝管中并混匀,分别于采血后室温0.5 h、2 h、4 h、6 h、8 h、10 h、12 h在血细胞分析上重复测定WBC、RBC、HGB、HCT、PLT 5个参数,每个时间点重复5次,总计35次。观察变化规律并结合文献,确定下面血细胞分析仪辅助校准方法的各项各次实验均控制在采血后2 h内完成。



2.常规血生化分析仪辅助校准方法的建立
以参加全国室间质评的7020生化分析仪作为参考仪器,控制时间内把7020生化分析仪C.F.A.S校准品的量值传递给1份混合运动员血清(由10份运动员新鲜血清等量混合而成),以此辅助校准MD-100生化分析仪,并通过重复性检验、偏差检验和线性范围检验与参考仪器比对血清BUN、CK参数。
7020生化分析仪的校准及质控:按仪器操作程序进行7020生化分析仪的维护、保养工作,开机自检仪器处于良好状态后,采用罗氏公司的C.F.A.S校准品和质控品进行仪器的校准、质控工作。定期参加卫生部临检中心的血BUN、CK项目EQA工作,确保仪器测试结果的精密度。
血生化分析仪的时间控制:在血细胞分析仪时间控制的同时取一份静脉血3 mL置于真空促凝管中并离心,分别于取血后室温7个时间点在血生化分析上重复测定血尿素(BUN)和血肌酸激酶(CK)35次。观察变化规律并结合文献,确定以下血生化分析仪辅助校准方法的各项、各次实验均控制在取血后4 h内完成。



辅助校准的线性范围检验:以7020测定结果为横坐标,MD-100测定结果为纵坐标做散点图和直线回归,对运动员特殊群体高值CK测定结果进行线性范围检验。
2.2.5 统计方法
3 结果
3.1 常规血细胞分析仪辅助校准方法的建立
3.1.1 DIFF2血细胞分析仪参加EQA的结果
图1显示,2013年实验室DIFF2血细胞分析仪血细胞项目参加室间质评的性能评价为满意和成功。

图 1 DIFF2血细胞分析仪参加室间质评的结果(2013)示意图
3.1.2 血细胞分析仪的时间控制
图2显示,采血后7个时间点在血细胞分析上重复测定WBC、RBC、HGB、HCT、PLT 5个参数,各参数变化规律不尽相同。有临床文献报道了时间温度控制对血细胞分析仪检测结果的影响并阐述原因,因实验室条件迥异各研究结论不尽相同。由于没有离心等步骤,以图2并参考文献,下文建立血细胞分析仪辅助校准方法的各项各次实验都严格控制在采血后2 h内完成。
3.1.3 新鲜抗凝全血重复性检验
DIFF2和辅助校准后的GEN.S测定同一份新鲜抗凝全血的重复性检验结果见图3、表1。

图 2 血细胞分析仪的时间控制结果曲线图

图 3 DIFF2和辅助校准后的GEN.S测定同一份新鲜抗凝全血5项血细胞参数的比较结果曲线图

DIFF2GEN.SX±SDCV%X±SDCV%WBC(×109/L)5.60±0.101.05.70±0.101.4RBC(×1012/L)4.48±0.061.24.53±0.030.6HGB(g/L)140.00±1.000.8145.00±1.000.4HCT(%)42.30±0.601.442.60±0.300.6PLT(×109/L)141.00±4.003.0149.00±3.002.3
血细胞分析仪厂家有规定的各血细胞参数精密度值(表2)。图3、表1的结果和表2相比,DIFF2和校准后的GEN.S各参数的变异系数均在厂家规定的范围内,表明辅助校准后两种仪器的测试准确度一致,具备了进行比对验证的必要条件。另外,PLT参数由于自动分析过程中受影响因素较多,因此变异系数范围变化较大。
3.1.4 男子运动员血细胞各参数偏差检验
DIFF2和辅助校准后的GEN.S测定男子运动员血细胞各参数的偏差检验结果见图4~图8、表3。

表 2 血细胞分析仪各参数精密度值
3.1.5 女子运动员血细胞各参数偏差检验
DIFF2和辅助校准后的GEN.S测定女子运动员血细胞各参数的偏差检验结果见图9~图13、表4。
血细胞分析仪的美国CLIA'88能力比对检验的分析质量要求,如表5所示。图4~图13、表3、表4的结果和表5相比,DIFF2和校准后的GEN.S各血细胞参数的偏差值远低于规定的最大允许误差范围,表明辅助校准后两种仪器的测试正确度一致,满足了比对验证的质量要求。另外,PLT参数允许范围变化较大,说明保证不同系列血液分析仪PLT测定结果一致性具有一定难度。

图 4 DIFF2和辅助校准后的GEN.S测定男子运动员白细胞的比对结果柱状图

图 5 DIFF2和辅助校准后的GEN.S测定男子运动员红细胞的比对结果柱状图

图 6 DIFF2和辅助校准后的GEN.S测定男子运动员血红蛋白的比对结果柱状图

图 7 DIFF2和辅助校准后的GEN.S测定男子运动员红细胞压积的比对结果柱状图

图 8 DIFF2和辅助校准后的GEN.S测定男子运动员血小板的比对结果
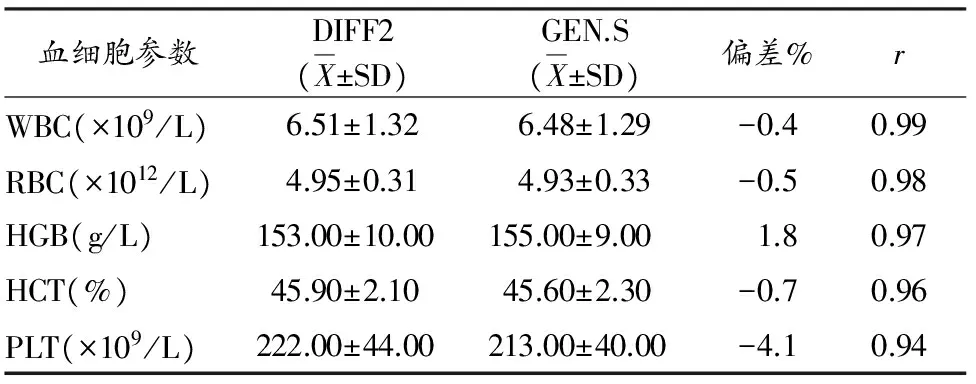
血细胞参数DIFF2(X±SD)GEN.S(X±SD)偏差%rWBC(×109/L)6.51±1.326.48±1.29-0.40.99RBC(×1012/L)4.95±0.314.93±0.33-0.50.98HGB(g/L)153.00±10.00155.00±9.001.80.97HCT(%)45.90±2.1045.60±2.30-0.70.96PLT(×109/L)222.00±44.00213.00±40.00-4.10.94

图 9 DIFF2和辅助校准后的GEN.S测定女子运动员白细胞的比对结果柱状图
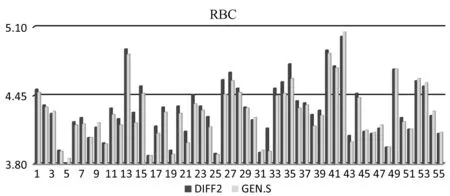
图 10 DIFF2和辅助校准后的GEN.S测定女子运动员红细胞的比对结果柱状图

图 11 DIFF2和辅助校准后的GEN.S测定女子运动员血红蛋白的比对结果柱状图

图 12 DIFF2和辅助校准后的GEN.S测定女子运动员红细胞压积的比对结果柱状图

图 13 DIFF2和辅助校准后的GEN.S测定女子运动员血小板的比对结果柱状图

血细胞参数DIFF2(X±SD)GEN.S(X±SD)偏差%rWBC(×109/L)5.73±1.285.81±1.301.30.99RBC(×1012/L)4.31±0.284.28±0.27-0.80.98HGB(g/L)131±8133±71.50.97HCT(%)39.9±2.539.6±2.3-0.80.98PLT(×109/L)218±45209±41-4.20.95

表 5 美国CLIA'88能力比对检验的分析质量要求
3.1.6 运动员5项血细胞参数离群检验


表 6 两种血细胞分析仪测定运动员5项血细胞参数的离群值检验
3.1.7 小结
本实验结果显示,采血2 h内,使用定值的新鲜抗凝全血辅助校准GEN.S血细胞分析仪后,重复性比对实验的5个血细胞参数的CV%值分别为1.4、0.6、0.4、0.6、2.3,符合测试精密度范围要求。偏差比对实验的5个血细胞参数偏倚值(靶值±%)分别为:男子运动员-0.4、-0.5、1.8、-0.7、-4.1;女子运动员1.3、-0.8、1.5、-0.8、-4.2(女),远小于血细胞分析仪的最大允许误差范围。离群值比对实验显示,5个血细胞参数的异常高值离群值和异常低值离群值与参考仪器DIFF2相比,没有出现显著差异(P>0.01)和偏离正态分布。

表 7 血细胞参数的临床参考区间
3.2 常规血生化分析仪辅助校准方法的建立
3.2.1 7020血生化分析仪参加EQA的结果
图14显示,2013年测试中心7020血生化分析仪尿素和肌酸激酶项目参加室间质评的性能评价为通过。

图 14 7020血生化分析仪参加室间质评的结果(2013)示意图
3.2.2 血生化分析仪的时间控制
图15显示,取血后7个时间点在血生化分析上重复测定BUN/CK参数,8 h后CK活性呈现明显下降趋势。血样本放置时间和方式对不同生化指标检测结果的影响也有大样本临床报道和原因分析,虽然测试仪器不同不利于统一评定,但一般倾向于审慎观点,本文不在此重点讨论。由于增加离心等步骤,以图15并结合文献,建立血生化分析仪辅助校准方法的各项、各次实验都严格控制在取血后4 h内完成。
3.2.3 新鲜混合血清重复性检验
7020和辅助校准后的MD-100测定同一份新鲜混合血清的重复性检验结果见图16、表8。

图 15 本研究血生化分析仪的时间控制结果曲线图
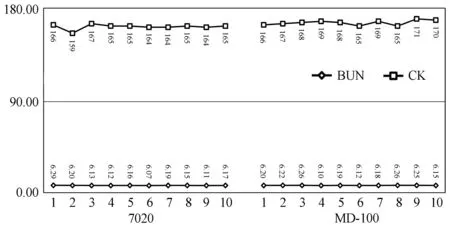
图 16 7020和辅助校准后的MD-100测定同一份新鲜混合血清BUN、CK的比较结果曲线图

7020MD-100X±SDCV%X±SDCV%BUN(mmol/L)6.16±0.060.986.19±0.060.92CK(U/L)164±2.121.29168±2.041.22
血生化分析仪厂家有规定的血清BUN、CK参数精密度值(表9)。表8的结果和表9相比,7020和校准后的MD-100血清BUN、CK的变异系数均在厂家规定的范围内,表明辅助校准后两种仪器的测试准确度一致,具备了进行比对验证的必要条件。
3.2.4 运动员血清尿素氮偏差检验
7020和辅助校准后的MD-100测定运动员血清BUN的偏差检验结果见图17、表10。
3.2.5 男、女运动员血清肌酸激酶偏差检验
7020和辅助校准后的MD-100测定男、女运动员血清CK的偏差检验结果见图18、图19和表10。

表 9 血生化分析仪BUN、CK参数精密度值

图 17 7020和辅助校准后的MD-100测定运动员血清BUN的比对结果柱状图

7020(X±SD)MD⁃100(X±SD)偏差%rBUN(mmol/L)5.89±1.575.90±1.610.20.9967CK(U/L,男)485.82±380.06490.19±379.280.90.9981CK(U/L,女)200.31±199.66207.36±200.443.50.9992

图 18 7020和辅助校准后的MD-100测定男子运动员血清CK的比对结果柱状图
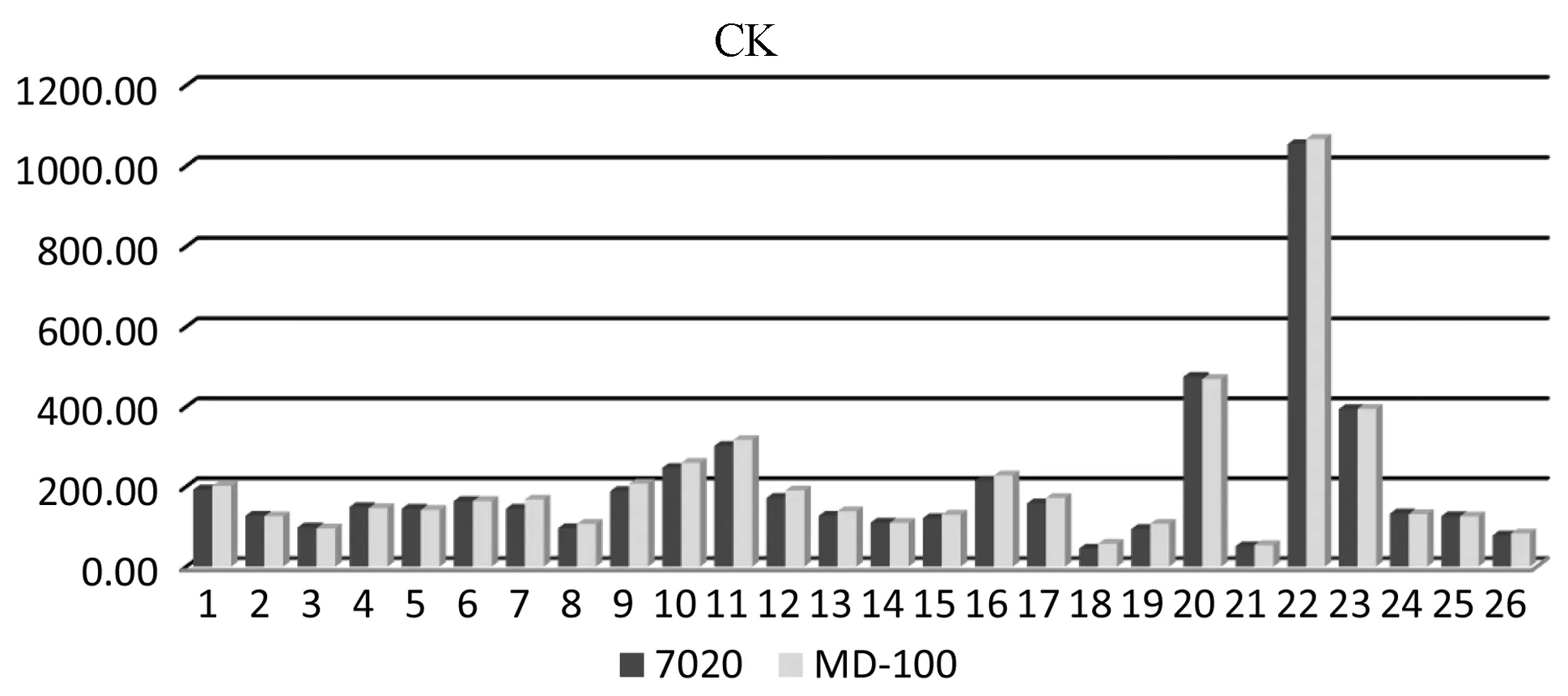
图 19 7020和辅助校准后的MD-100测定女子运动员血清CK的比对结果柱状图
血生化分析仪的美国CLIA'88能力比对检验的分析质量要求如表11所示。图17~图19、表10的结果和表11相比,7020和校准后的MD-100 测定血清BUN、CK的偏差值远低于规定的最大允许误差范围,表明辅助校准后两种仪器的测试正确度一致,满足了比对验证的质量要求。

表 11 美国CLIA'88能力比对检验的分析质量要求
3.2.6 男、女运动员血清肌酸激酶线性范围检验
7020和辅助校准后的MD-100测定男、女运动员血清CK的线性范围检验结果见图20、21。血清酶比色法BUN和CK的线性范围及相关系数要求如表12所示。表10的结果和表12相比,BUN测定范围在线性范围内,不再作散点图和线性回归分析。如图20、图21显示,7020和校准后的MD-100测定运动员血清CK在1 000 U/L左右有偏离线性关系的趋势,这可能和CK>1 000 U/L以上的测定数值例数较少(男6例,女1例)有关,但也可初步看出,辅助校准后的MD-100测定CK的线性范围较窄。

图 20 7020和辅助校准后的MD-100测定男子运动员血清CK的线性范围检验示意图

图 21 7020和辅助校准后的MD-100测定女子运动员血清CK的线性范围检验示意图

血清参数线性范围相关系数BUN(mmol/L)0~50.0≥0.990CK(U/L,37℃)0~2000≥0.990
3.2.7 小结
本实验结果显示,取血4 h内,使用赋值的新鲜混合血清辅助校准MD-100血生化分析仪后,重复性比对实验的血清BUN、CK参数的CV%值分别为0.92、1.22,符合测试精密度范围要求。偏差比对实验的血清BUN参数的偏倚值(靶值±%)为0.2,血清CK参数的偏倚值(靶值±%)为0.9(男)、3.5(女),远小于血生化分析仪的最大允许误差范围。线性范围比对实验显示,与参考仪器7020相比,血清CK高值的非线性拐点在1 000 U/L附近。
4 讨论
运动生化血液分析仪的校准品是用于校准血液分析仪的物质,应具有稳定且可溯源的特点,以保证检测结果的正确性,通常使用与仪器配套的商品化校准品。对于校准品定值的来源,应由新鲜血经参考测量系统传递赋值,而且,最好是使用有溯源性的国际公认参考方法标定的健康人新鲜血,或按说明书要求用厂家的配套标准物进行校准,不应由前批号的校准品或其他厂商的校准品传递。不同厂家或型号不配套的非新鲜血校准物不能混用,更不能用全血质控物校准仪器。
4.1 常规血细胞分析仪辅助校准方法的建立
血细胞分析仪具有操作简单、测定迅速、重复性高的特点而得到广泛应用。但有研究表明,在我国血细胞分析仪校准方面存在的问题仍很突出,许多血细胞分析仪因没有配套校准物,而无法保证测试结果的准确性。为保证检验质量,ICSH对血细胞分析仪的考核,在细胞计数、血红蛋白测定方面,要评价仪器测试样本的变异率、可比性和准确性等;在白细胞方面,要评价重复性、准确性和对异常细胞的灵敏度;而血小板自动化分析过程中受影响因素较多,保证不同血细胞分析仪血小板测试结果一致相对具有难度。DIFF2血细胞分析仪配套校准品4C-CAL和质控品4C-ES,用该仪器定值的新鲜全血可以对其他血细胞分析仪进行辅助校准。
本实验结果表明,辅助校准后的血细胞分析仪,WBC、RBC、HGB、HCT、PLT 5个常规血细胞参数符合重复性检验、偏差检验和离群值检验的比对要求,使用控制时间的运动员定值新鲜抗凝全血是建立血细胞分析仪辅助校准的可靠方法。
4.2 常规血生化分析仪辅助校准方法的建立
检测准确度是ICSH评价血生化分析仪最重要的性能指标,包含正确度和精密度,由检测仪器、试剂、校准品等共同组成的检测系统决定。7020生化分析仪,吸样、吸试剂、混合、去干扰物、保温、比色、检测、结果计算和报告等实验操作步骤全部由仪器独立完成,实现自动化,只需预先装入样品和试剂,通知仪器要检测的项目即可。而MD-100生化仪,在比色之前的步骤(吸样、吸试剂、混和)必须由人工完成,由于存有样品和试剂的流动比色池难以清洗,导致检测的准确性和精密度可能不如前者高,在测试结果上可能会产生一定差异。在使用多台分析设备的常规实验室内部,ICSH推荐可指定其中一台仪器为“校准器”或参比仪器,并用其对人新鲜血样本进行定值,再利用定值后的人血样本校准其他仪器,以保证结果的一致性和溯源性。
7020仪器配套罗氏校准品的组合,测定结果具有可溯源性,是目前公认较好的血生化检测系统之一。用该系统量值传递后的新鲜血清的结果再去校准其他检测系统,从实验结果来看,能明显改善某些酶的测定结果差异。一般认为,新鲜混合血清是校准系统的最佳校准品。但是,新鲜混合血清作为临时酶校准品基质效应虽然最小,但并非完全没有。特别是多项酶类测定时,由于影响因素众多,最好在使用前先进行临时校准品的多项检验,避免盲目应用影响测定的准确度和正确度。同时在酶类测定时,还应充分认识校准品与检测系统配套的重要性,才能真正获得满意的测定结果。
本实验结果表明,辅助校准后的血生化分析仪,BUN和CK两个常规运动生化血清参数符合重复性检验、偏差检验和离群值检验的比对要求。因此,使用控制时间的运动员定值新鲜混合血清是建立血生化分析仪辅助校准的可靠方法。
5 结论与建议
从室间质评到重复性检验、再到偏差检验,完成仪器辅助校准的同时证明了测试数据的可溯源性、可比对性。其中,室间质评的高性能是辅助校准方法的充分条件;重复性准确度检验的高性能是辅助校准方法的必要条件;而偏差正确度检验的高性能满足了辅助校准方法的质量要求;并且离群值和线性范围检验的高性能,满足了辅助校准方法对于测试运动员特殊群体参数异常高、低值的质量要求。
结论1:使用控制时间的定值新鲜抗凝全血是建立运动生化常规血细胞分析仪辅助校准的可靠方法。
结论2:使用控制时间的运动员新鲜混合血清是建立常规血生化分析仪辅助校准的可靠方法。
建议1:在GEN.S辅助校准后,对高水平运动员血细胞参数离群值的甄别还需扩大检测范围,并结合个体运动训练背景进行综合判断。
建议2:对MD-100辅助校准后,对高水平运动员大于1 000 U/L的血清CK高值的检测可以采用样本倍比稀释使数值回落在线性范围内的方法。
[1]段秋林,殷海燕,樊超英,等.新鲜全血标本在多台血细胞分析仪间室内质控中的应用[J].国际检验医学杂志,2010,31(2):187-188.
[2]冯连世,李开刚.运动员机能评定常用生理生化指标测试方法及应用[M].北京:人民体育出版社,2002:144-153.
[3]顾国龙,谢智光,梁景云,等.经日立-罗氏检测系统量值传递后的新鲜混合血清作临时酶校准品的可行性[J].现代检验医学杂志,2007,22(3):113-114.
[4]黄海燕,李雪宏,张淑,等.抗凝新鲜血在血细胞分析仪校准和比对中的应用探讨[J].检验医学与临床,2011,8(12):1452-1454.
[5]李鹏飞,冯葆欣,宗丕芳,等.指血与静脉血BUN、CK3种测试方法的比较实验研究[J].体育科学,2010,30(1):80-85.
[6]李卫宁,吴志.不同生化试剂检测结果的比较研究[J].现代检验医学杂志,2006,21(2):56-57.
[7]美国医疗机构评审联合委员会国际部.临床实验室评审标准[M].申子瑜,译.北京:科学技术文献出版社, 2009:95-100.
[8]彭海维,方宗君,杨容,等.血标本放置时间和方式对9项生化指标检测结果的影响[J].中国全科医学,2010,13(30):3427-3428.
[9]彭黎明,邓瑞雪.血细胞自动分析校准的溯源[J].中华检验医学杂志,2005,28(5):475.
[10]彭明婷,谷小林,王文丽,等.不同方法校准血液分析仪的结果比较[J].中华检验医学杂志,2000,23(1):37.
[11]任碧琼,徐飞,蒋卫平,等.采用新鲜全血比对控制ADVIA2120五分类血液分析仪质量的方法探讨[J].重庆医学,2011,40(28):2854-2858.
[12]邵大祥.标本保存时间及温度对血液生化检测结果的影响分析[J].国际检验医学杂志,2013,34(21):2896-2997.
[13]王治国. 临床检验质量控制技术[M].2版.北京:人民卫生出版社, 2008:263-270.
[14]杨彬,黄繁嫱. 新鲜血生化室间质评调查结果分析[J].现代检验医学杂志, 2002, 17(3):43.
[15]展凤霞,王谦,杨晓静,等.新鲜全血代替校准物在多系列血液分析仪上的应用[J].临床检验杂志, 2003,21(3):167.
[16]朱文元,刘芹,王莉,等. 抗凝全血标本存放条件对血细胞参数稳定性的影响[J].国际检验医学杂志, 2011, 32(4):439-441.
[17]宗丕芳.采用定值新鲜血校准CISF-820血细胞分析仪[J].中国运动医学杂志, 2006, 25(6):703-705.
The Building of an Aided Calibration Method for Routine Sports Biochemistry Blood Analyzers
LI Peng-fei,FENG Bao-xin,ZHANG Wei-ying,YANG Xing-ya
Objective:To build an aided calibration method for routine hematology analyzers and biochemistry analyzers by fresh blood specimens from athletes.Methods:1) Sample of fresh whole blood from athlete was measured in 2 hours by DIFF2 hematology analyzer,an reference instrument participating the EQA program,then used to calibrate GEN.S hematology analyzer.The RBC,HGB,HCT,MCV and PLT counting of 155 male athletes and 58 female athletes were compared between the two hematology analyzers on repeatability test,bias test and outlier test.2) A pooled serum from balanced mix of ten athletes fresh serum was measured in 4 hours by 7020 biochemistry analyzer,an reference instrument participating the EQA program,then used to calibrate MD-100 biochemistry analyzer.The serum level of BUN & CK of 100 male athletes and 26 female athletes were compared between the two biochemistry analyzers on repeatability test,bias test and linearity range test.Results:1) After the aided calibration for DIFF2 hematology analyzer,the repeatability test showed that the coefficients of variation (CV)% of five hematological parameters were 1.4,0.6,0.4,0.6 and 2.3,beyond the degree of precision.The bias test showed that the bias value of five hematological parameters were respectively 0.4 minus,0.5,1.8,0.7 minus and 4.1 minus in male group and 1.3,0.8,1.5,0.8 minus,4.2 minus in female group,lower than the maximum permissible error.The outlier test showed that there was no significant difference in abnormally low or high value of five hematological parameters between the two hematology analyzers.2) After the aided calibration for MD-100 biochemistry analyzer,the repeatability test showed that the CV% of the serum level of BUN & CK were 0.92 and 1.22,beyond the degree of precision.The bias test showed that the bias value of the serum level of BUN was 0.2,and that of the serum level of CK was respectively 0.9 in male group and 3.5 in female group,lower than the maximum permissible error.The linearity range test showed that inflection point of the serum level of CK was 1000U/L.Conclusion:1) Application of athletes fresh whole blood for aided calibration of hematology analyzers is a reliable method.2) Application of athletes fresh pooled serum for aided calibration of biochemistry analyzers is a reliable method.It is proposed that the calibration method for hematology analyzers may be more helpful for the detecting athlete outliers in consideration of individual training background and that the calibration method for biochemistry analyzers can be more feasible to test the serum level of CK from athletes with sample dilution.
sportsbiochemistry;bloodanalyzer;calibrationmethod
1002-9826(2016)05-0136-10
10.16470/j.csst.201605019
2015-10-19;
2016-06-21
国家体育总局体育科学研究所基本科研业务费项目(基本13-27)。
李鹏飞(1977-),男,山西晋城人,高级实验师,硕士,主要研究方向为体育重点实验室测试,Tel:(010)87182539,E-mail:lipengfei@ciss.cn。
国家体育总局体育科学研究所,北京 100061 China Institute of Sport Science,Beijing 100061,China.
G804.7
A

