根癌农杆菌介导地被菊‘紫妍’遗传转化体系的建立
周蕴薇,刘 彧,马 欣,高文杰,何 淼
(东北林业大学 园林学院,哈尔滨 150040)
根癌农杆菌介导地被菊‘紫妍’遗传转化体系的建立
周蕴薇,刘 彧,马 欣,高文杰,何 淼
(东北林业大学 园林学院,哈尔滨 150040)
以地被菊‘紫妍’高效再生体系为基础,研究农杆菌介导的地被菊‘紫妍’遗传转化的若干影响因素。结果表明:卡那霉素6、4 mg·L-1分别是叶片分化和植株生根的最适筛选质量浓度,同时确定羧苄霉素200 mg·L-1是抑制农杆菌生长的最适质量浓度;预培养2 d,侵染时菌液OD600约为0.5,侵染时间8 min,共培养2 d,延迟培养3 d有利于提高转化频率。对抗性芽进行生根筛选后,抗性苗提取DNA经过PCR检测初步证明外源基因ClCBF4已整合到地被菊中。移栽出的转基因地被菊全部存活且生长状况良好。
地被菊;遗传转化;根癌农杆菌;ClCBF4
地被菊(Chrysanthemumgrandiflorum)是菊花中具有植株低矮、抗逆性强、管理粗放和花紧密等特点的一个品种群[1]。由于其盛花期在“十一”前后,这一新型菊花已在很多地区得到推广和应用[2]。但是,这种新型菊花在中国北方应用受到的一个限制性因素就是在秋冬季露地生长情况下绿期较短[3]。因此,开展培育耐寒性较强的品种并加以应用显得尤为重要。
CBF(C-repeat bing factor)是植物特有的一类转录因子,在逆境条件下,CBF转录因子能激活下游含有CRT/DRE(C-repeat dehydration-responsive element)顺式作用元件的COR(cold-regulated)基因的表达,从而提高植物的抗逆性[4]。当植物细胞感应到干旱、高盐或低温等胁迫的时候,一系列CBF上游转录因子被激活,同时CBF基因表达产物与下游一系列COR基因启动子中的CRT/DRE元件结合[5],诱导大量抗性基因表达,以增强植物综合抗逆性。这类转录因子一般存在于干早、高盐或低温胁迫条件下应答基因的启动子中,刺激这类抗性基因的表达来提高植物的抗逆性[6-8]。在前期表达分析中发现,该基因在甘菊中不但受冷诱导表达,同时受到盐、干旱的诱导表达[9]。目前,已经在多种植物上得到证实和应用,如肖政等[10]成功将CBF1基因转入菊花“小金黄”。
本研究拟将抗性因子转入地被菊中以提高抗逆性,使其具有更长的花期,在绿化过程中发挥更加重要的作用。利用农杆菌介导法将甘菊ClCBF4基因转入地被菊中,旨在获得具有优良稳定性的转基因植株。了解非模式植物中抗性因子的作用,同时获得具有更强抗逆性的地被菊品种,以期为今后开展抗性强的地被菊品种培育提供参考。
1 材料与方法
1.1 试验材料
将培养20 d左右的地被菊‘紫妍’完全展开的无菌上部叶片作为外植体,切成0.5 cm×0.5 cm小叶片作为受体材料。
农杆菌菌株是GV3101,携带有35S启动子的自野生甘菊中克隆出的ClCBF4转录因子,其表达载体是pBI121,2012年于北京林业大学园林学院戴思兰教授实验室构建,置于东北林业大学园林学院实验室保存。
卡那霉素(Km)、羧苄青霉素(Carb)、利福平(Rif)、庆大霉素(Gent)酵母粉、胰蛋白胨、MS培养基、6-苄氨基腺嘌呤(6-BA)、萘乙酸(NAA)等药品购于哈尔滨伊事达生物公司。植物基因组DNA提取试剂盒为天根植物基因组DNA提取系统。
1.2 遗传转化体系建立的方法
农杆菌的活化培养参照向太和等[11]的方法。
卡那霉素对地被菊‘紫妍’叶盘的筛选质量浓度、卡那霉素抑制茎段生根的最佳质量浓度、羧苄霉素对叶片脱菌质量浓度的确定参照储俊等[12]的方法。预培养时间、农杆菌侵染时间、共培养时间、延迟培养时间的确定参照Sun等[13]的方法。
预培养培养基:MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1。
最适生根培养基:MS+NAA 0.2 mg·L-1。
延迟筛选培养基:MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1+Carb 300 mg·L-1。
分化筛选培养基:MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1+Km 6 mg·L-1+Carb 200 mg·L-1。
生根筛选培养基:1/2MS+NAA 0.2 mg·L-1+Km 4 mg·L-1。
1.3 转基因植株的筛选及鉴定
将‘紫妍’经遗传转化后的再生苗从叶盘外植体上取下后,接入生根筛选培养基中,筛选出的生根植株通过试剂盒提取基因组DNA,提取的植株部位为抗性苗叶片。
以提取好的抗性苗DNA为模板,未转化的野生型植株做阴性对照,水作为空白对照,pBI121-ClCBF4质粒为阳性对照,CBF4-BamHⅠ:5′-CGCGGATCCTTTACAAGTCCAAA- ACAACT-3′为上引物,CBF4-ScaⅠ:5′-TTTAGTACTATAACTCCATAGCGCCAC-3′为下引物,进行PCR扩增。扩增产物于10 g/L的琼脂糖凝胶电泳检测分析。扩增体系为:1 μL DNA模板,1 μL CBF4-BamHⅠ,1 μL CBF4-ScaⅠ,10 μL 2×EasyTaqPCR SuperMix,7 μL ddH2O。扩增条件为:94 ℃预变性5 min;94 ℃变性50 s;57 ℃退火50 s;72 ℃延伸40 s;72 ℃延伸10 min;10 ℃终止;4 ℃保存,25个循环。
2 结果与分析
2.1 卡那霉素对叶片分化率的影响
在叶片最适分化培养基中添加不同质量浓度的卡那霉素显著地影响地被菊‘紫妍’的叶片分化率,由表1可以看出,当卡那霉素质量浓度由0 mg·L-1增至4 mg·L-1时,叶片分化率逐渐降低,且降幅较大,而当卡那霉素质量浓度大于4 mg·L-1时,叶片分化率降至0。同时,在试验期间观察到,当卡那霉素质量浓度在0、2、4 mg·L-1时,叶片逐渐增大,愈伤组织形成明显,而随着卡那霉素质量浓度增大,叶片愈伤形成不明显,甚至黄化、褐化死亡(图1)。所以选取6 mg·L-1作为叶片的最适筛选质量浓度。
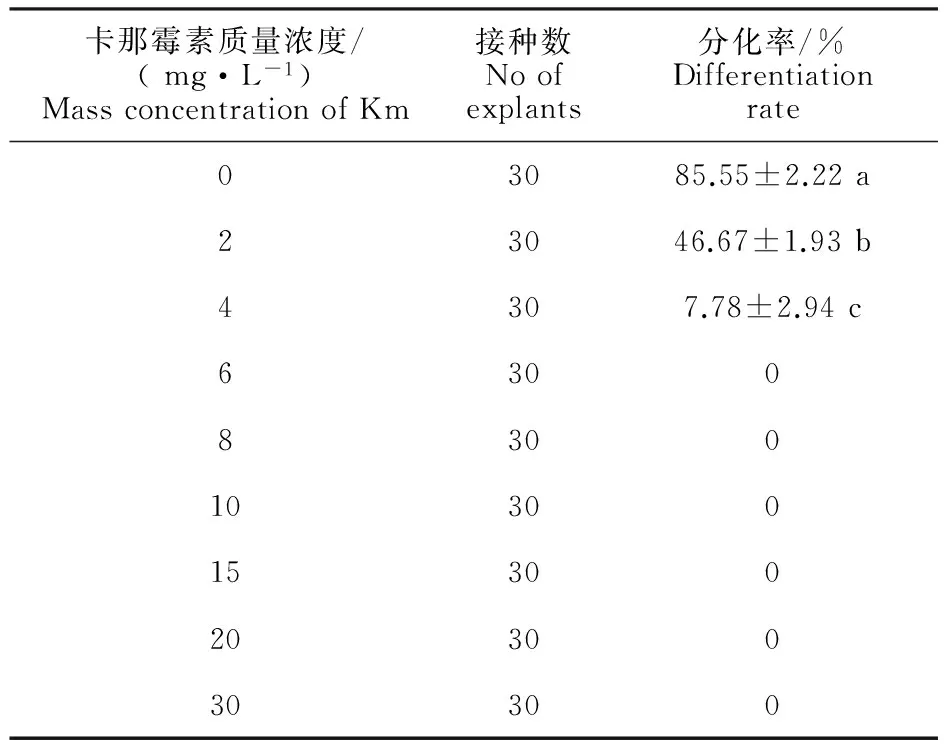
表1 不同质量浓度卡那霉素条件下叶片分化情况
2.2 卡那霉素对植株生根的影响
卡那霉素质量浓度对植株生根情况有着较大的影响。由表2可以看出,随着卡那霉素质量浓度的增加,生根系数和平均根长显著减小(P<0.05),当卡那霉素质量浓度增至4 mg·L-1时,生根率、生根系数、平均根长均降至0。同时,在试验过程中观察到,随着卡那霉素质量浓度的增加,植株逐渐低矮,叶片变小、发黄甚至萎蔫;植株中下段茎部发生紫化现象,且逐渐明显,根部呈现褐色突起,阻碍植株生根和地上部分生长,一段时间后导致植株死亡(图2)。所以选取4 mg·L-1作为植株生根的最适筛选质量浓度。
2.3 不同质量浓度羧苄青霉素对叶片脱菌的影响
羧苄青霉素是常用的转基因试验抑菌剂,加入适量的羧苄霉素既能抑制侵染后多余菌液的扩大生长,又能使叶片分化受到最小的影响。如表3所示,当羧苄毒霉素质量浓度为100 mg·L-1时,有近一半的叶片被菌液污染边缘,导致分化率较低,而当羧苄毒霉素质量浓度为200、300 mg·L-1时,菌落生长受到抑制,叶片分化率升高且差异不显著(P>0.05),而羧苄毒霉素质量浓度再增大时,菌落生长虽被完全抑制,但叶片分化率显著降低(P<0.05),所以从叶片分化率、菌落生长情况和预防浪费多角度分析,选取羧苄毒霉素 200 mg·L-1作为抑制农杆菌生长的最适质量浓度。在延迟培养之后的培养过程中,通过观察叶片分化和菌落生长情况,适量减小羧苄毒霉素的质量浓度,达到抑菌作用后即可停止使用。
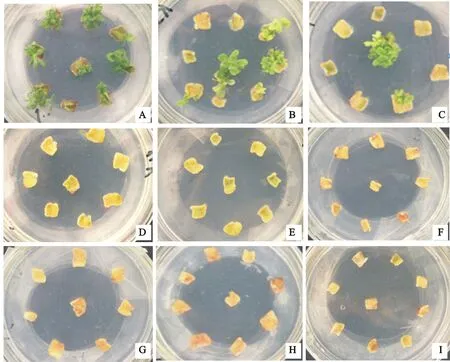
A~I分别表示卡那霉素质量浓度为0、2、4、6、8、10、15、20、30 mg·L-1时叶片分化情况。
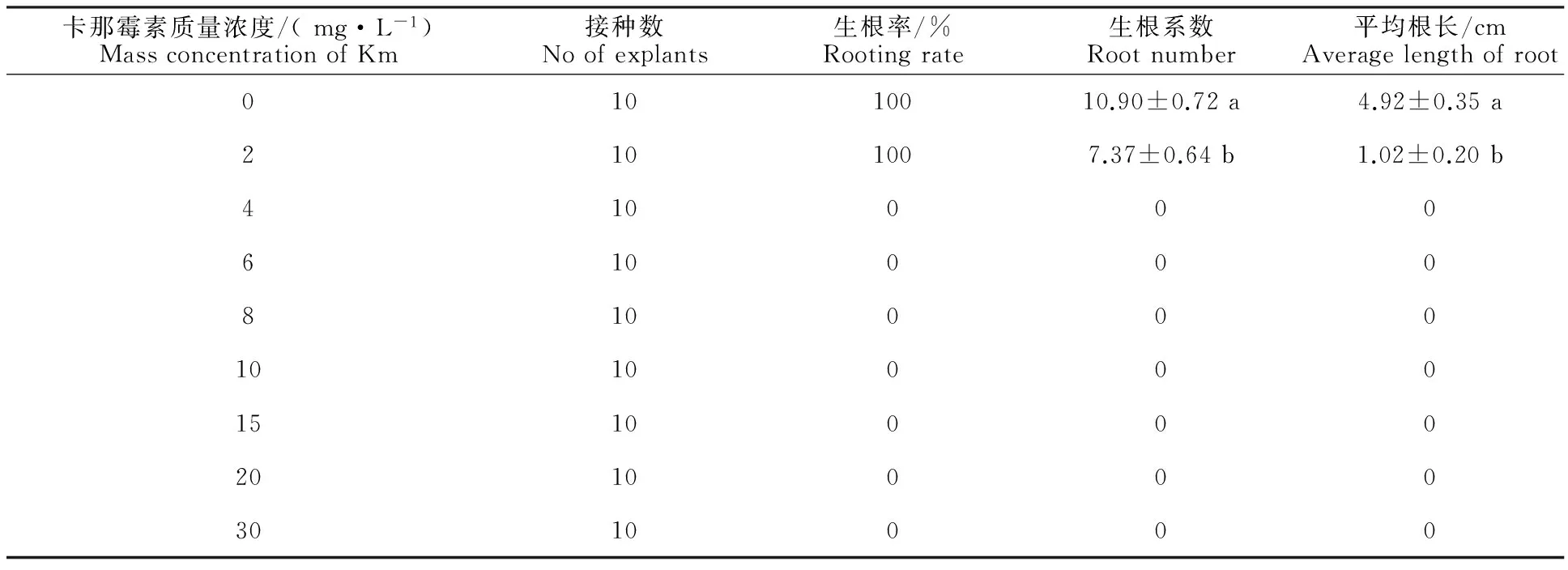
表2 不同质量浓度卡那霉素条件下植株生根情况
2.4 预培养时间的确定
叶片在侵染前要经过预培养阶段,目的是使叶片细胞在侵染时处于较高的分化状态,适当的预培养时间能够提高叶片转化率。如表4所示,叶片不经过预培养阶段直接进行侵染时,抗性愈伤生成率较低,且没有抗性芽生成;预培养2 d时的抗性芽生成率显著高于预培养1、3 d时(P<0.05),说明预培养时间过长,叶片伤口逐渐愈合,对菌液的侵染产生抵御能力,不利于转化。所以选择2 d作为最适预培养时间。

1~9分别表示卡那霉素质量浓度为0、2、4、6、8、10、15、20、30 mg·L-1 时植株生根情况。

表3 不同质量浓度羧苄青霉素条件下叶片分化情况
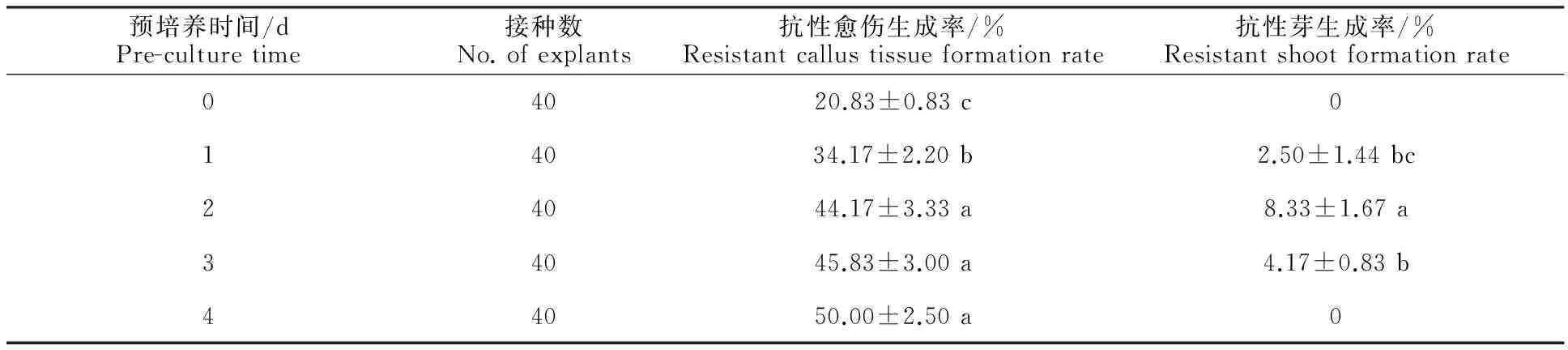
表4 不同预培养时间下的转化情况
注:农杆菌菌液OD600=0.5,侵染时间8 min,共培养2 d,延迟培养3 d。
Note:BacteriumOD600=0.5, infected for 8 min, co-cultured for 2 d, delaye-cultured for 3 d.
2.5 侵染时间的确定
农杆菌侵染叶片时一般情况下选择菌液OD600约为0.5~0.6,此时农杆菌活性最强,最适宜侵染。所以在此基础上设置不同的侵染时间,如表5所示,侵染时间为8、10 min时抗性愈伤生成率较高,显著高于其他处理(P<0.05),而侵染8 min时的抗性芽生成率最高,显著高于其他处理(P<0.05),同时在试验过程中观察发现,侵染时间较短,不利于菌液附着在叶片上,使得菌液对于叶盘的侵蚀作用不明显;而侵染时间过长时,菌液极有可能会大面积侵蚀叶片,使得在接下来的培养中产生叶片软腐现象,难以形成抗性愈伤和抗性芽。所以选择8 min作为最适侵染时间。
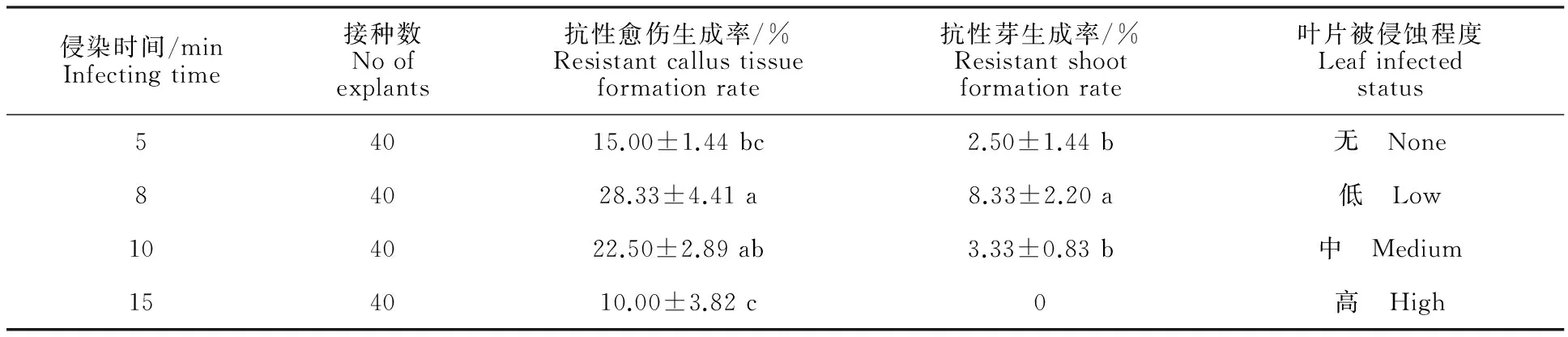
表5 不同侵染时间下的转化情况
注:农杆菌菌液OD600=0.5,预培养2 d,共培养2 d,延迟培养3 d。
Note: BacteriumOD600=0.5, pre-cultured for 2d, co-cultured for 2d, delaye-cultured for 3 d.
2.6 共培养时间的确定
试验结果表明,共培养1 d时,抗性愈伤生成率较低,并且没有抗性芽生成(表6),说明菌液并没有有效地侵染叶片;共培养2 d时,抗性愈伤和抗性芽都显著高于其他处理(P<0.05)。同时,试验过程中发现,共培养1 d时很难观察到菌落的形成,叶片几乎没有变化,而随着共培养时间的增加,能明显观察到菌落开始附着在叶片上,但4 d 时叶片已经受到严重侵蚀,叶片难以继续培养。所以选择2 d作为最适共培养时间。
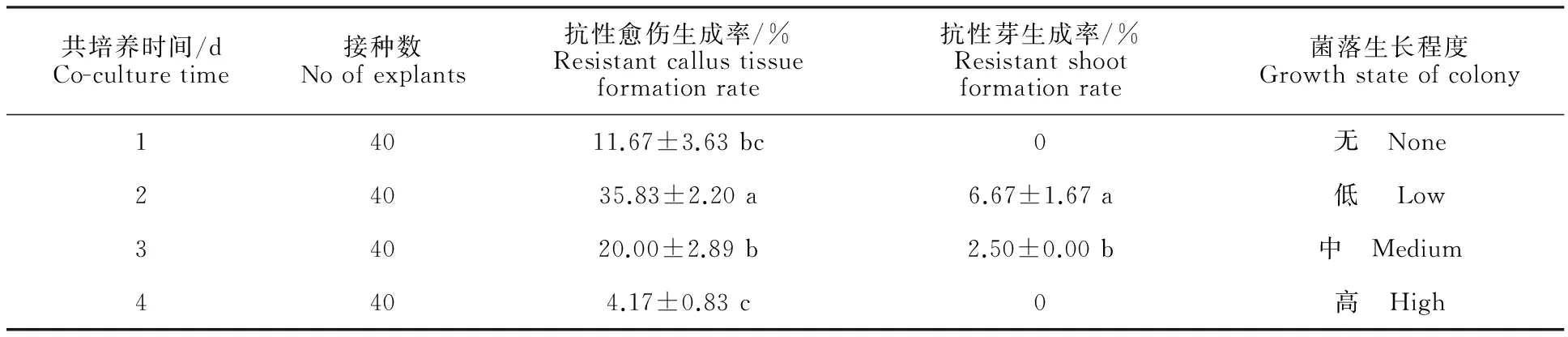
表6 不同共培养时间下的转化情况
注:农杆菌菌液OD600=0.5,预培养2 d,侵染时间8 min,延迟培养3 d。
Note:BacteriumOD600=0.5, pre-cultured for 2 d, infected for 8 min, delaye-cultured for 3 d.
2.7 延迟培养时间的确定
延迟培养是经过共培养之后的叶片不直接加入选择压(即卡那霉素),只是先进行脱菌培养,一段时间后再加入选择压,既有利于转化细胞的生长,又不会产生较多嵌合体。延迟培养是必不可少的过程,若不经过延迟培养而直接筛选叶片,容易将已转化的细胞直接筛死,增加转化难度。由表7可以看出,随着延迟培养时间的增加,愈伤生成率逐渐增加,但抗性芽生成率是先升高后降低,在3 d时达到最大值,与其他处理差异显著(P<0.05)。在试验过程中发现,虽然延迟培养4 d时,愈伤组织形成率比较高,但由于延迟培养时间过长,导致未转化细胞长势强,假阳性苗增多,一段时间筛选后假阳性苗逐渐白化筛死,增加了筛选工作量。所以选择3 d作为最适延迟培养时间。“地被菊‘紫妍’抗性愈伤和抗性芽见图3”。

表7 不同延迟培养时间下的转化情况
注:农杆菌菌液OD600=0.5,预培养2 d,侵染时间8 min,共培养2 d。
Note:BacteriumOD600=0.5, pre-culture 2 d, infecting time 8 min, co-culture 2 d.
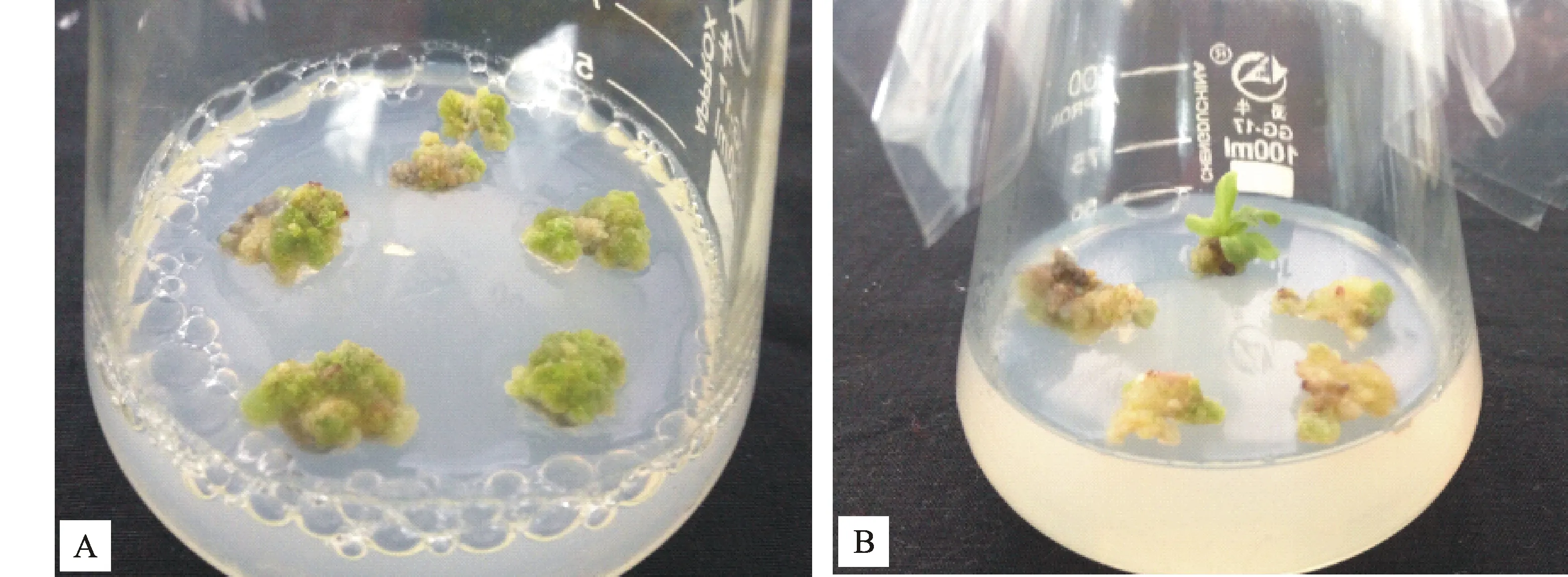
抗性愈伤组织(A);抗性芽(B) The resistant callus (A); The resistant shoots (B)
2.8 抗性植株的获得及鉴定
将筛选出的抗性苗转到含4 mg·L-1卡那霉素的生根培养基中进一步筛选(图4),淘汰不能生根的假阳性苗,植株经过筛选后,假阳性苗没有生根且茎叶黄化死亡,最终获得转基因苗11株,分别编号为1~11,提取转基因苗叶片基因组DNA,以其为模板,用ClCBF4基因特异性引物进行PCR检测后,将扩增产物在10 g/L的琼脂糖凝胶进行电泳检测。分析表明,其中有10株抗性苗在642 bp处扩增出与阳性对照相同长度的基因特异片段,而空白对照和未转基因的阴性对照中未扩增出条带,初步证实外源基因已转入地被菊‘紫妍’中,获得阳性单株10株(图5)。将转基因植株移至营养土中30 d后,生长状况良好(图6)。

抗性苗生根(A);抗性苗(B);假阳性苗(C)
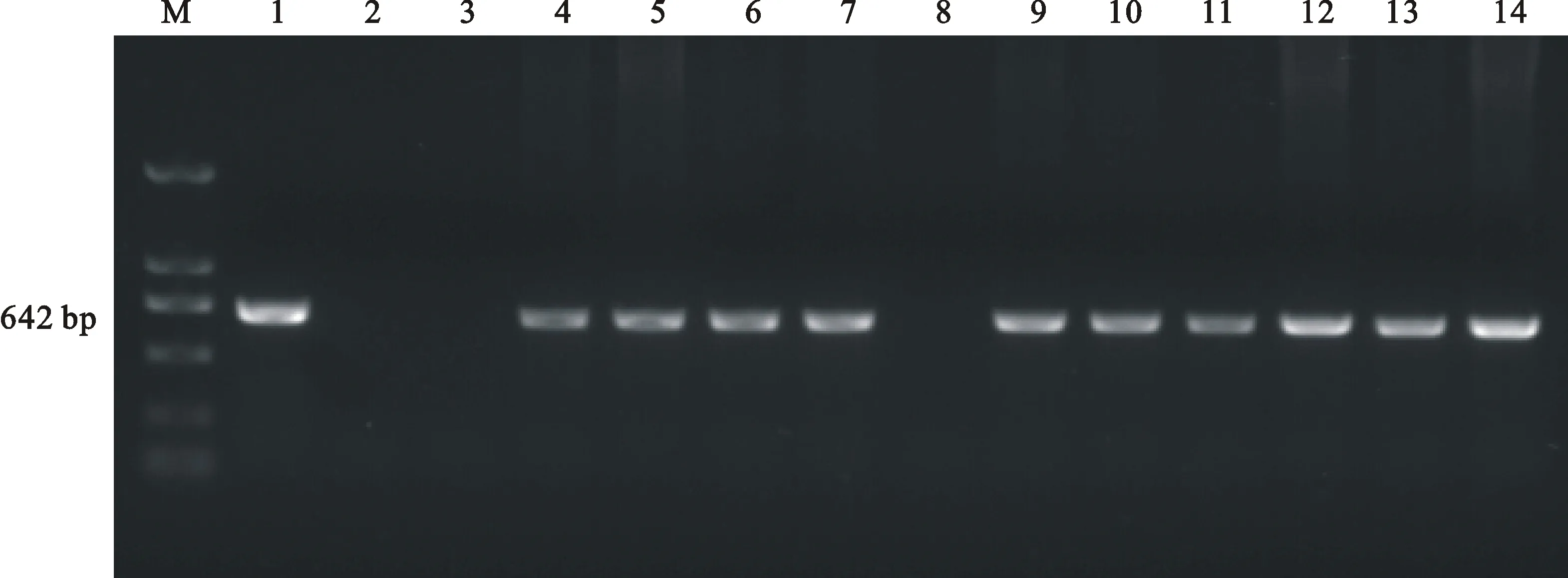
含有目的基因的质粒为阳性对照(1);阴性对照(2);空白对照(3);T1代的11个株系(4~14)

图6 转基因植株移栽后表型
3 讨 论
CBF转录因子与植物的抗逆性密切相关,在植物处于逆境条件时可对逆境胁迫相关基因的表达起调控作用,从而增强植物的抗逆性[14]。霍秀文等[15]从拟南芥中扩增得到CBF4的上游DNA片段,并与GUS基因融合构建双元表达载体,将其成功转入烟草后进行组织特异性检测后见明显的GUS活性,从而证明CBF4基因为干旱诱导型启动子。徐春波等[16-17]通过建立植物表达载体HpBPC26-CBF4,将克隆出的拟南芥CBF4基因利用基因枪法顺利转入蒙农杂种冰草中。李利斌等[18]从大白菜中克隆出同源基因BrCBF4,并对它的序列特征、蛋白结构和遗传进化体系进行分析,证明BrCBF4与拟南芥AtCBF4属同一个类群,且在功能上相似。刘杰从甘菊当中克隆出ClCBF4基因,在建立植物表达载体后成功转入拟南芥。为其他物种中CBF4基因克隆及转化的研究奠定基础。
在遗传转化体系的建立过程中,预培养时间、侵染时间、共培养时间、延迟培养时间的确定十分必要。若受体叶片转化前不进行预培养,叶片切口处因处于受伤状态而十分敏感,直接被菌液侵染会导致叶片因抵抗力差而无法正常生长甚至死亡。若预培养时间过长,叶片切口处有可能已经愈合,很难被菌液感染[19-20]。外源基因整合到T-DNA中不仅仅是靠菌液侵染的一段时间,转化中的共培养过程是外源基因导入的良好时机,在共培养过程中,由于黑暗条件和温度的适宜性,侵染时附着在受体叶片上的菌丝会迅速扩增,进一步侵染叶片伤口,增加转化几率。共培养时间对叶片的影响和侵染时间相似,若共培养时间过短,叶片不能很好感染菌液,不能产生抗性芽;若共培养时间过长,菌液增长速度很快,会发生大面积腐蚀叶片的现象,增加转后叶片死亡率。共培养过程中应及时观察,若出现菌落生长过快而腐蚀叶片时,应提早结束共培养,进入延迟培养阶段。延迟培养阶段所需要用到的一种抗生素是抑菌剂。常用的脱菌抗生素是头孢霉素和羧苄青霉素,虽然许多专家学者认为头孢霉素的加入在抑菌的同时也会抑制叶片分化[21],但绝大部分研究依然使用头孢霉素。本试验选取对叶片分化抑制较小的羧苄青霉素。试验从多角度分析后,选取羧苄霉素200 mg·L-1作为抑制农杆菌生长的最适质量浓度。对地被菊而言,常用的转后筛选剂是卡那霉素,使用质量浓度一般为0~50 mg·L-1,崔新利等[22]和许志茹等[23]分别利用潮霉素和甘露糖进行地被菊转后筛选,也得到很好的效果。适宜的筛选浓度是既能保证抗性芽和抗性植株不因筛选剂浓度过大而被筛死,又不能因浓度过小而增加后期继续筛选的工作量。很多品种地被菊的筛选都选取10 mg·L-1作为筛选质量浓度,与本试验结果略有差异,原因可能是地被菊品种不同,基因型不同,导致植株对于卡那霉素的反应程度不同,所以不同品种地被菊的适宜筛选剂浓度没有共用性和借鉴性[24]。
有的研究表明,转入高表达量的外源基因后植株的生长可能会发生畸形现象[25]。本试验将PCR鉴定得到的阳性植株扩繁后移栽到营养土中,30 d后观察发现植株长势良好,叶片较大、茎节粗壮。但转入的外源基因ClCBF4究竟调控哪些下游基因的表达以及植株转入该基因后的抗逆性还需进一步研究。
Reference:
[1] 戴思兰,王文奎,黄家平.菊属系统学与菊花起源研究进展[J].北京林业大学学报,2002,24(5/6):230-234.
DAI S L,WANG W K,HUANG J P.Advances of researches on phylogeny ofDendranthemaand origin ofChrysanthemum[J].JournalofBeijingForestryUnicersity,2002,24(5/6):230-234(in Chinese with English abstract).
[2] 陈发棣,房伟民,赵宏波,等.菊花新品种-地被菊系列[J].园艺学报,2005(6):1167-1168.
CHEN F L,FANG W M,ZHAO H B,etal.New varieties ofChrysanthemum-Ground Cover Varieties[J].ActaHorticulturaeSinica,2005(6):1167-1168(in Chinese with English abstract).
[3] 张晓娇,史春凤,李春水,等.转AtDREB1A基因地被菊杂交后代优株耐寒性分析 [J].园艺学报,2011,38(9):1717-1726.
ZHANG X J,SHI CH F,LI CH SH,etal.Cold stress tolerance of the filial generations produced byAtDREB1Atransgenic ground coverChrysanthemumand a conventional variety[J].ActaHorticulturaeSinica,2011,38(9):1717-1726(in Chinese with English abstract).
[4] MORRAN S,EINI O,PYVOVARENKO T,etal.Improvement of stress tolerance of wheat and barley by modulation of expression of DREB/CBF factors[J].PlantBiotechnolJournal,2011,9(2):230-249.
[5] 翟俊峰,王法微,王 南,等.月季CBF转录因子基因的克隆及表达分析[J].园艺学报,2012,39(8):1596-1602.
ZHAI J F,WANG F W,WANG N,etal.Cloning and expression profiling of the transcription factorCBFgene from rosa hybrida[J].ActaHorticulturaeSinica,2012,39(8):1596-1602(in Chinese with English abstract).
[6] SHAN W,KUANG J F,LU W J,etal.Banana fruit NAC transcription factor MaNACl is a direct target of MaICE1 and involved in cold stress through interacting with MaCBF1[J].PlantCell&Environment,2014.37(9):2116-2127.
[7] CHEN M,WANG Q Y,CHENG X G,etal.GmDREB2,a soybean DRE-Binding transcription factor,conferred drought and high-salt tolerance in transgenic plants[J].BiochemicalandBiophysicalResearchCommunications,2007,353(2):299-305.
[8] ZHOU M Q,SHEN C,WU L H,etal.CBF-dependent signaling pathway:a key responder to low temperature stress in plants[J].CriticalReviewsinBiotechnology,2011,31(2):186-192.
[9] 刘 杰.甘菊ClCBF家族基因分离及其对拟南芥的转化[D].哈尔滨:东北林业大学,2013.
LIU J.Isolation ofCBFfamily genes fromChrysanthemumlavandulifoliumand transformation studies ofClCBFinArabidopsisthaliana[D].Harbin:Northeast Forestry University,2013(in Chinese with English abstract).
[10] 肖 政,范崇辉,金万梅.根癌农杆菌介导转录因子CBF1基因对菊花的转化[J].西北农业学报,2009,18(6):262-267.
XIAO ZH,FAN CH H,JIN W M.Agrobacterium-mediated transformation ofDeranthemamorifoliumTzvel.cv.Xiaojinhuang with transcription factorCBF1gene[J]ActaAgriculturaeBoreali-OccidentalisSinica,2009,18(6):262-267(in Chinese with English abstract).
[11] 向太和,王 琳,蒋 欢,等.发根农杆菌K599对菊花活体转化及其高效再生 [J].园艺学报,2011,38(7):1365-1370.
XIANG T H,WANG L,JIANG H,etal.Hairy roots induced byAgrobacteriumthizogenesK599 inChrysanthemumin vivo and plant regeneration from hairy roots [J].ActaHorticulturaeSinica,2011,38(7):1365-1370(in Chinese with English abstract).
[12] 储 俊,许 娜,张 强,等.农杆菌介导的药百合鳞片遗传转化体系的建立[J].草业学报,2011,20(6):164-169.
CHU J,XU N,ZHANG Q,etal.Establishment of anAgrobacteriumtumefaciens-mediated genetic transformation system ofLiliumspeciosum[J].ActaPrataculturaeSinica,2011,20(6):164-169(in Chinese with English abstract).
[13] SUN H J,UCHII S,WATANABE S,etal.A highly efficient transformation protocol for Micro-Tom,a model cultivar for tomato functional genomics[J].PlantCellPhysiol,2006,47(3):426-431.
[14] KNIGHT M R,KNIGHT H. Low-temperature perception leading to gene expression and cold tolerance in higher plants [J].NewPhytologist,2012,195(4):737-751.
[15] 霍秀文,米福贵,云锦凤,等.转录因子CBF4诱导型启动子的克隆及功能分析[J].分子植物育种,2005,3(3):363-368.
HUO X W,MI F G,YUN J F,etal.Clonging and functional analysis of an induced promoter of transcriptional factorCBF4fromArabidopsis[J] .MolecularPlantBreeding,2005,3(3):363-368(in Chinese with English abstract).
[16] 徐春波,王 勇,李兴酉,等.含有拟南芥转录因子CBF4基因植物表达载体的构建[J].草业科学,2010,27(6):88-92.
XU CH B,WANG Y,LI X Y,etal.Construction of plant expression vector containingArabidopsistranscription factorCBF4[J]PrataculturalScience,2010,27(6):88-92(in Chinese with English abstract).
[17] 徐春波,王 勇,赵来喜,等.基因枪法获得转CBF4基因蒙农杂种冰草的研究[J].中国草地学报,2013,35(5):24-28.
XU CH B,WANG Y,ZHAO L X,etal.Studies on transformation ofAgropyroncristatum×A.desertorumcv.Mengnong withCBF4by particle bombardment[J].ChineseJournalofGrassland,2013,35(5):24-28(in Chinese with English abstract).
[18] 李利斌,刘立锋,王殿峰,等.大白菜CBF4基因的克隆和遗传进化分析[J].山东农业科学,2009(4):1-4.
LI L B,LIU L F,WANG D F,etal.Cloning and phylogeny analysis of Chinese cabbage geneCBF4[J].ShandongAgriculturalSciences,2009(4):1-4(in Chinese with English abstract).
[19] DUTT M,MADHAVARAJ J,GROSSER J W,etal.Agrobacteriumtumefaciens-mediated genetic transformation and plant regeneration from a complex tetraploid hybrid citrus root stocks[J].ScientiaHorticulturae,2010,123(4):454-458.
[20] PUSHYAMI B,BEENA M R,SINBA M K,etal.In vitro regeneration and optimization of conditions forAgrobacterium-mediated transformation in jute,Corchoruscapsularis[J].JournalofPlantBiochemistryandBioteclmology,2011,20(1):39-46.
[21] YEPES I M,MITTAK V,SLIGHTOM J I,etal.Agrobacteriumtumefaciensversus biolistic mediated transformation of theChrysanthemumcv.Polaris and Golden Polaris with nuleocapsid protein genes of three tospovirus speciesm[J].ActaHorticulturae,1999,482:209-218.
[22] 崔新利,陈发棣,陈素梅.地被菊雨花勋章再生和遗传转化体系的建立[J].南京农业大学学报,2009,32(2):40-46.
CUI X L,CHEN F L,CHEN S M.Establishment of regeneration and transtormation system of groud-coverChrysanthemumYuhuaxunzhang[J] .JournalofNanjingAgriculturalUniversity,2009,32(2):40-46(in Chinese with English abstract).
[23] 许志茹,陈智华,姜艳东,等.露地菊离体再生体系建立及BrDFR基因遗传转化[J].园艺学报,2013,40(8):1517-1526.
XU ZH R,CHEN ZH H,JIANG Y D,etal.Establishment of the regeneration system and genetic transformation ofBrDFRgene inChrysanthemumcultivar[J].ActaHorticulturaeSinica,2013,40(8):1517-1526(in Chinese with English abstract).
[24] DA SLILVA J A T,SHINOYAMA H,AIDA R,etal.Chrysanthemumbiotechnology:Quo vadis?[J].CriticalReviewsinPlantSciences,2013,32(1):21-52.
[25] 郭惠明,李召春,张 晗,等.棉花CBF基因的克隆及其转基因烟草的抗寒性分析[J].作物学报,2011,37(2):286-293.
GUO H M,LI ZH CH,ZHANG H,etal.Cloning of cottonCBFgene and its cold tolerance expression in transgenic tobacco[J] .2011,37(2):286-293(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Establishment ofAgrobacteium-mediated Transformation System ofChrysanthemumgrandiflorum‘Ziyan’
ZHOU Yunwei, LIU Yu, MA Xin, GAO Wenjie and HE Miao
(College of Landscape Architecture, Northeast Forestry University,Harbin 150040, China)
Several factors, affectingAgrobacterium-mediated transformation ofChrysanthemumgrandiflorum‘Ziyan’ were studied based on the establishment of high efficient regeneration system.The results showed that the most suitable concentration of Km for leaf differentiation and plant rooting is 4 mg·L-1and 6 mg·L-1. The most suitable concentration of Carb for inhibiting the growth ofAgrobacteriumtumefaciensis 200 mg·L-1. The pre-culture time of 2 days and Co-culture for 2 days were beneficial for improving transformation frequency. The 8 min bacteria infection (OD600=0.5) with delay-culture of 3 days were found to be optimal selection for transgenic plantlets. It was confirmed by using gene PCR test that the vector was integrated into the regeneration genome ofChrysanthemumgrandiflorum‘Ziyan’ and the transgenicChrysanthemumgrandiflorumwhich were transplanted survived and grew well.
Chrysanthemumgrandiflorum; Genetic transformation;Agrobacteiumtumefaciens;ClCBF4
ZHOU Yunwei,female,professor.Research area:genetics resources of landscape plant.E-mail:dlzhyw@nefu.edu.cn
HE Miao, female,associate professor.Research area:genetics resources of landscape plant.E-mail:hemiao_xu@126.com
2016-04-20
2016-07-25
林业公益性行业科研专项经费资助(201404202);中央高校基本科研业务费(2572015EY03)。
周蕴薇,女,教授,研究方向为园林植物种质资源。E-mail:dlzhyw@nefu.edu.cn
何 淼,女,副教授,研究方向为园林植物种质资源。E-mail:hemiao_xu@126.com
日期:2016-12-12
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161212.1117.032.html
S682.1+1
A
1004-1389(2016)12-1861-09
Received 2016-04-20 Returned 2016-07-25
Foundation item Special Fund for Forest Scientific Research in the Public Welfare(No.201404202);Fundamental Research Funds for the Central Universities(No.2572015EY03).

