糖氧剥夺再灌注对PC12细胞自噬、凋亡的影响及意义
陈艾,陈芷,沈兴
(1西南医科大学附属医院,四川泸州646000;2西南医科大学)
糖氧剥夺再灌注对PC12细胞自噬、凋亡的影响及意义
陈艾1,陈芷2,沈兴1
(1西南医科大学附属医院,四川泸州646000;2西南医科大学)
目的 观察糖氧剥夺再灌注对PC12细胞自噬、凋亡的影响,探讨激活自噬调控神经元损伤修复的有效时间窗。方法 将高分化的大鼠肾上腺嗜铬细胞瘤PC12细胞随机分为四组,分别置于缺氧(1% O2、5% CO2、94% N2)环境中培养0 h(OGD 0 h组)、1 h(OGD 1 h组)、2 h(OGD 2 h组)、3 h(OGD 3 h组);换用含10%灭活胎牛血清的高糖双抗DMEM培养液,正常条件下继续培养,分别培养0、4、8、12 h;采用CCK-8法检测四组各时间点细胞增殖率,采用RT-PCR法检测自噬基因微管相关蛋白2轻链3(LC3-Ⅱ)、凋亡基因Caspase-3相对表达量。结果 OGD 1 h组灌注后各时间点细胞增殖率均高于同时间点OGD 2 h及OGD 3 h组,组间比较P均<0.05;三组再灌注4、8、12 h时细胞增殖率均逐渐降低(P均<0.05),0、4 h时细胞增殖率比较差异无统计学意义(P均>0.05)。四组再灌注4 h时LC3-Ⅱ相对表达量均低于同组0 h,OGD 1 h、OGD 2 h组再灌注4 h时Caspase-3相对表达量均低于同组0 h,OGD 1 h、 OGD 2 h组再灌注12 h时LC3-Ⅱ、Caspase-3相对表达量均高于同组4、8 h,组间及组内比较P均<0.05。结论 糖氧剥夺再灌注可诱导PC12细胞发生自噬及凋亡,半暗带修复时间窗以糖氧剥夺4 h内为宜。
脑缺血再灌注损伤;糖氧剥夺再灌注;PC12细胞;微管相关蛋白2轻链3;Caspase-3
脑缺血再灌注损伤(CIRI)是儿科常见的病理现象,涉及各年龄段儿童,可继发于新生儿围产期窒息,亦可继发于阿斯综合征、重度脱水、感染等各种原因导致的休克,致残率极高[1];CIRI发生后有效时间窗内进行半暗带神经元修复是其治疗的重点[2]。有研究认为,轻度缺氧能诱发适度自噬,促使神经元自我清除代谢产物而发挥神经保护作用;缺氧严重则诱导过度自噬,促进神经元加速向凋亡及坏死进展[3]。大鼠肾上腺嗜铬细胞瘤PC12细胞是一类具有交感神经元特性的细胞,能分泌儿茶酚胺类递质[4];糖氧剥夺再灌注是诱导CIRI的常用实验方法。2014年1月~2016年1月,本研究观察了糖氧剥夺再灌注对PC12细胞自噬及凋亡的影响,现分析结果,探讨糖氧剥夺再灌注激活自噬调控神经元损伤修复的有效时间窗。
1 材料与方法
1.1 材料 高分化的PC12细胞株由四川大学妇幼研究所馈赠,本实验室冻存。高糖改良Eagle培养基(DMEM)、不含葡萄糖的DMEM购自美国Sigma公司,CCK-8试剂盒购于碧云天生物技术研究所。Maxi-MixⅡ试管震荡器(Barnstead/Thermolyne公司,美国),CO2培养箱(SANYOMCO15AC,日本),倒置相差显微镜(Olympus IX2-SLP,日本),三气培养箱(Thermo Scientific 3110,美国),FTC2000实时荧光定量基因扩增仪(枫岭公司,加拿大),MSE Micro-Centaur Centrifuge微型台式离心机(日本Sanyo公司),Gel Doc 1000凝胶成像系统(Gel Doc,BIO-RAD,USA)。
1.2 细胞培养及处理 冻存的PC12细胞复苏后吹打至单细胞悬液,接种于25 cm2细胞培养瓶,内含10%灭活胎牛血清的高糖双抗DMEM培养液(含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素),置于37 ℃、5% CO2、饱和湿度培养箱中培养。每2~3天换液1次,70%~80%满瓶时传代,继续培养。取第5~8代对数生长期细胞用于后续研究。建立细胞糖氧剥夺再灌注模型,具体步骤为将PC12细胞弃去原培养基,用预热PBS洗涤3次,加入无糖改良Eagle培养基,随机分为四组,分别置于缺氧(1% O2、5% CO2、94% N2)环境中培养0 h(OGD 0 h组)、1 h(OGD 1 h组)、2 h(OGD 2 h组)、3 h(OGD 3 h组);换用含10%灭活胎牛血清的高糖双抗DMEM培养液,正常条件下继续培养,分别培养0、4、8、12 h。
1.3 相关指标观察
1.3.1 细胞增殖率检测 采用CCK-8法。调整各组各时间点细胞悬液密度至5×105个/mL,分别以100 μL/孔接种于96孔板中。每孔加入占培养体系总体积1/10的CCK-8试剂,37 ℃、5% CO2孵箱中孵育0.5 h,在ELX-800全自动酶标仪上检测450 nm波长处的光密度(OD)值。每组6孔,实验重复3次,结果取平均值。以正常培养细胞的OD值为基数100%,计算各组细胞增殖率。细胞增殖率=观察孔OD值/基线对照孔OD值×100%。
1.3.2 LC3-Ⅱ、Caspase-3基因表达检测 采用RT-PCR法。提取1.2中各时间点细胞的RNA,对提取的总RNA进行1%琼脂糖凝胶电泳检验,利用逆转录酶反转录成cDNA。采用Fermentas公司的Revert AidTMFrist Strand cDNA Synthesis Kit在PCR仪上进行扩增。反应体系为30 μL:10×buffer 3 μL、MgCl2(25 mmol/L)3 μL、dNTP(25 mmol/L)0.36 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、探针(10 μmol/L)1 μL、Taq酶(5 U/μL)0.3 μL、ddH2O 15.34 μL、cDNA模板5 μL。引物序列、退火温度及产物大小见表1。将原始数据(Ct值)采用2-ΔCt换算为基因的相对表达量。

表1 引物序列、退火温度及产物大小

2 结果
2.1 各组再灌注后不同时间点细胞增殖率比较OGD1h组灌注后各时间点细胞增殖率均高于同时间点OGD2h组及OGD3h组,组间比较P均<0.05;三组再灌注4、8、12h时细胞增殖率均逐渐降低(P均<0.05),0、4h时细胞增殖率比较差异均无统计学意义(P均>0.05)。见表2。
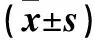
表2 各组再灌注后不同时间点细胞增殖率
2.2 各组再灌注后不同时间点LC3-Ⅱ、Caspase-3相对表达量比较 四组再灌注4 h时LC3-Ⅱ相对表达量均低于同组0 h,OGD 1 h、2 h组再灌注4 h时Caspase-3相对表达量均低于同组0 h,OGD 1 h、2 h组再灌注12 h时LC3-Ⅱ、Caspase-3相对表达量均高于同组4、8 h,组间及组内比较P均<0.05。见表3。

表3 各组再灌注后不同时间点LC3-Ⅱ、Caspase-3相对表达量
3 讨论
生理情况下细胞内存在低水平自噬,以维持细胞正常代谢及稳态。当CIRI发生时,自噬会清除无功能的细胞器以维持神经元稳态,防止其快速凋亡,从而为半暗带的修复赢得时间[5],改善预后。半暗带区脑组织可见暗神经元、神经元肿胀、星形胶质细胞和小胶质细胞反应,而细胞骨架正常或轻微改变且持续存在于损伤梗死区边缘。Hudak等[6]报道,半暗带中的细胞呈现细胞内水肿,且随时间的延长水肿逐渐加重,但范围相对缩小。电镜下可见细胞器肿胀,而血脑屏障完整。半暗带有效抢救时间一般认为是在血脑屏障保持完整之前,即缺血后4~6 h;但不同缺血缺氧程度可能在不同时间激活自噬与凋亡,且打击程度诱发自噬及凋亡的程度也不同[7,8],因此本研究分别给予PC12细胞缺糖氧剥夺1、2、3 h,以模拟细胞的轻、中、重度缺血缺氧损伤。在神经元缺血再灌注损伤中,自噬、凋亡、坏死的动态过程一直是研究者关注的焦点[9]。有学者认为凋亡与自噬可以相互转化,因此如何将进入凋亡程序的细胞诱导为自噬,是神经元修复的重点[10]。亦有学者认为自噬—凋亡—坏死只能以射线顺序发生,不可逆转或者循环[11]。因此神经损伤修复的重点是诱导加强适度自噬,以抑制凋亡发生。
适度自噬是对抗CIRI的机制之一[12],即当遭遇营养缺乏、氧气剥夺等应激时,细胞会产生单层或双层膜结构包裹胞内受损细胞器形成自噬前体,逐渐延伸封闭形成自噬小体,与溶酶体对接融合形成自噬溶酶体,最后其内受损细胞器被溶酶体降解成小分子物质循环使用。自噬小体中存在14 kD的LC3Ⅱ,因此存在于细胞质中的LC3-Ⅱ被认为是细胞发生自噬的分子标志,且LC3-Ⅱ含量与发生自噬的程度呈正比[13]。本研究结果显示,OGD 1、2、3 h组PC12细胞在复氧4 h内细胞增殖率比较无明显统计学差异,复氧4 h后细胞增殖率均下降。肖君等[14]研究发现,原代培养的新生大鼠大脑皮质星形胶质细胞在缺氧6 h、复氧48 h内星形胶质细胞的细胞活力未发生明显改变。糖氧剥夺2 h内,PC12细胞的凋亡基因Caspase-3表达逐渐增多,提示虽然CCK-8法检测细胞增殖活性尚可,但实际上细胞已经开始出现糖氧剥夺应激损伤产生的代谢产物。与此同时,OGD 1 h、OGD 2 h组PC12细胞自噬基因LC3-Ⅱ表达无明显改变,提示此阶段细胞的自噬能力大于其代谢产物的产生,可清除细胞废弃物,使细胞耐受2 h以内的糖氧剥夺造成的细胞器破坏,以保持细胞增殖活力。进一步动态观察再灌注12 h内细胞增殖、自噬、凋亡的变化,结果显示OGD 0 h组Caspase-3于再灌注不同时间未出现表达量的明显波动;LC3-Ⅱ在再灌注4 h表达量最低,细胞活力也是从再灌注4 h急转向下。提示随着糖氧剥夺时间延长,其代谢产物增加,自噬负荷增加,细胞启动适度自噬维持稳态的能力逐渐减弱,在再灌注4 h时降至最低,半暗带的修复可能在应激后4 h内更有效。再灌注>4~8 h阶段,自噬及凋亡基因均进入稳定表达期,再灌注8、12 h时,虽然LC3-Ⅱ及Caspase-3表达增加,但细胞增殖率下降;提示此时细胞崩解的速度以及代谢产物的产生已经远远超过自噬所能承载,故即使细胞加强自我保护的调控程序,也难以维持细胞活力。虽然LC3-Ⅱ与Caspase-3于再灌注过程中的表达趋势相似,但与OGD 0 h组相比,再灌注后各时间点各组LC3-Ⅱ相对表达量均降低,而OGD 1 h、OGD 2 h组Caspase-3相对表达量均高于OGD 0 h组;提示随着缺氧程度的加重,在一定代偿范围内凋亡越强自噬能力越弱。自噬抑制剂3-甲基腺嘌呤可导致经糖氧剥夺处理的皮质神经元存活率降低,Caspase-3表达上调;而加入自噬增强剂雷帕霉素组,皮质神经元存活率升高,Caspase-3表达下调[15]。上述结果提示,在缺血缺氧脑损伤早期启动自噬可抑制神经元凋亡,产生内源性神经保护作用;当超过细胞代偿范围即自噬能承载的代谢产物处理量,细胞迅速崩解坏死。一旦缺血缺氧应激出现,自噬和凋亡是神经元细胞同时启动的自我保护程序,在探索自噬与凋亡的动态关系时一定要权衡应激程度与耐受时间的平衡,应激程度越重,自噬效能越弱,细胞可耐受时限越短。
综上所述,糖氧剥夺再灌注可诱导PC12细胞发生自噬及凋亡,半暗带修复时间窗以糖氧剥夺后再灌注4 h内为宜。
[1] 齐军,李峰.缺血再灌注脑损伤机制及治疗进展[J].卒中与神经疾病,2015,22(2):120-122.
[2] Green DR, Oguin TH, Martinez J. The clearance of dying cells: table for two[J]. Cell Death Differ, 2016,23(6):915-926.
[3] Caberlotto L, Nguyen TP. A systems biology investigation of neurodegenerative dementia reveals a pivotal role of autophagy[J]. Bmc Systems Biology, 2014,8(1):1-15.
[4] 董琳,童煜,毛萌.PC12细胞氧糖剥夺/再灌注损伤中自噬与凋亡现象[J].实用儿科临床杂志,2012,27(18):1397-1401.
[5] Türei D, Földvári-Nagy L, Fazekas D, et al. Autophagy regulatory network-a systems-level bioinformatics resource for studying the mechanism and regulation of autophagy[J]. Autophagy, 2015,11(1):155-165.
[6] Hudak AM, Peng L, de la Plata CM, et al. Cytotoxic and vasogenic cerebral oedema in traumatic brain injury: assessment with FLAIR and DWI imaging[J]. Brain Inj, 2014,28(12):1602-1609.
[7] 罗振钊,王静,孔曼,等.神经元损伤度对小胶质细胞表型的影响[J].华中科技大学学报(医学版),2015(1):47-51.
[8] Tang D, Wang C, Gao Y, et al. Deep hypothermia-enhanced autophagy protects PC12 cells against oxygen glucose deprivation via a mitochondrial pathway[J]. Neurosci Lett, 2016,6(632):79-85.
[9] Lalaoui N, Lindqvist LM, Sandow JJ, et al. The molecular relationships between apoptosis, autophagy and necroptosis[J]. Semin Cell Dev Biol, 2015(39):63-69.
[10] Chen H, Tang B, Qu Y, et al. Progress and extensive meaning of mammalian target of rapamycin involved in restoration of nervous system injury[J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2012,26(5):625-630.
[11] Kenney DL, Benarroch EE. The autophagy-lysosomal pathway: general concepts and clinical implications[J]. Neurology, 2015,85(7):634-645.
[12] Thapalia BA, Zhou Z, Lin X. Autophagy, a process within reperfusion injury: an update[J]. Int J Clin Exp Pathol, 2014,7(12):8322-8341.
[13] 褚迎欣,张建凯,程光,等.饥饿对大鼠大脑皮质自噬相关蛋白 LC3、Beclin 1表达的影响[J].山东医药,2015,55(30):23-25.
[14] 肖君,张函,谢敏杰,等.缺氧/复氧条件下体外培养星形胶质细胞神经生长因子分泌的变化[J].神经损伤与功能重建,2015,10(1):1-4.
[15] 周迎,段满林.自噬在氧糖缺失早期诱发大鼠皮质神经元凋亡中的作用[J].中华麻醉学杂志,2014,34(12):1492-1494.
Effects of oxygen and glucose deprivation-reperfusion on autophagy and apoptosis of PC12 cells
CHENAi1,CHENZhi,SHENXing
(1TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To observe the effects of oxygen and glucose deprivation-reperfusion (OGD/OGD-R) on autophagy and apoptosis of PC12 cells, and to evaluate the effective time window of OGD/OGD-activated autophagy-regulated neuron injury repair. Methods The high differentiated PC12 cells were cultured under hypoxia (1% O2, 5% CO2, 94% N2) and then randomly divided into 4 groups which were respectively cultured for 0 h (OGD 0 h group), 1 h(OGD 1 h group), 2 h (OGD 2 h group), 3 h (OGD 3 h group), followed by persistent culture in high glucose Dulbecco′s modified Eagle′s medium (DMEM) which supplemented with 10 % fetal bovine serum for another 0, 2, 4, 8, 12 h, respectively. The cell viability was analyzed by CCK-8. The expression of microtubule-associated protein 2-light chain 3 (LC3Ⅱ) and Caspase-3 gene of PC12 cells in each group at different time was detected RT-PCR. Results At each oxygen-glucose reperfusion time point, the cell viability of OGD 1 h group was higher than that of OGD 2 h and OGD 3 h group, the difference was statistically significant between these groups (allP<0.05). The cell viability of each OGD group gradually decreased as the reperfusion duration till to 4, 8 and 12 h, the difference was statistically significant between these time points (allP<0.05), except the comparison between 0 h and 4 h (allP>0.05). The relative expression of LC3Ⅱgene at reperfusion of 4 h (R4H) was lower than that of 0 h in each reperfusion groups including the control group. The relative expression of Caspase-3 gene at R4H was lower than that of R0 h in OGD 1 h and OGD 2 h groups respectively. The relative expression of LC3Ⅱand Caspase-3 gene at R12H in the OGD 1 h and OGD 2 h groups was higher than that at R4H and R8H, and the difference between groups and within groups was statistically significant (allP<0.05). Conclusions OGD-R can induce the autophagy and apoptosis of PC12 cells. The penumbra repair time window is advised to be less than 4 hours after oxygen and glucose deprivation.
cerebral ischemia-reperfusion injury; oxygen and glucose deprivation-reperfusion; PC12 cells; microtubule-associated protein 2-light chain 3; Caspase-3
四川省卫生和计划生育委员会科研课题重点项目(15018);四川省科技厅项目(2014TSX-0028);西南医科大学附属医院人才基金(201301E)。
陈艾(1978-),女,副教授,研究方向为小儿神经病学。E-mail: zuoma78@163.com
10.3969/j.issn.1002-266X.2016.44.006
R722
A
1002-266X(2016)44-0020-04
2016-03-30)

