XPG基因表达用于法医学年龄推断
邓小冬,张伟,张波,马英,木尔扯尔,章丽霞,谢英,刘云
(1.川北医学院法医学系,四川南充 637000;2.川北医学院附属医院神经内科,四川南充 637000)
XPG基因表达用于法医学年龄推断
邓小冬1,张伟1,张波1,马英2,木尔扯尔1,章丽霞1,谢英1,刘云1
(1.川北医学院法医学系,四川南充 637000;2.川北医学院附属医院神经内科,四川南充 637000)
目的探讨着色性干皮病G组(xeroderma pigmentosum group G,XPG)基因在不同年龄段健康汉族人群中的表达情况,分析XPG mRNA和蛋白表达量与年龄之间的相关性,以期为法医学年龄推断提供新的分子生物学指标。方法收集150名不同年龄段健康汉族人的外周血样,采用TRIzol法提取外周血单个核细胞(peripheral blood mononuclear cell,PBMC)总RNA,通过实时荧光定量PCR检测XPG mRNA在PBMC的相对表达量,酶联免疫吸附试验检测XPG蛋白在血浆中的表达量。结果XPG mRNA及其蛋白表达量在≤18岁组与19~45岁组之间、≤18岁组与≥46岁组之间的差异均有统计学意义(P<0.05),但19~45岁组与≥46岁组之间的差异无统计学意义(P>0.05)。XPG mRNA和蛋白表达量均无性别差异(P>0.05)。结论XPG mRNA在PBMC的相对表达量在低龄段内随年龄增加而下降,其血浆中蛋白随年龄增加而升高;XPG基因有望成为法医学年龄推断的新型指标之一。
法医遗传学;法医人类学;着色性干皮病G组;实时荧光定量PCR;酶联免疫吸附试验;年龄推断
为克服形态学方法推断个体年龄的局限性,近年来利用分子生物学技术探寻法医学年龄推断的新型指标引起研究者的广泛关注,主要集中在端粒长度变化、线粒体DNA损伤、氨基酸外消旋法、DNA甲基化程度等[1-5],但以上研究多为趋势化分析,缺乏定量研究。因此,积极探寻年龄推断的新指标,建立与年龄相关的数学模型至关重要。
研究[6-7]发现,着色性干皮病G组(xeroderma pigmentosum group G,XPG)在DNA损伤修复中扮演着重要角色。一方面,XPG基因是核苷酸切除修复(nu-cleotide excision repair,NER)通路的限速酶,具有特异性核酸内切酶活性,切除损伤DNA的3′端[6];另一方面,XPG基因在碱基切除修复(base excision repair,BER)途径中激活DNA糖基化酶参与修复氧化应激所致的DNA损伤[7]。NER和BER是DNA损伤修复系统中最重要的修复途径,故XPG基因的转录和翻译水平可在一定程度上反映DNA损伤修复能力或效率。近年来,研究[8-9]报道DNA损伤修复能力随着年龄增加而逐渐下降,其中NER和BER途径最为突出。动物实验[10-11]发现XPG基因缺陷模型小鼠出现早衰现象,认为XPG基因缺陷严重影响DNA修复能力及其活性,导致体内蓄积大量有害物质,阻碍基因的转录和复制,影响基因组的稳定性,加速了机体衰老。因此,推测XPG基因转录和翻译水平与年龄存在一定相关性。本研究拟通过实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)检测XPG mRNA在不同年龄段健康汉族人群外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的相对表达量,采用酶联免疫吸附试验(ELISA)检测XPG蛋白在血浆中的表达水平,分析XPG mRNA及其蛋白表达量与年龄之间的相关性,为建立XPG基因表达与年龄之间的数学模型奠定基础,以期为法医学年龄推断提供新的分子生物学指标。
1 材料与方法
1.1 研究对象
采集健康汉族人群外周血样150份,其中男性73例,女性77例;年龄≤18岁50例、19~45岁70例、≥46岁30例。以上样本均来源于川北医学院附属医院健康体检中心和产科住院部(所有样本的采集均为知情同意)。
1.2 主要仪器及试剂
7900型实时荧光定量PCR仪(美国AB公司),Benchmark酶标仪(美国Bio-Rad公司),NanoDrop 2000紫外分光光度仪(美国Thermo Fisher Scientific公司)。2×Taq PCR MasterMix试剂盒、琼脂糖凝胶DNA回收试剂盒[天根生化科技(北京)有限公司],Human XPG ELISA试剂盒(武汉优尔生科技股份有限公司),人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),RNAiso Plus试剂(日本TaKaRa公司),PrimeScript®RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(日本TaKaRa公司)。RT-qPCR引物采用Primer Premier 5.0和Oligo 6.0软件自行设计(表1),所用引物由日本TaKaRa公司合成。

表1 XPG基因和β-actin基因RT-qPCR引物序列
1.3 总RNA提取、鉴定及逆转录合成cDNA
用人外周血淋巴细胞分离液分离出PBMC,按RNAiso Plus操作说明书提取总RNA。采用NanoDrop 2000紫外分光光度仪测定总RNA纯度和浓度,经琼脂糖凝胶电泳鉴定总RNA完整性。选取纯度高、完整性好的总RNA,按逆转录试剂盒(PrimeScript®RT reagent Kit with gDNA Eraser)操作说明书分两步逆转录合成cDNA。
1.4 XPG mRNA在PBMC中相对表达量的检测
1.4.1 标准曲线制作
按2×Taq PCR MasterMix试剂盒操作说明书扩增XPG和内参β-actin基因,琼脂糖凝胶电泳确定模板cDNA的质量及引物特异性;根据目标条带大小分别切下XPG和β-actin基因电泳条带,按琼脂糖凝胶DNA回收试剂盒操作说明书纯化PCR产物;将纯化后的PCR产物(标准品)用纯水10倍梯度稀释6个浓度,按SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒操作说明书建立PCR反应体系和条件,并在7900型实时荧光定量PCR仪上制作XPG和βactin基因的标准曲线。PCR扩增体系:SYBR Green Mix 10 μL,DyeⅡ0.4 μL,上下游引物(pmol/μL)各0.8 μL,标准品(PCR纯化产物)2 μL,加ddH2O至20 μL。PCR扩增条件:95℃15 s预变性;95℃5 s,60℃30s,共40个循环。扩增反应结束后,进行融解曲线分析,融解条件:95℃15s,60℃30s,95℃15s,1个循环。
1.4.2 XPG mRNA相对表达量检测
取待测样本的cDNA溶液2.0μL,加入与标准曲线制作完全相同的PCR体系中,与标准品在相同反应条件下进行PCR扩增。每个样本复孔3个,并设定无cDNA样品的空白管作为阴性对照。用7900型实时荧光定量PCR仪自动收集荧光信号,得出目的基因(XPG基因)和内参基因(β-actin基因)的Ct值及相关曲线,采用2-ΔΔCt法计算XPG mRNA的相对表达量。
1.5 XPG蛋白在血浆中表达量的检测
按Human XPG ELISA试剂盒操作说明书在Benchmark酶标仪上检测并收集待测样本的光密度(D)值。以调整后的标准品D值为横坐标(x),以标准品浓度为纵坐标(y),绘制标准曲线并求得拟合曲线方程式,将待测样品的D值代入方程式即可求得血浆中XPG蛋白表达量。
1.6 统计学处理
2 结果
2.1 RT-qPCR扩增特异性与扩增效率
熔解曲线显示β-actin和XPG基因扩增片段的熔点分别为86.0℃和85.9℃,熔解曲线呈单峰,峰形窄而尖,无杂峰,表明扩增产物特异性良好。标准曲线是10倍梯度稀释β-actin和XPG后进行PCR扩增形成,其拟合优度(R2)分别为0.9952和0.9998,斜率分别为-3.3394和-3.5271,直线拟合度好,PCR反应体系和条件适宜,可在较宽广范围内进行定量分析。
2.2 标准曲线的建立
XPG蛋白标准曲线的拟合优度(R2)为0.999 5;曲线拟合方程为y=1.1769x2+2.3859x+0.2527。
2.3 XPG mRNA在不同年龄段PBMC中的表达水平
XPG mRNA在不同年龄段PBMC中的相对表达量见表2。经检验,XPG mRNA的相对表达量在≤18岁组与19~45岁组之间、≤18岁组与≥46岁组之间的差异均具有统计学意义(P<0.05),但19~45岁组与≥46岁组之间的差异无统计学意义(P>0.05)。另外,XPG mRNA的相对表达量在性别间差异无统计学意义(P>0.05)。
表2 XPG mRNA在PBMC中的相对表达量(±s)
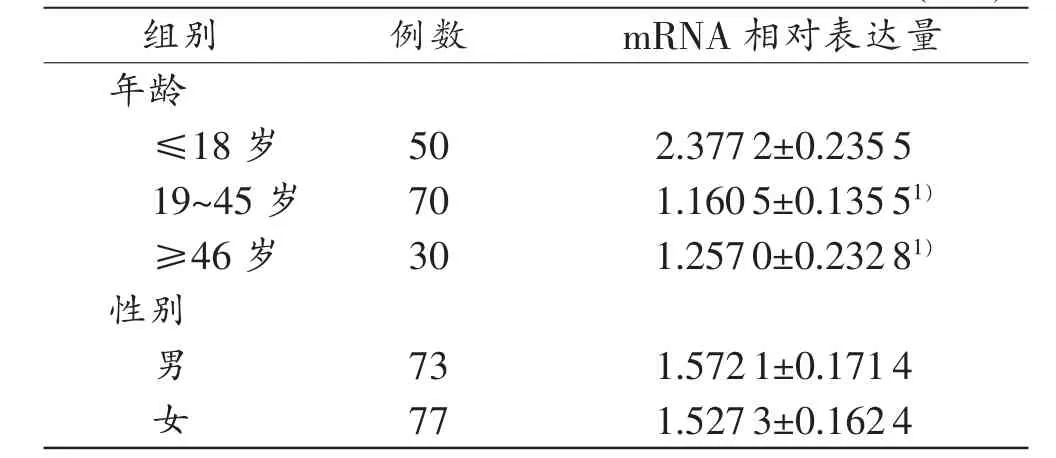
表2 XPG mRNA在PBMC中的相对表达量(±s)
注:1)与≤18岁组比较,P<0.05
组别例数mRNA相对表达量年龄≤18岁502.3772±0.2355 19~45岁701.1605±0.13551)≥46岁301.2570±0.23281)性别男731.5721±0.1714女771.5273±0.1624
2.4 XPG蛋白在不同年龄段血浆中的表达水平
XPG蛋白在不同年龄段血浆中的表达量见表3。XPG蛋白表达量在≤18岁组与19~45岁组之间、≤18岁组与≥46岁组之间的差异均具有统计学意义(P<0.05),但19~45岁组与≥46岁组之间的差异无统计学意义(P>0.05)。另外,XPG蛋白表达量在性别间差异无统计学意义(P>0.05)。
表3 XPG蛋白在血浆中的表达量(±s)
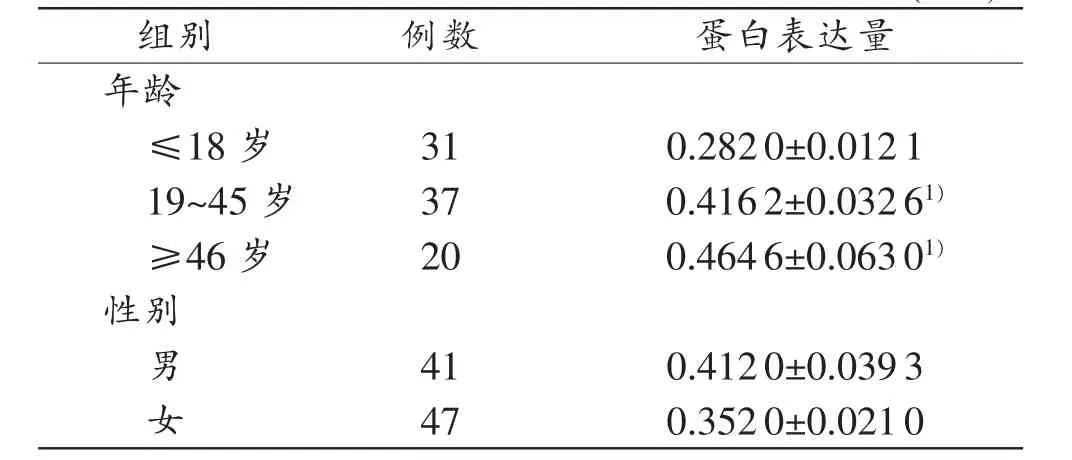
表3 XPG蛋白在血浆中的表达量(±s)
注:1)与≤18岁组比较,P<0.05
组别例数蛋白表达量年龄≤18岁310.2820±0.0121 19~45岁370.4162±0.03261)≥46岁200.4646±0.06301)性别男410.4120±0.0393女470.3520±0.0210
2.5 XPG基因表达水平与年龄的相关性
回归分析结果显示,XPG mRNA的相对表达量与≤45岁年龄呈负相关(r=-0.811,P<0.05)。以年龄为自变量(x),mRNA表达量为因变量(y),拟合曲线为y=0.001 x2-0.116 2 x+3.439 9(R2=0.760 4,P<0.05)。然而,XPG蛋白表达量与≤45岁年龄呈正相关(r= 0.662,P<0.05);以年龄为自变量(x),蛋白表达量为因变量(y),拟合曲线为y=0.000075x2+0.0005x+0.2017(R2=0.336 4,P<0.05)。XPG mRNA和蛋白表达量与≥46岁年龄相关性无统计学意义(P>0.05)。
3 讨论
本研究结果显示,XPG mRNA的相对表达量在低龄段间的差异有统计学意义(P<0.05),且回归分析显示XPG mRNA的相对表达量在低龄段内随年龄增加而下降,说明XPG mRNA表达量与年龄有关,其机制可能是:(1)XPG基因作为NER通路的限速酶,其mRNA随年龄下降,导致NER修复能力降低,引起体内有害物质的大量蓄积,上调p53基因表达,诱导细胞凋亡;同时,激活p21CIP1/WAF1基因表达使细胞周期停止在G2期,造成DNA合成与复制受阻,抑制细胞增殖,最终出现衰老、死亡[12]。研究[6]报道,XPG基因敲除小鼠和XPG基因定点突变小鼠均出现早衰、体质量下降(为正常小鼠的60%)和神经退行性变等现象,且XPG基因敲除小鼠生存时间明显低于定点突变小鼠,两者体内均堆积大量紫外线损伤产物,如环丁烷嘧啶二聚体(cyclobutane pyrimidine dimer,CPD)和6-4光产物(6-4 photoproduct,6-4PP),表明XPG基因缺失或突变引起NER修复能力明显下降,致使CPD和6-4PP等产物蓄积,最终导致机体早衰。(2)XPG mRNA表达下降的原因可能与基因突变有关。研究[8-13]发现,淋巴细胞NER修复能力每年降低约0.61%,其DNA突变能力每年增长约0.6%。XPG基因常见多态性可能通过转录区或转录调节区直接或间接影响XPG基因转录水平或稳定性,下调其mRNA表达水平,从而降低NER修复能力,最终启动衰老途径[12]。(3)XPG基因甲基化程度可影响其mRNA表达。有研究[14-15]报道,XPG基因启动区甲基化能阻止转录因子与启动子(增强子)结合而抑制mRNA表达,导致NER修复能力降低。因此,随着年龄的增加,XPG mRNA表达水平和NER修复能力均下降,相互之间形成恶性循环,影响细胞增殖和基因组稳定性,最终导致机体衰老。
本研究前期运用RT-qPCR检测PBMC中XPG mRNA表达水平时,发现XPG mRNA相对表达量在≤45岁年龄段与年龄呈负相关。为此,我们从不同年龄段中随机抽取部分血浆样本检测XPG蛋白的表达水平,结果显示XPG蛋白表达水平在≤45岁年龄段与年龄呈正相关,与XPG mRNA表达水平不一致,且呈截然相反的现象。为了验证这一结果,本研究继续从不同年龄段随机选取血浆样本进行检验,但结果依然没有改变,其原因可能与XPG蛋白翻译过程中或翻译后加工及修饰异常有关[16-17]。研究发现多细胞生物mRNA与蛋白水平相关性仅为0.09~0.46,mRNA水平仅能解释40%蛋白水平,另外60%受其他因素调控,如转录后翻译效率的改变[18]。随着年龄增加机体内分泌功能或内环境发生变化,可能刺激并提高了XPG蛋白翻译效率[18-19],最终出现了XPG蛋白不降反升的现象,但具体机制尚不清楚,有待进一步研究予以明确。
XPG mRNA和蛋白表达水平在≤45岁年龄段内与年龄相关性较好,而在≥46岁年龄段,其mRNA和蛋白表达水平与年龄相关性无统计学意义,表明XPG基因在年龄增加到某个时间段后,其mRNA和蛋白表达将趋于稳定。出现该现象的原因可能与以下因素有关:(1)本研究高龄组纳入样本量相对较少,可能造成统计学偏倚;(2)XPG mRNA和蛋白表达可能具有时序特异性,即只有到某一阶段其表达才会相对稳定[18];(3)XPG基因经过早期体内外有害物质的预适应,随着年龄增加可能产生了适应性表达,即XPG基因在45岁左右表达趋于稳定[20-21]。未来需加大样本量并从基因表达调控方面深入研究XPG基因表达规律。
回归分析显示,XPG mRNA相对表达量和蛋白表达水平与年龄(≤45岁)均呈现良好的相关性,XPG mRNA的相对表达量与年龄(≤45岁)呈负相关(r= -0.811),XPG蛋白血浆中表达量与年龄(≤45岁)呈正相关(r=0.662),且均不受性别差异的影响;其拟合曲线分别为y=0.001x2-0.1162 x+3.4399(R2=0.7604, P<0.05)、y=0.000075x2+0.0005x+0.2017(R2=0.3364,P<0.05)。故认为XPG mRNA和蛋白表达水平均有望成为≤45岁年龄段法医学年龄推断的有效指标之一。但本研究实际运用于法医学年龄推断时存在一定局限。首先,本研究样本量相对较少,尤其是≥46岁组,可能导致统计学偏倚;其次,人群结构较单一,仅纳入本地区汉族人群,不宜推广到所有人群中运用;另外,本研究随机选取不同年龄段部分血浆样本检测XPG蛋白表达水平,可能导致统计学偏倚,未来需在明确XPG基因表达调控机制的基础上,进一步加大样本量、丰富人群结构、细化年龄分组,深入研究XPG基因与年龄的关系,以便建立更好的数学模型应用于法医学实践。
[1]曲冬阳,邓淑娇,葛芸英,等.利用人体外周血痕sjTREC含量推断个体年龄[J].法医学杂志,2013,29(4):256-258,272.
[2]Zbie'c-Piekarska R,Spólnicka M,Kupiec T,et al. ExaminationofDNAmethylationstatusofthe ELOVL2 marker may be useful for human age prediction in forensic science[J].Forensic Sci Int Genet,2015,14:161-167.
[3]Srettabunjong S,Satitsri S,Thongnoppakhun W,et al.The study on telomere length for age estimation in a Thai population[J].Am J Forensic Med Pathol,2014,35(2):148-153.
[4]Sakuma A,Saitoh H,Ishii N,et al.The effects of racemization rate for age estimation of pink teeth[J]. J Forensic Sci,2015,60(2):450-452.
[5]Lacan M,Thèves C,Keyser C,et al.Detection of age-related duplications in mtDNA from human muscles and bones[J].Int J Legal Med,2011,125(2):293-300.
[6]Barnhoorn S,Uittenboogaard LM,Jaarsma D,et al.Cell-autonomous progeroid changes in conditional mouse models for repair endonuclease XPG deficiency[J].PLoS Genet,2014,10(10):e1004686.
[7]Melis JP,van Steeg H,Luijten M.Oxidative DNA damage and nucleotide excision repair[J].Antioxid Redox Signal,2013,18(18):2409-2419.
[8]MacRae SL,Croken MM,Calder RB,et al.DNA repair in species with extreme lifespan differences[J]. Aging(Albany NY),2015,7(12):1171-1184.
[9]Moriwaki S,Ray S,Tarone RE,et al.The effect of donor age on the processing of UV-damaged DNA by cultured human cells:reduced DNA repair capacity and increased DNA mutability[J].Mutat Res,1996,364(2):117-123.
[10]Harada YN,Shiomi N,Koike M,et al.Postnatalgrowth failure,short life span,and early onset of cellular senescence and subsequent immortalization in mice lacking the xeroderma pigmentosum group G gene[J].Mol Cell Biol,1999,19(3):2366-2372.
[11]Shiomi N,Mori M,Kito S,et al.Severe growth retardation and short life span of double-mutant mice lacking Xpa and exon 15 of Xpg[J].DNA Repair(Amst),2005,4(3):351-357.
[12]Blomquist TM,Crawford EL,Willey JC.Cis-acting genetic variation at an E2F1/YY1 response site and putative p53 site is associated with altered allelespecific expression of ERCC5(XPG)transcript in normal human bronchial epithelium[J].Carcinogenesis,2010,31(7):1242-1250.
[13]Wei Q,Matanoski GM,Farmer ER,et al.DNA repair and aging in basal cell carcinoma:a molecular epidemiology study[J].Proc Natl Acad Sci USA,1993,90(4):1614-1618.
[14]Bocklandt S,Lin W,Sehl ME,et al.Epigenetic predictor of age[J].PLoS One,2011,6(6):e14821.
[15]Le May N,Fradin D,Iltis I,et al.XPG and XPF endonucleases trigger chromatin looping and DNA demethylationforaccurateexpressionofactivated genes[J].Mol Cell,2012,47(4):622-632.
[16]Kimchi-Sarfaty C,OhJM,KimIW,etal.A“silent”polymorphism in the MDR1 gene changes substrate specificity[J].Science,2007,315(5811):525-528.
[17]Tsai CJ,Sauna ZE,Kimchi-Sarfaty C,et al.Synonymous mutations and ribosome stalling can lead to altered folding pathways and distinct minima[J].J Mol Biol,2008,383(2):281-291.
[18]de Sousa Abreu R,Penalva LO,Marcotte EM,et al.Global signatures of protein and mRNA expression levels[J].Mol Biosyst,2009,5(12):1512-1526.
[19]Takahashi F,Morita K,Katai K,et al.Effects of dietary Pi on the renal Na+-dependent Pi transporter NaPi-2 in thyroparathyroidectomized rats[J].Biochem J,1998,333(Pt 1):175-181.
[20]唐深,李习艺,陆彩玲,等.氢醌刺激脐血单个核细胞适应性反应基因表达[J].中国公共卫生,2009,25(11):1339-1340.
[21]邓宇斌,李士勇,叶伟标,等.H2O2预处理对骨髓间质干细胞凋亡适应性保护作用的研究[J].中山大学学报(医学科学版),2009,30(4):372-376.
Expression of XPG Gene in Forensic Age Estimation
DENG Xiao-dong1,ZHANG Wei1,ZHANG Bo1,MA Ying2,MUER Che-er1,ZHANG Li-xia1,XIE Ying1, LIU Yun1
(1.Department of Forensic Medicine,North Sichuan Medical College,Nanchong 637000,China;2.Department of Neurology,Affiliated Hospital of North Sichuan Medical College,Nanchong 637000,China)
ObjectiveTo explore the expression of xeroderma pigmentosum complementation group G(XPG)gene in healthy Han population of different ages and to analysis the relationship between the mRNA and protein expression levels of XPG and age,which may provide a new molecular-biological indicator for forensic age determination.MethodsTotal 150 samples of peripheral blood were collected from healthy Han population of different ages.Total RNA of peripheral blood mononuclear cell(PBMC)were extracted by TRIzol method,and the relative expression of XPG mRNA in PBMC was detected by quantitative real-time PCR,and the protein expression levels of XPG in plasma were detected by ELISA.ResultsThe mRNA and protein expression levels of XPG in≤18 years old group were significantly different from 19-45 years old group and≥46 years old group(P<0.05),while there was no significant difference between 19-45 years old group and≥46 years old group(P>0.05).No significant sex differences were observed in mRNA and protein expression levels of XPG(P>0.05).ConclusionThe relative expression level of XPG mRNA in PBMC declines with the increase of age in younger age,while the protein expression level in plasma increases with age,and XPG gene can be used as one of new markers for forensic age estimation.
forensic genetics;forensic anthropology;xeroderma pigmentosum group G;quantitative realtime PCR;enzyme linked immunosorbent assay;age estimation
DF795.2
A
10.3969/j.issn.1004-5619.2016.06.005
1004-5619(2016)06-0415-05
2015-12-11)
(本文编辑:李莉)
国家自然科学基金青年科学基金资助项目(81400966);四川省教育厅科研基金重点项目(14ZA0191,15ZA0209)
邓小冬(1988—),男,硕士,助教,主要从事法医学研究;E-mail:857123409@qq.com
刘云,男,博士,教授,主要从事法医病理学和法医毒理学研究;E-mail:xyun2005@163.com

