生态浮床对宁夏引黄灌区污染河道生态系统的影响
刘娅琴,付子轼,邹国燕*,孔令彬
(1上海市农业科学院,上海 201403;2宁夏回族自治区环境保护厅,银川 750011)
生态浮床对宁夏引黄灌区污染河道生态系统的影响
刘娅琴1,付子轼1,邹国燕1*,孔令彬2
(1上海市农业科学院,上海 201403;2宁夏回族自治区环境保护厅,银川 750011)
采用成熟的生态浮床技术,对引黄灌区中度污染河流水体治理的可行性及其效果进行了技术示范研究。结果显示:生态浮床对工程示范区域水体中的TN、NH+4-N、CODMn平均相对去除率分别为59.4%、59.7%和24.7%;浮游植物的优势种由前期的小环藻(Cyclotella sp.)和啮齿隐藻(Cryptomonas erosa)变为后期的小环藻和尖针杆藻(Synedra acusvar);浮游植物的Margalef多样性指数和Shannon-wiener多样性指数分别由2.17、2.04提升至2.85、2.44,且同时段浮床区域监测点的值高于对照点。研究表明,生态浮床技术在西部高寒地区夏季有较好的生态适应性和水质改善效果,但针对西部地区特定的气候和水文条件,如何延长生态浮床的作用时间有待进一步的研究。
生态浮床;水体修复;浮游植物;生物多样性
宁夏是全国水资源严重短缺的省区之一,水资源人均占有量只有190 m3,是全国平均值的1/11。近年来,水污染进一步加剧了水资源的短缺,呈现资源型缺水与水质型缺水共存的局面[1]。据统计,2013年全自治区废水排放总量36 312万t(生活污水占68.8%,工业废水占31.2%)[2]。“十一五”期间,通过流域污染防治改善措施,黄河宁夏段水环境质量有所改善,比“十五”期间提高一个水质类别,连续四年保持Ⅲ类水质[3]。但宁夏引黄灌区“大引大排”、过量施用化肥等粗放农作方式依然普遍,排水量占总引水量比例基本稳定在46%左右,“大引大排”将大量农药和化肥带入黄河,造成农业面源污染,对黄河水质构成极大威胁[4]。在中科院发布的2013年中国可持续发展战略报告中,宁夏可持续发展能力和环境支持能力位列全国后五位[5]。保护水资源,防治水污染,依然是宁夏实现经济社会可持续发展的重大问题。
上海市农业科学院水环境研究团队拥有三项发明专利的生态浮床技术,经过20多年的发展,已经成为河湖污染水体水质净化的常规手段之一。生态浮床的研究从早期的浮床植物适应性[6]发展到提高水质净化效果的立体化结构设计[7-9]。如利用PVC镂空框架代替传统泡沫板,减少浮床系统对水面的覆盖从而提高水体复氧,同时利用沸石等填料协同去除水体营养盐,极大提升了浮床的水质净化效率[7]。李先宁等[10]在生态浮床中引入水生动物单元,通过食物链的“加环”作用,提高了颗粒性有机物的可溶化和无机化(氨化)以及可生化性,改善了植物吸收及人工介质单元生物膜中微生物的基质条件,提高了浮床的净化效果。另一方面,对生态浮床的效应研究,也从单纯的水体理化性状改善[11]上升到对水体生态系统功能的修复的研究上。生态浮床因对水体N、P、COD等的有效去除,以及浮床植物根系对水体溶解氧等条件的改善,使得水体浮游植物[7]、浮游动物[12-13]的群落结构得以调整,生物多样性大幅度提升。
浮床系统卓越的水质净化、水体生态功能修复及优良的景观功能等,使其自“十五”起变成为水体生态修复领域的主要技术之一,活跃于每个五年计划中水体污染治理与控制重大专项科技项目的大部分研究与示范课题。但目前绝大多数的研究及应用主要针对的是长江中下游富营养化的城乡水体[11,14],生态浮床在西北高寒地区的适应性及效率尚未见报告。本研究依托上海市科委西部合作项目,开展了生态浮床技术治理西部污染水体的应用研究与示范,以期为西部水体治理献计献策,同时为推进生态浮床的应用积累科学数据。
1 材料与方法
1.1 应用示范地概况
应用示范在宁夏回族自治区银川市进行。银川属西北高寒地区,地处内陆,远离海洋,位于我国季风区的西缘,冬季受蒙古高压控制,正当冷空气南下之要冲,夏季处在南季风西行的末梢,形成较典型的大陆性气候。基本特征是:干旱少雨,蒸发强烈;日照时间长,太阳辐射强,昼夜温差大;无霜期短而多变。银川市年平均气温仅为8.3—8.6℃,夏季(6—8月份)月平均气温在21—23℃。
1.2 示范工程布设
工程示范区所涉及河段位于艾伊河(黄河支流)景观水道西侧,北京中路与上海西路之间(图1),工程区所在河段全长460 m,平均宽度30 m,常水位水面面积13 800 m2。在示范区南端有一条东西向支流与艾伊河直接相通。工程主要采用生态浮床及挺水植物种植等技术体系,总施工水域面积约为5 500 m2。生态浮床采用PVC管作为四周框架、套网(网孔大小:2 cm×2 cm)作为种植区(图2),每个单体面积为2 m2,浮床总面积1 500 m2。经过前期适应性筛选(另文发表),浮床植物主要采用铜钱草(Hydrocotyle vulgaris)(基于铜钱草为浮水植物,未使用套网)和路易斯安娜鸢尾(Iris hexagona),每个浮床单体种植密度为铜钱草3—4簇,路易斯安娜鸢尾12株(3×4)。共设4个取样点,分别在浮床示范区域的前段(参照点1#)、区域中段(2#)、区域后段(3#)、浮床示范区域的下游200 m处(4#),位置布局见图1。试验区位于银川市黄河补水前段,定期接纳来自黄河的补水(水流方向为西南至东北)。

图1 工程区航拍图Fig.1 Picture of the engineering zone

图2 生态浮床现场实施图Fig.2 Pictures of the EFBS in work scene
1.3 测定方法
工程施工之前(2014年4月15日)对河道本底值进行采样,施工完成后,6—9月(2014年)每个月对工程区水体进行采样检测。TP、TN、NH4+-N和CODMn等指标采用《水和废水监测方法》第四版[15]中的方法在试验室测定:用钼锑抗分光光度法测定TP(700 nm),用过硫酸钾氧化-紫外分光光度法测定TN(220/275 nm),用纳氏试剂比色法测定NH+4-N(420 nm),用酸性法测定CODMn。
用于浮游生物监测的水样采集使用5 L改良Patalas采水器,从表层至底层采取混合水样。取其中1 L经重力沉淀48 h后收集浓缩液,经1%的Lugol试剂染色固定,定容到50 mL用于浮游植物定量镜检;10 L混合水样过25#筛网用于浮游动物定量镜检。浮游生物定性、定量检测主要参照章宗涉[16]的方法,用体积法估算浮游植物的生物量,即1 μm3相当于10-6μg鲜重,优势浮游植物种类的大小随机选取10—30个个体测定求平均值[17]。
浮床植物泥沙携带量采用的是粗放式称重法,于物筛选试验(2013年)结束时进行,分别对清洗前及清洗后的植物进行称重,将两者差值视为泥沙携带量。
1.4 数据分析
采用Margalef多样性指数和Shannon-Wiener多样性指数,对工程区浮游植物的群落结构进行分析评价。
Margalef多样性指数主要体现浮游植物物种丰富度,公式为:d=(S-1)/ln N。式中:S为浮游植物的属数;N为浮游植物个体总数;d为多样性指数。
Shannon-Wiener多样性指数主要侧重于体现物种均匀度,公式为:H’=-∑si=1(pi)(log2pi),pi=ni/N。式中:H’为多样性指数;ni为样本中i种的个数;N为样本中浮游植物总个数;S为检测点水体中浮游植物总种数。
2 结果与分析
2.1 水体营养盐的变化
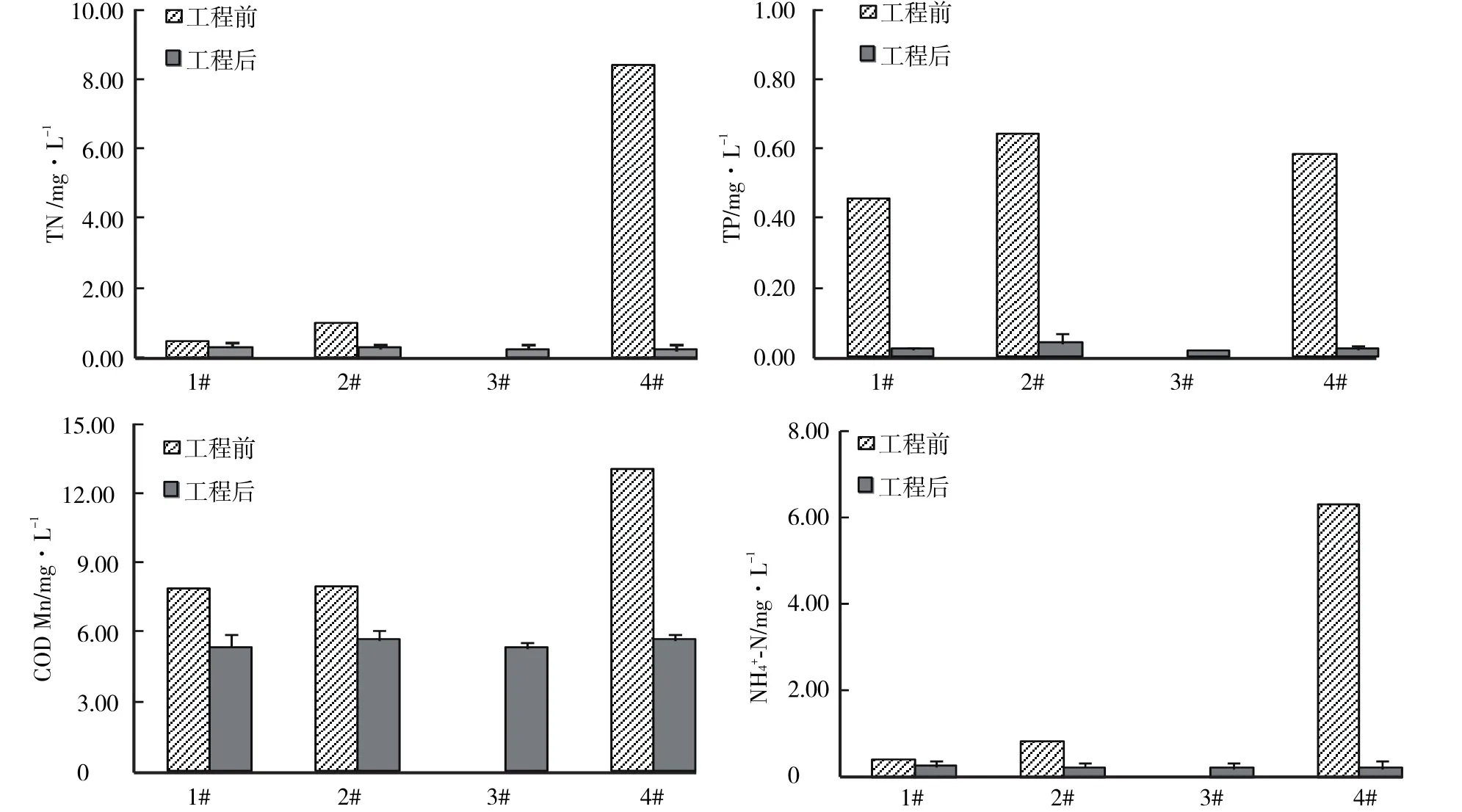
图3 浮床修复前后水体营养盐的变化Fig.3 Nutrients content in water at the beginning and end of EFBS restoration
工程修复前,浮床示范区域与区域下游水体N水平差异较大,其中下游水体中TN、NH+4-N高达8.39 mg/L和6.34 mg/L,远高于示范区域前段水体中的0.48 mg/L和0.43 mg/L,以及中段水体中的0.96 mg/L和0.82 mg/L(图3)。经过生态浮床的修复,水体中N水平显著下降,各监测点TN、NH+4-N 6—9月平均值均相对修复前(4月)下降到0.30 mg/L以下(注:3#为工程实施完成后增加的采样点,缺失工程修复前的对照值)。与对照1#位点相对,4#位点TN相对去除率达到59.4%,NH+4-N相对去除率为59.7%。
相对于N污染的高去除效率来说,生态浮床对有机污染的去除率较小,示范区域前段及中段CODMn相比工程前下降了31.7%和29.1%,示范区域下游CODMn下降了56.4%;生态浮床处理后同时段(9月)4#点位相对于1#对照点CODMn下降更多,这表明生态浮床处理对CODMn去除有显著效果。
生态浮床工程实施后,水体中TP含量由工程前的0.45—0.64 mg/L下降到0.04 mg/L以下,其中浮床示范区域的前段和中段分别下降了95.5%和94.0%,示范区下游的4#点位下降了96.5%。浮床处理区域的点位和1#对照点之间的差异并不明显,TP水平的下降可能来自于浮床处理之外的因素,比如因季节变化带来的上游来水中污染水平的差异。
2.2 浮床植物的泥沙携带量
黄河不仅是中国也是世界上输沙量最大的河流,平均含沙量35 kg/m3,黄河河水的这一特性也决定了银川引黄灌区水系中的水体泥沙含量处于较高水平。生态浮床对水体泥沙的去除、提高水体透明度有较大贡献。工程前期,浮床供试植物筛选试验显示,铜钱草和路易斯安那鸢尾的泥沙携带能力较大,尤其是铜钱草,植株泥沙比可达1∶3以上(表1)。这主要是因为铜钱草是匍匐型水生植物,在生长过程中有大部分的枝条是在水面以下伸展、生长,相互穿插成网状结构,有利于减缓水流,使水体中的泥沙逐渐沉降、吸附于植株表面,同时漂浮于水面的叶片会对水体中的泥沙产生吸附作用,增加植株对泥沙的吸附量(图4)。

表1 浮床植物的泥沙携带量Table 1 Suspended solids carrying capacity of the EFBS Plants

图4 工程修复期间铜钱草的泥沙携带图Fig.4 Sediment adhered by Hydrocotyle vulgaris during the restoration
2.3 浮游植物
2.3.1 浮游植物的种类组成与优势种的变化趋势
工程示范期间共鉴定出浮游藻类7门54属,其中绿藻门22属,硅藻门14属,蓝藻门7属,裸藻门4属,甲藻门和黄藻门分别3属,隐藻门1属。硅藻门的小环藻在整个工程期间的各个检测点均为优势种,尖针杆藻在后期的部分检测点占优势;随着示范工程的开展,隐藻门的啮齿隐藻优势度逐渐减小(表2)。

表2 浮床修复期间的浮游植物优势种Table 2 The dominant species of phytoplankton during the restoration of EFBS
2.3.2 浮游植物的密度
工程期间,各个检测点浮游植物总的密度在3.06×104—9.12×104个/L,其中最小值出现在7月的1#点,最大值在8月的2#点(图5)。从浮游植物总密度来看,水体污染程度较小。工程初期,3#点浮游植物总密度显著高于其他监测点;工程中后期,随着温度的上升,浮游植物总密度并没有呈现一般状态下的爆发式增长,各检测点密度有一定程度增长,且处于浮床中断的3#点的总密度略有下降。
2.3.3 浮游植物的群落结构与生物多样性
工程前期,各监测水体中隐藻门、硅藻门的种类占据浮游植物总密度的80%左右,排在第三优势地位的是绿藻门。随着修复效果的呈现,水体营养盐和有机物水平的下降,浮游植物群落结构出现相应的变化:硅藻门的优势地位略有升高,同时隐藻门的优势地位被黄藻门取代。此外,蓝藻门的比率随着温度的提升有所上升(图6)。
一般来说,水体所受污染越严重,生物种类越少,而个别耐污种类则增加。生物多样性指数越低,则说明群落受到的污染或者干扰越大。Margalef多样性指数的d值为0—1时为重污染,1—3时中等污染,3—4时轻污染,大于4为清洁水体;与Margalef多样性指数相似,Shannon-wiener生物多样性指数H值在0—1为重度污染,1—3为中度污染,其中1—2为α-中度污染,2—3为β-中度污染,大于3为清洁水体。修复期间,绝大部分监测点的浮游植物群落Margalef多样性指数和Shannon-wiener多样性指数在2—3,属于中度污染水平。可以看出,伴随着生态修复工程的开展,浮游植物植物的多样性整体呈现明显的上升趋势,后期部分监测点水体接近或进入轻污染状态;6、7、9月同时段,2#、3#、4#采样位点水体中浮游植物的多样性指数均大于对照1#点,这表明浮床处理能有效提升浮游植物的生物多样性(表3)。
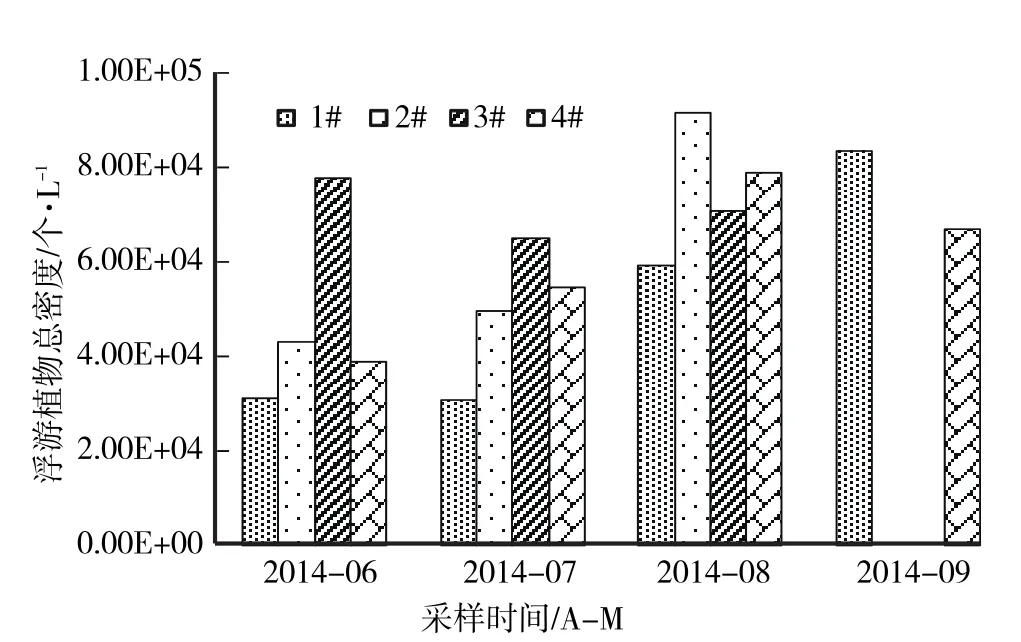
图5 浮游植物总密度的时空变化Fig.5 Dynamics of the cell densities of phytoplankton

图6 浮床修复期间浮游植物的群落结构Fig.6 Structure of phytoplankton during the restoration of EFBS

表3 浮床修复期间浮游植物多样性的时空变化Table 3 Dynamics of the phytoplankton biodiversity during the restoration of EFBS
2.4 浮游动物
浮床修复期间,原生动物和轮虫种类有所增加,8、9月部分监测点位水体中出现变形虫(Amoeba)、草履虫(Paramecium)、板壳虫(Coleps)、旋轮虫(philodina)。此外,部分点位水体中还监测到枝角类的象鼻溞(Bosmina),表明生态浮床置入后水体生境的改善有助于提升浮游动物的种类多样性。
原生动物前期(6、7月份)以拟铃虫属(Tintionnopsis)为优势,后期砂壳虫(Difflugia)成为最大优势属;轮虫中,三肢轮虫(Filinia)和多肢轮虫(Polyarthra)的优势度交替出现。在种类增加的同时,原生动物和轮虫的密度显著提升(表4)。修复前期,原生动物和轮虫的密度分别为30个/L和23个/L,至修复后期大幅升高至3 056个/L和1 925个/L。
大型甲壳类中,除后期监测点中偶见的象鼻溞以外,主要为桡足类的剑水蚤(Cyclops)及其无节幼体,且数量变化不大。

表4 浮床修复期间浮游动物的密度变化Table 4 Dynamics of the zooplankton during the restoration of EFBS个·L-1
3 讨论
3.1 生态浮床对水体营养盐的去除效率
几乎所有的生态浮床研究结果[7-11]都显示,浮床系统对水体营养盐表现出极好的去除效率。司友斌等[11]在巢湖的研究结果表明,浮床香根草对巢湖水体TN、TP和CODMn的去除率高达85.3%、98.0%和56.2%。但浮床系统对营养盐的去除率与温度有较为密切的关系,李欲如等[14]的静态试验显示,在气温35℃、水温30℃以上时,浮床水蕹菜对苏州重污染水体中的CODMn、TN、NH+4-N、TP的去除率分别为37.0%、92.9%、93.9%、94.3%。而冬季,当水温4.0—10.1℃的条件时(浮床植物生长良好),浮床系统对水体中TN、NH+4-N、TP、CODMn污染物的去除率分别为59.3%—29.2%、65.2%—39.3%、55.6%—33.9%和55.7%—49.5%[18]。可见,较低的水温不利于浮床系统对水体的氮磷去除率。本研究中,浮床修复示范地处我国西北高寒地区,虽然6—9月份平均水温15—22℃,相对较我国沿海地区(20—35℃)低,但生态浮床植物在此期间生长正常,系统对水体N元素和CODMn仍具有极高的去除率。尤其是处于下游的的4#位点,经过上游生态浮床的拦截去除,相对于1#对照位点,TN、NH+4-N、CODMn平均去除率达到59.4%、59.7%和24.7%。可见,本示范研究在相对不利的条件下,浮床系统对部分污染物质的去除效率与长江中下游同类试验[19]不相上下。
生态浮床对水体水质净化的效果,尤其是对N、P的去除首要来自于浮床植物的吸收。周小平等[19]的研究表明,浮床植物所累积的N、P量分别占各自系统去除量的40.32%—63.87%。这就意味着,在同等浮床利用强度下,浮床植物的生物量累积速度和程度对浮床系统的效率至关重要。相比常规污染水体的生态浮床修复应用试验,本研究试验条件严苛,宁夏黄河灌区夏季平均水温相对较低,而水体又携带大量泥沙,这些都不利于浮床植物的生长。因此,筛选合适的植物种类成为西部高寒地区浮床技术实施利用的关键。本研究通过前期大量筛选,最后选定了在较低水温下仍然拥有较大生物量和发达根系、生长期较长,同时又具有较高泥沙携带量的铜钱草和路易斯安娜鸢尾作为当地生态浮床植物的主导品种。本示范工程周期较短,若浮床系统长期投放,则有必要改善种植方式(如增加套网,本试验后期,铜钱草吸附大量泥沙沉入水底)、同时在合适的时间对浮床植物进行刈割处理,植物对泥沙的大量吸附会影响其自身的生长,进而阻碍对污染物的吸收去除效果。合适的刈割方式有助于促进浮床植物的生长,从而提升对水体N、P的去除强度[20-21]。
3.2 生态浮床对浮游植物的影响
相对于南方大多数富营养水体夏天随着温度的上升,浮游植物急剧繁殖大量暴发水华[22-23]的普遍情形而言,本研究所处的北方城市河道中浮游植物的现存量要低得多,且随温度上升的增长趋势也较为平缓。本研究中,浮床上游的浮游植物比中下游的浮游植物增长程度要大,但总体来说,浮床系统对浮游植物密度影响较小,有可能是浮床作用时间较短,此外还与浮游植物现存量总体呈现较低状态的有关。一些生态浮床对浮游植物有显著抑制作用的研究报道,通常针对的是某些容易大量暴发水华的特异性种类如铜绿微囊藻等[8],或是试验条件为夏季高生物量状况,如Nakamura等[24]的研究中,夏季非浮床处理组的浮游植物数量是浮床处理组的数十倍,而在冬季低生物量时则无明显差异。
相对浮游植物数量增长的抑制影响,浮床系统对浮游植物群落结果的影响要大得多。首先,群落组成及优势种的变化趋势较为明显。与南方富营养化水体浮游植物群落以绿藻门、硅藻门、蓝藻门占主要优势[25]不同,本研究中,绿藻门的优势度在整个研究期间均处于第二梯度,位于第一优势梯度的是隐藻门和硅藻门的种类,后期隐藻门的优势地位一定程度上被蓝藻门取代。出现此种情况的原因可能是由于CODMn的降低,在有机质含量较高的状态下具有生长优势的隐藻[26]失去最佳生长条件;而随着温度的上升,一些更适应较高温度条件的蓝藻门种类得以快速增长[27]。
此外,本研究中,生态浮床对浮游植物群落结构的影响更多体现在对其多样性提升的作用上。浮床修复期间,各监测点水体中浮游植物群落的Margalef多样性指数和Shannon-wiener多样性指数均随着修复的进行而明显提升。生态工程实施后,2#、3#、4#点位的多样性指数在大部分时间内相比同时段1#对照点位要高;这表明生态浮床对浮游植物多样性有明显的提升作用,相关研究也呈现出类似的结果[9,28]。浮床系统对浮游植物群落结构的影响与其显著的N、P去除率关系密切,营养物质对浮游植物的影响主要集中在N或P的限制上[29-30],这种影响不仅仅是对于浮游植物的生物量,更多体现在浮游植物的种类组成和群落结构上[31],生态浮床对营养盐的高去除率为浮游生物多样性提升的重要因素。
3.3 生态浮床对浮游动物的影响
浮游动物的种类多样性能作为水质环境评价标准[32],有研究显示,生态浮床处理能提升浮游动物的数量和多样性[12]。本研究中,污染水体经浮床修复后,原生动物、轮虫及枝角类种类数均有所提升,浮游动物的种类多样性趋于丰富。本研究中,生态浮床处理后期原生动物和轮虫数量激增,增长倍数分别高达102倍和85倍。有可能由于浮床植物根系输氧有利于水体复氧,改善了浮游动物的生存环境,因此原生动物和轮虫的数量得以大幅提升,因为溶解氧不足会限制轮虫的发生[33],低溶解氧会使浮游动物的生长和繁殖受到抑制[34]。但考虑到1#对照位点与浮床处理位点变化趋势较为一致,浮游动物数量激增可能另有原因,有待进一步调查研究。
4 结论
生态浮床技术能较好地适应我国西部高寒地区水体,在相对不利条件(相比长江中下游地区,水温低、泥沙含量高)下,筛选合适的植物种类,能对水体TN、NH+4-N、CODMn的平均相对去除率达到59.4%、59.7%和24.7%。生态浮床对水体营养元素的有效拦截使得浮游植物的群落结构得以调整,多部分处理时段内,浮床处理区水体中浮游植物生物多样性高于对照点水体。本研究表明,生态浮床技术在西部地区显示出了较好的生态适应性和水质净化效果,但是如何应对西部高寒地区的特定气候与水文条件,延长生态浮床的作用时间,仍需要进一步研究。
[1]邸国卫.宁夏水环境现状及水污染防治[J].环境保护,2006(5):16-21.
[2]中华人民共和国环境保护部.2013年环境统计年报[M].北京:中国环境出版社,2014.
[3]董亚萍,辛亮,任建东.“十一五”期间黄河宁夏段水环境质量状况变化分析[J].电子测试,2013(11):279-280.
[4]姜亚敏,刘猛,侯晓明.宁夏黄河流域主要水环境问题及对策[J].环境科学与管理,2012,37(12):30-33.
[5]中国科学院可持续发展战略研究组.2013中国可持续发展战略报告:未来10年的生态文明之路[M].北京:科学出版社,2013.
[6]SONG X F,YING H D,WU W M,et al.Study of surface aquaponics in natural waters[J].Aquaponics Journal,2000,4(3):16-20.
[7]刘娅琴,邹国燕,宋祥甫,等.框式复合型生态浮床对富营养化水体浮游植物群落结构的影响[J].水生生物学报,2010,34(1):196-203.
[8]LI X N,SONG H L,LI W,et al.An integrated ecological floating-bed employing plant,freshwater clam and biofilm carrier for purification of eutrophic water[J].Ecological Engineering,2010,36(4):382-390.
[9]李艳枫,刘凌,陈宁,等.一种新型的复合生态浮床及其对浮游植物群落结构的影响[J].水资源保护,2014,30(2):46-51.
[10]李先宁,宋海亮,朱光灿,等.组合型生态浮床的动态水质净化特性[J].环境科学,2007,28(11):2448-2452.
[11]司友斌,包军杰,曹德菊,等.香根草对富营养化水体净化效果研究[J].应用生态学报,2003,14(2):277-279.
[12]杨凤娟,杨扬,潘鸿,等.强化生态浮床原位修复技术对污染河流浮游动物群落结构的影响[J].湖泊科学,2011,23(4):498-504.
[13]李爽,谢从新,何绪刚,等.水蕹菜浮床对草鱼主养池塘轮虫群落结构的影响[J].水生生物学报,2014,38(1):43-50.
[14]李欲如,操家顺,徐峰,等.水蕹菜对苏州重污染水体净化功能的研究[J].环境污染与防治,2006,28(1):69-71.
[15]国家环境保护总局.水和废水检测分析方法[M].4版.北京:中国环境科学出版社,2002.
[16]章宗涉,黄翔飞.淡水浮游生物研究方法[M].北京:科学出版社,1991.
[17]中华人民共和国农业部.SC/T 9402—2010淡水浮游生物调查技术规范[S].北京:人民出版社,2011.
[18]李欲如,操家顺.冬季低温条件下浮床植物对富营养化水体的净化效果[J].环境污染与防治,2005,27(7):505-508.
[19]周小平,王建国,薛利红,等.浮床植物系统对富营养化水体中氮、磷净化特征的初步研究[J].应用生态学报,2005,16(11):2199-2203.
[20]周晓红,王国祥,杨飞,等.刈割对生态浮床植物黑麦草光合作用及其对氮磷等净化效果的影响[J].环境科学,2008,29(12):3393-3399.
[21]贾悦,李秀珍,唐莹莹,等.不同采收方式对富养化河道浮床空心菜生物产出的影响[J].生态学杂志,2011,30(6):1091-1099.
[22]邱光胜,胡圣,叶丹,等.三峡库区支流富营养化及水华现状研究[J].长江流域资源与环境,2011(3):311-316.
[23]JIN X,LIU H,TU Q,et a1.Eutrophication of lakes in China[M].Beijing:Chinese Research Academy of Environmental Sciences,1990.
[24]NAKAMURA K,SHIMATANI Y.Water purification and environment enhancement by the floating wetland[C].6 th IAWQ Asia-Pacific Regional Conference.IANQ,1997:888-895.
[25]孟睿,何连生,过龙根,等.长江中下游草型湖泊浮游植物群落及其与环境因子的典范对应分析[J].环境科学,2013,34(7):2588-2596.
[26]刘霞,陆晓华,陈宇炜.太湖北部隐藻生物量时空动态[J].湖泊科学,2012,24(1):142-148.
[27]RYCHTECKY P,ZNACHOR P.Spatial heterogeneity and seasonal succession of phytoplankton along the longitudinal gradient in a eutrophic reservoir[J].Hydrobiologia,2011,663(1):175-186.
[28]刘娅琴,刘福兴,宋祥甫,等.农村污染河道生态修复中浮游植物的群落特征[J].农业环境科学学报,2015,34(1):162-169.
[29]NALEWAJKO C,MURPHY T P.Effects of temperature,and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa,Japan:An experimental approach[J].Liminology,2001,2:45-48.
[30]ALTMAN J C,PAEPL H W.Composition of inorganic and organic nutrient sources influences phytoplankton community structure in the New River Estuary,North Carolina[J].Aquatic Ecology,2012,46:269-282.
[31]SALMASO N.Interactions between nutrient availability and climatic fluctuations as determinants of the long-term phytoplankton community changes in Lake Garda,Northern Italy[J].Hydrobiologia,2011,660:59-68.
[32]曾阳,付秀娥,苗明升,等.基于大型浮游动物多样性与水质参数相关性分析的温榆河水质评价[J].生态毒理学报,2012,7(2):162-170.
[33]都雪,王齐东,张超文,等.洪泽湖轮虫群落结构及其与环境因子的关系[J].湖泊科学,2014,26(2):269-276.
[34]SEDLACEK C,MARCUS N H.Egg production of the copepod Acartia tonsa:The influence of hypoxia and food concentration[J].Journal of Experimental Marine Biology and Ecology,2005,318(2):183-190.
(责任编辑:张睿)
Effects of the ecological floating bed system(EFBS)on the water ecosystem of polluted river in Ningxia Yellow-River irrigating area
LIU Ya-qin1,FU Zhi-si1,ZOU Guo-yan1*,KONG Ling-bin2
(1Shanghai Academy of Agricultural Sciences,Shanghai 201403,China;2Environmental Protection Department of the Ningxia Hui Autonomous Region,Yinchuan 750011,China)
The feasibility and efficiency of ecological floating bed system(EFBS)for water restoration of moderately polluted ditch in Ningxia Yellow-river irrigating region was studied.The results showed that through the purification of EFBS,the relatively average removal rates of TN,NH+4-N,and CODMnin water reached 59.4%,59.7%and 24.7%respectively.During the repair of EFBS,dominant genus of phytoplankton were Cyclotella sp.and Cryptomonas erosa in the earlier,Cyclotella sp.and Synedra acusvar in the later experimental time.After the restoration,Margalef diversity index and Shannon-wiener diversity index of phytoplankton were increased from 2.17 and 2.04 to 2.85 and 2.44 respectively,and the value of the EFBS area was higher than that of the control point.All of these showed that EFBS could be used in the cold western alpine region of China,and there was a significant efficiency of the EFBS in the purification and ecosystem functions restoration of pollution water in western of China.Meanwhile,according to the specific climatic and hydrological conditions in the western region of China,how to prolong the action time of the EFBS needed further study.
EFBS;Water restoration;Phytoplankton;Biodiversity
S273;X52
A
1000-3924(2016)06-092-08
2016-10-08
上海市科研计划项目(11395800900)
刘娅琴(1981—),女,硕士,助理研究员,主要研究方向为浮游生物生态学。E-mail:yaqliu@126.com
*通信作者,E-mail:zouguoyan@263.net

