东亚钳蝎毒素对人结肠癌细胞Caco—2的增殖抑制作用研究
贺源+肖凯夫+王智
摘 要:为研究东亚钳蝎毒素对人结肠癌细胞Caco-2增殖的影响,以不同浓度的东亚钳蝎毒素(10、20、40 μg/mL)干预体外培养的Caco-2细胞,分别于24、48 h后,用四甲基偶氮唑盐(MTT)比色法,观察毒素对Caco-2细胞的增殖抑制作用,运用淋巴细胞转化试验和乳酸脱氢酶(LDH)释放试验检测蝎毒素对Caco-2细胞的作用途径。结果表明:东亚钳蝎毒素不仅能抑制Caco-2细胞的增殖而且能促进淋巴细胞转化,且毒素对Caco-2细胞增殖的抑制作用具有浓度和时间的依赖关系,随浓度加大和时间延长,对Caco-2细胞增殖的抑制作用增强。
关键词:Caco-2人结肠癌细胞;东亚钳蝎毒;细胞增殖;抗肿瘤
中图分类号:Q78文献标识号:A文章编号:1001-4942(2016)12-0136-06
Abstract The effects of Buthus martensii Karsch venom on proliferation of human colon adenocarcinoma cell line Caco-2 were investigated in this study. The test used different concentrations (10, 20, 40 μg/mL) of Buthus martensii Karsch venom to interfere the Caco-2 cells cultured in vitro for 24 and 48 hours, then the proliferation inhibition effects was observed by means of MTT assay. The mechanism of venom on Caco-2 cells was measured by lymphocyte transformation and lactate dehydrogenase release assays. The data indicated that Buthus martensii Karsch venom could inhibit the Caco-2 cell proliferation and promote the lymphocyte transformation. Besides, the inhibition effects were closely related to the treatment time and venom concentration, which enhanced with the extension of treatment time and increase of venom concentration.
Keywords Human colon adenocarcinoma cell line Caco-2; Buthus martensii Karsch; Cell proliferation; Antitumor
癌症已经成为威胁人类健康的第一杀手[1],也是死亡率最高的疾病之一[2,3],癌症的预防与治疗任务十分艰巨[4]。根据目前癌症的发病趋势,2020年全世界癌症发病率将比现在增加50%[5]。因此,找到并运用新的抗癌药物成为人类战胜癌症的关键。
现有研究表明,蝎毒对肿瘤细胞有直接杀伤作用,能有效地导致癌细胞凋亡[6]。蝎毒在抗肿瘤的同时还具有明显的调节和增强机体免疫力的作用,是一种理想的抗肿瘤药物[7-10]。目前,关于蝎毒抗肿瘤研究的报道很多,对蝎毒素的分离、纯化及药理作用等也进行了深入研究[11-16]。本研究就是在前人工作的基础上,以常见的东亚钳蝎(Buthus martensii Karsch)毒素作为研究材料,用四甲基偶氮唑盐(MTT)比色法,观察不同浓度东亚钳蝎毒素处理不同时间对Caco-2细胞的增殖抑制作用,同时通过淋巴细胞转化试验考察蝎毒是否具有免疫调节作用,通过LDH释放试验检测细胞受损程度,从而探讨该毒蝎毒素对Caco-2结肠癌细胞增殖的抑制作用途径,以丰富蝎目动物在毒理学和药理学等方面的理论内涵,为东亚钳蝎毒素的开发与利用提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 药品与试剂 东亚钳蝎毒素,由湖南农业大学动物研究室提取,-20℃长期保存,完全培养液溶解,细菌过滤器过滤灭菌,按试验要求加入完全培养液稀释至所需浓度。
青霉素和链霉素,华北制药股份有限公司产品;DMEM(高糖)培养基,Hyclone产品;0.1%胰蛋白酶(含EDTA)、谷氨酰胺(1 mL/支)和0.01 mol/L等渗PBS液(pH 7.4),均为湘雅第二附属医院实验中心分装配置;胎牛血清(FCS),杭州四季青生物工程材料公司产品;二甲基亚砜(dimethylsulfoxid,DMSO),合肥博美生物科技有限责任公司;四甲基氮唑盐(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,MTT),Sigma公司国产分装;刀豆素Con-A(Cat.No.C8110),为Sigma公司产品;细胞裂解液(Cat#RT1220),北京天根生化科技有限公司产品;其他试剂皆为国产分析纯。
1.1.2 仪器 分析天平,上海天平仪器厂;细菌过滤器,日本NIPPON公司;25 cm2培养瓶(Cat-NO.:690 170),德国Greiner Bio-One GmbH产品;96孔培养板,美国COSTAR公司;移液枪(20、200、1 000 μL),湖南农业大学生化实验室提供;Tips,Hlue Light Biiolab 技术公司;冰箱(BCD-213型),海尔集团;低温冰箱(MDF-328E型),日本SANYO公司;细胞计数板,上海天光玻璃仪器厂;CO2培养箱,Thermo Forma;倒置相差显微镜(LH-50A型),日本OLYMPUS公司;超净工作台,Thermo Electron Corporation;低速离心机,北京医用离心机厂;全自动酶标仪,Thermo Labsystems。
1.1.3 动物与细胞株 昆明种小鼠,购自湖南思莱克景达实验动物有限公司。Caco-2人结肠癌细胞,由中南大学湘雅医学院药学院熊友健惠赠。
1.2 试验方法
1.2.1 Caco-2细胞的复苏、培养、传代、冻存 细胞复苏、培养:将冷冻管迅速由-80℃低温冰柜转入37℃恒温水浴箱中,摇动使其快速溶解, 将解冻后细胞转移到含4℃预平衡培养液的试管中;75%乙醇消毒冻存管,立即移入超净工作台中,在无菌条件下打开冻存管,用吸管吸取细胞悬液于无菌离心管中;盖好盖子,轻轻摇匀,细胞悬液在4℃下500×g离心10 min;弃上清,向沉淀中加入5 mL含150 U/mL青霉素、链霉素和10% FCS的DMEM培养液,将细胞转移到25 cm3无菌细胞培养瓶,37℃、5% CO2培养箱中培养。
细胞传代:每2~3 d,待细胞进入对数生长期后,将生长状态良好的Caco-2细胞从CO2培养箱中取出,在超净工作台中倒掉瓶内培养液,PBS缓冲液冲洗2遍;加入少许0.1%胰蛋白酶消化液(含EDTA)进行预消化,后加入1 mL胰酶,于37℃静置2~3 min。在倒置显微镜下观察被消化细胞,如果细胞边缘变圆,相互之间不再连接成片,立即在超净台中将胰蛋白酶消化液倒掉,加入2 mL含血清新鲜培养液终止消化,用吹打管吹打200~300次,制成细胞悬液。将细胞悬液各吸出1 mL分别加到另4个培养瓶中,并向每个瓶中分别加3~4 mL培养液,盖好瓶塞,送回CO2培养箱中,继续培养。
细胞冻存:在收集细胞24 h前更换培养液,取对数生长期细胞,按比例(培养液∶血清∶DMSO=7∶2∶1)配置冻存液;倒掉瓶内培养液,用PBS缓冲液冲洗2遍;加入少许0.1%胰蛋白酶消化液(含EDTA)消化2~3 min,滴加DMEM培养液,制成1 mL细胞悬液,4℃条件下900×g离心5 min;将沉淀的细胞重新悬浮在冻存液中(约1×107个细胞/mL冻存液),制成细胞悬液;每个冷冻管中加入1.5 mL细胞悬液,置于-80℃冰箱保存备用。
1.2.2 四甲基偶氮唑盐(MTT)药敏试验 取对数生长期的Caco-2细胞,用0.1%胰酶(含EDTA)消化,并用细胞计数板计数,用高糖DMEM培养基调整细胞密度,终密度约为3×104个/mL。将悬液接种于96孔培养板,每孔200 μL,培养24 h。弃去旧培养基,并分别加入阴性对照PBS缓冲液、阳性对照Con-A及不同浓度的东亚钳蝎毒素(10、20、40 μg/mL)各200 μL,每处理重复3个孔。另设只加DMEM培养液不加细胞的空白对照。置于饱和湿度、温度37℃、5% CO2培养箱中分别培养24、48 h,各培养孔加入1 mg/mL MTT 10 μL,4 h后弃去培养上清,PBS缓冲液充分洗涤细胞,每孔加入150 μL DMSO,振荡器上振荡10 min,充分溶解甲臜(formazan)结晶,酶标仪检测各孔吸光度A值,测定波长λ=570 nm,参考波长λ=630 nm。计算相对于阴性对照的生长抑制率。
抑制率(CI,%)=(阴性对照组A值-试验组A值)/阴性对照组A值×100
1.2.3 淋巴细胞转化试验 小鼠脾细胞的制备:将小鼠折颈处死后,立即用75%乙醇溶液浸泡消毒体表;无菌条件下取脾脏,置于D-hanks缓冲液中,用镊子轻轻将脾撕碎,制成单细胞悬液;400目筛网过滤,用PBS缓冲液洗3次,每次离心10 min(800×g),弃上清液;加入5~7 mL红细胞裂解液使红细胞溶解,37℃水浴5~10 min,800×g离心10 min,弃上清;加入适量PBS缓冲液吹吸混匀,800×g离心10 min,弃上清;将细胞悬浮于2 mL完全培养液中,血球计数板计数,高糖DMEM完全培养液将细胞数调成5×105个/mL。
试验分组:阳性对照组(在小鼠脾细胞悬液中加入浓度为10 μg/mL的Con A溶液);阴性对照组(在小鼠脾细胞悬液中加入浓度为10 μg/mL的PBS缓冲液);试验组(在小鼠脾细胞悬液中分别加入浓度为10、20、40 μg/mL东亚钳蝎毒素)。
试验程序:调整细胞浓度为5×105个/mL,接种于96孔培养板,每孔200 μL,24 h后弃旧培基,分别加入各组溶液,重复6孔。将培养板置于CO2培养箱中,37℃培养48 h后每孔加入10 μL 1 mg/mL MTT,4 h后弃去上清,PBS缓冲液充分洗涤细胞,每孔加入150 μL DMSO,振荡器上振荡10 min,充分溶解甲臜结晶。酶标仪检测各孔吸光度A值,测定波长λ=570 nm,参考波长λ=630 nm。计算转化指数。
转化指数(%)=(加Con A孔A值-不加Con A孔A值)/加Con A孔A值×100
1.2.4 乳酸脱氢酶(LDH)释放试验 将Caco-2细胞以3×104个/mL浓度接种于24孔培养板,37℃、5%CO2孵育24 h,无血清同步化处理后随机分组,对照组和试验组细胞处理及细胞分组同上,每份样品重复3孔。常规条件下孵育后于24、48 h后收集上清液,用紫外分光光度计比色法检测LDH释放量,计算LDH释放率。
LDH释放率(%)=(LDH上清液释放量-LDH原标本量释放量)/LDH原标本释放量×100
2 结果与分析
2.1 Caco-2细胞的体外培养
日常细胞培养过程发现,Caco-2细胞进行传代的标准为细胞长至对数生长期时即长满培养瓶底70%~80%;倒置显微镜下观察培养24 h的细胞为铺路石状(图1):细胞贴壁良好,形态完整,细胞连接紧密,数量多。由于该细胞贴壁较强、胞间连接较紧密,所以在胰酶作用消化时间和细胞吹打上,可以考虑稍加延长,即消化3 min,吹打300次为宜。
2.2 东亚钳蝎毒素对Caco-2人结肠癌细胞增殖抑制作用的量效关系
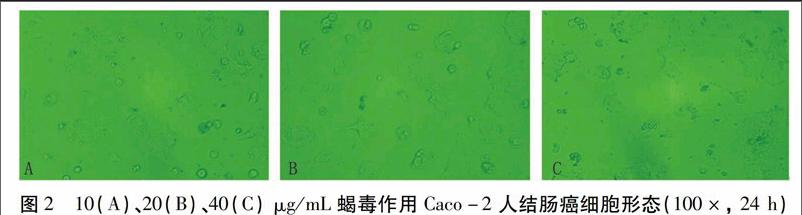
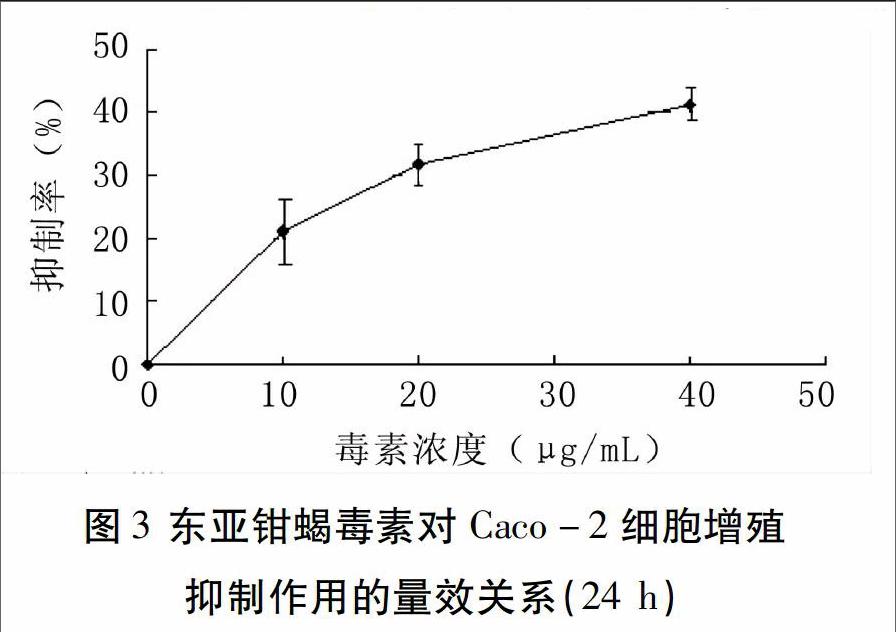
MTT药敏试验结果表明,与阴性对照比较,处理Caco-2细胞24 h后,蝎毒处理组贴壁细胞数量稀少,且随蝎毒处理浓度增加越来越少,细胞形态也变得欠清晰(图2);不同浓度东亚钳蝎毒素对Caco-2细胞均有抑制作用,且抑制率随毒素浓度升高而递增,具有良好的量效关系(图3)。
2.3 东亚钳蝎毒素对Caco-2人结肠癌细胞增殖抑制作用的时效关系
MTT试验结果表明,各浓度毒素对Caco-2细胞的增殖抑制率均为48 h时高于24 h时,即随时间延长而增加,可见各浓度毒素对Caco-2细胞的生长具有时间依赖性(图4)。
2.4 Caco-2人结肠癌细胞经毒素作用后淋巴细胞转化结果
由表1可知,与阴性对照相比, 20、40 μg/mL东亚钳蝎毒素可以显著促进淋巴细胞转化(P<0.05)。
2.5 乳酸脱氢酶(LDH)释放率检测
由图5可见, 随着东亚钳蝎毒素浓度的增加和时间的延长,Caco-2细胞中LDH的释放率逐渐增加。
3 讨论
3.1 MTT药敏试验检测细胞活性
本研究使用Caco-2人结肠癌细胞进行体外试验,这是筛选和研究抗肿瘤药物常用的重要手段,通常采用定量反应亚致死损伤性四甲基偶氮唑盐微量酶反应比色法(MTT法)检测细胞活性。MTT分析法以代谢还原MTT为基础。MTT是一种能接受含氢原子的染料,可被水溶解和透过细胞膜进入细胞内。有核活性细胞,特别是增殖期细胞,其线粒体内存在NADP相关的脱氢酶(琥珀酸脱氢酶),通过线粒体的能量代谢能将黄色的MTT还原成不溶的蓝紫色甲臜,沉积在细胞周围。在一定细胞数范围内甲臜结晶物形成量与活细胞数目和功能状态呈正相关。用DMSO将甲臜溶解后,可用酶标仪在570 nm处测定其吸光度(A值),即可测出存活细胞数,并计算出细胞抑制率[17]。
MTT法可进行高通量检测,并且定量检测灵活简便,与其他检测细胞活力的方法有良好的相关性,也常用于新研制抗癌药物的体外抗癌活动及抗癌谱筛选。但它容易受到药物的影响,由于药物和MTT溶液会生成有色复合物——甲臜,甲臜有时易聚成团干扰对结果的测试,使测定的A值不能反映实际的活细胞数。
本研究结果表明,与对照组相比,东亚钳蝎毒素随着浓度加大和作用时间延长,对Caco-2细胞增殖的抑制作用增强,即该抑制作用具有浓度和时间的依赖关系。
3.2 淋巴细胞转化试验方法的选择
淋巴细胞转化试验是细胞免疫试验的一种,又称T细胞转化试验。T细胞在体外经某种物质刺激,细胞代谢和形态相继发生变化,主要表现为短时间内细胞表面电荷即起变化,数小时后细胞内酶活化,在24~48 h细胞内蛋白质和核酸合成增加,从而产生一系列增殖变化,如细胞变大、细胞浆扩大、出现空泡、核仁明显、染色质疏松、淋巴细胞转变成母细胞等[18]。因此,这种淋巴细胞增殖又称淋巴母细胞转化。细胞转化情况可反应机体的细胞免疫水平,淋巴细胞转化率低则表示细胞免疫水平低。当T淋巴细胞受Con A、PHA等致分裂原或特异性抗原刺激后发生母细胞转化,活细胞特别是增殖细胞通过线粒体水解将MTT分解为蓝紫色的甲臜结晶而显色,其光密度值能够反映细胞的增殖情况[19]。
本试验结果显示,东亚钳蝎蝎毒能促进淋巴细胞转化。可见促进淋巴细胞转化是该蝎毒的抗肿瘤机制之一,同时也是研发一种既能杀伤肿瘤细胞又能促进淋巴细胞转化的新药物的根据之一。
3.3 LDH释放试验检测细胞生化指标的改变
LDH是广泛存在于细胞浆内的一种生物酶,它在细胞浆内的浓度是细胞外浓度的约500倍,在正常生理条件下,它不能透过细胞膜释放,当细胞膜受到损伤,即细胞受到毒性作用时,它可以进入细胞外液,升高细胞外LDH浓度。该分析在实验前不需要标记细胞,不需要处理放射性废弃物,可揭示早期、低水平的不能被其它方法检测到的细胞膜损坏,所以测定细胞培养液LDH的释放率是一个稳定而实用的指标。因此,该法常用于监测药物对细胞的毒性作用[20]与衡量细胞的受损程度,也是进行药物筛选的一个有效方法。
LDH是一种极为稳定的细胞质酶,在外界刺激下,如果细胞膜破裂,LDH就会被释放。乳酸与氧化型辅酶Ⅰ(NAD)在LDH催化作用下生成丙酮酸和还原型辅酶Ⅰ(NADH),丙酮酸再和2,4-二硝基苯肼反应生成2,4-二硝基苯腙,后者在碱性溶液中呈棕红色,释放出的乳酸脱氢酶存在于培养物上清中,LDH释放量与裂解细胞的数目呈正比,用全自动生化检测仪30 min内测量丙酮酸含量推算出LDH活力。
4 结论
经MTT法、淋巴细胞转化试验、LDH释放试验可知,10、20、40 μg/mL东亚钳蝎毒素对Caco-2细胞增殖都有抑制作用以及良好的量效关系和时效关系。东亚钳蝎毒素(20、40 μg/mL)对淋巴细胞的增殖反应有一定刺激作用,可见该蝎毒的抗肿瘤机制之一是促进淋巴细胞转化。此外,东亚钳蝎毒素(10、20、40 μg/mL)对Caco-2细胞的毒性作用使细胞膜受损、LDH释放率增加,结果呈浓度和时间依赖关系。
总之,研究一种药物的抗肿瘤机制,不仅要以该药对肿瘤细胞增殖的抑制作用为依据,还需从促进癌细胞凋亡和引起细胞周期阻滞等多个途径进行探究,从而为蝎毒素作为多肽类生化抗肿瘤药物提供多方面的理论参考。
参 考 文 献:
[1] 王琨, 崔博淼, 李燕, 等. 人体微生物组的肿瘤诱导作用及机制的研究进展[J]. 生命科学, 2015, 27(9): 1155-1159.
[2] 谭莉, 王琳, 巴亚斯古楞, 等. 一种新的肿瘤标志物TU M2-PK的研究进展[J]. 中外医学研究, 2011, 9(34): 159-161.
[3] 张天, 孙素红. 调节性 B 细胞在癌症中的研究进展[J]. 医学综述, 2015,21(2):236-238.
[4] 周翠娥. 癌症的预防与治疗进展[J]. 实用医技杂志, 2010, 17(6): 537-538.
[5] 刘莹莹, 邓皖利, 刘文先, 等. 异常黑胆质成熟剂治疗肿瘤的研究进展[J]. 中华中医药杂志(原中国医药学报), 2015,30(1):156-158.
[6] 李建伟, 胡静, 张桂荣, 等. 东亚钳蝎蝎毒多肽组分Ⅲ对肝癌细胞凋亡的影响[J]. 吉林大学学报(医学版), 2006, 32(4): 625-629.
[7] 韦晓谋, 韦柳华, 周定球. 蝎毒抗癌多肽对肝癌细胞株中癌症高表达蛋白 Hec1 的抑制作用[J]. 中药药理与临床 2015,31(2):154-155.
[8] Hoffman R. Potent inhibition of breast cancer cell lines by the isoflaconoid kievitone:comparison with genistein[J]. Biochem. Biophys. Res. Commun., 1995, 211(2): 600-602.
[9] Ooi V, Liu F. Immune modulation and anti-cancer activity of polysaccharide protein complexes[J]. Curr. Med. Chem., 2000, 7(7): 715-729.
[10]胡熙明. 中华本草(第一版)[M]. 上海: 上海科学技术出版社, 1998, 699-1148.
[11]Bagdny M,Batista C V,Valdez-Cruz N A,et al. Anuroctoxin, a new scorpion toxin of the alpha-KTx 6 subfamily, is highly selective for Kv1.3 over IKCa1 ion channels of human T lymphocytes[J]. Mol. Phamacol., 2005, 67(4):1034-1044.
[12]赵灿国, 董伟华, 孔天翰. 蝎毒及其分离组分对4种肿瘤细胞生长的抑制作用[J]. 广州医学院学报, 2006, 34(1): 26-29.
[13]王燕, 张维东, 贾青, 等. 蝎毒多肽提取物对前列腺癌细胞侵袭力影响的体外研究[J]. 中华肿瘤防治杂志, 2008, 15(14): 1045-1048.
[14]孔天翰, 林山, 韩雪飞, 等. 蝎毒多肽对肿瘤细胞的抑制作用研究[J]. 中国病理生理杂志, 2004, 20(6): 968-972.
[15]Liu Y F, Ma R L, Wang S L, et al. Expression of an antitumor-analgesic peptide from the venom of Chinese scorpion Buthus martensii Karsch in Escherichia coli[J]. Protein Expr. Purif., 2003, 27(2): 253-258.
[16]马培奇. 全球抗肿瘤药物市场发展动态[J]. 药学进展, 2006, 30(3): 141-144.
[17]Abe R,Ueo H,Akiyoshi T. Evaluation of MTT assay in agarose for cemosensitivity testing of human cancers: comparison with MTT assay[J]. Oncology, 1994, 51(5): 416-425.
[18]李仪奎. 中药药理实验方法学[M]. 上海: 上海科技技术出版社, 1985:197-202.
[19]司徒镇强, 吴军正. 细胞培养[M]. 西安: 世界图书出版公司, 2004: 25-43, 44-57, 84-89, 251-291.
[20]洪庆涛, 宋岳涛, 唐一鹏, 等. 细胞培养液乳酸脱氢酶漏出率的比色测定及其应用[J]. 细胞生物学杂志, 2004, 26(1): 89-92.

