重组Ser17突变型hIFN-β腺病毒的构建及其对结肠癌细胞的增殖抑制作用①
唐丽媛 李 楠 缪希松 王 元 芮丹云 童 毅 王 波 李 臣 句红萍 谢 力
(昆明学院医学院分子医学研究中心,昆明650214)
重组Ser17突变型hIFN-β腺病毒的构建及其对结肠癌细胞的增殖抑制作用①
唐丽媛 李 楠 缪希松 王 元 芮丹云 童 毅 王 波 李 臣②句红萍 谢 力
(昆明学院医学院分子医学研究中心,昆明650214)
目的:构建表达突变型人源β干扰素(Ser17hIFN-β)的重组腺病毒,体外评价其对结肠癌细胞的抑制增殖作用及细胞周期的影响。方法:人工合成含Ser17突变型hIFN-β基因并克隆至穿梭载体pshuttle-CMV,pshuttle-Ser17hIFNβ与腺病毒骨架质粒pAd同源重组后转染HEK293细胞,包装重组腺病毒rAd-Ser17hIFNβ。 rAd-Ser17hIFNβ转染人结肠癌细胞株HT-29,Western blot检测rAd-Ser17hIFNβ在HT-29中的表达;MTT细胞生长实验检测rAd-Ser17hIFNβ对HT-29细胞的体外增殖的影响,流式细胞术检测HT-29细胞周期改变情况。结果:重组腺病毒经HEK293细胞扩增后滴度可达109.125CCID50/ml;Western blot检测到外源性Ser17hIFN-β基因在HT-29细胞中的表达;rAd-Ser17hIFNβ转染后HT-29细胞生长受到抑制(P<0.05),细胞处于S期百分比增加。结论:表达Ser17突变型hIFN-β的重组腺病毒能抑制结肠癌细胞的增殖及诱导S期阻滞,为应用β干扰素对结肠癌进行基因治疗提供了实验基础。
Ser17hIFN-β;结肠癌;重组腺病毒
干扰素(Interferon,IFN)是一类具有抗病毒,抗肿瘤及免疫调节等作用的多功能细胞因子。人类体内至少存在α、β、γ、δ、ω 5种类型的干扰素,根据干扰素的产生细胞、受体和活性等因素将其分为Ⅰ型和Ⅱ型[1,2]。Ⅰ型干扰素主要起抗病毒和抗肿瘤作用,包括IFN-α、IFN-β、IFN-δ和IFN-ω等;Ⅱ型又称免疫干扰素,主要起免疫调节作用,只包括IFN-γ。人源的IFN-β(human Interferon β,hIFN-β)是一种主要由成纤维细胞产生的糖蛋白,为单一基因产物,相对分子质量为23 kD。IFN-β与IFN-α具有相同的识别受体[3],且生物学功能相似,都具有抗病毒、生长抑制和刺激免疫细胞活化等功能[4]。但两者在氨基酸同源性上仅为30%,在核苷酸同源性上约为45%。对于多数癌细胞,人类的IFN-β显示出比IFN-α更强的抑制肿瘤增殖的作用[5,6]。有研究表明:IFN-β可以通过促进机体免疫功能,提高巨噬细胞、NK 细胞和CTL 的杀伤水平等机制抑制和杀伤多种肿瘤细胞[7]。然而天然产生的hIFN-β血清中含量小,且半衰期很短,体内难以达到发挥抗肿瘤作用的有效浓度[8]。
本实验中我们构建以腺病毒为载体的重组hIFN-β,并选用第17位氨基酸半胱氨酸Cys突变为丝氨酸Ser的hIFN-β基因序列,在不影响其生物活性的情况下同时获得更稳定的表达产物。继而以重组Ser17hIFN-β转染人结肠癌HT-29细胞,观察腺病毒载体表达的突变型hIFN-β对结肠癌细胞体外增殖及细胞周期的影响。旨在为重组IFN-β对结肠癌的基因治疗提供临床前的实验参考。
1 材料与方法
1.1 载体、细胞和主要试剂 E1、E3区缺陷的5型腺病毒表达系统pAdEasy-1、pShuttle-CMV和Ecoli BJ5183购自Stratagene公司;小鼠抗人IFN-β抗体购自Santa Cruz公司;脂质体Lipofection2000购自Invitrogen公司;PacⅠ和PmeⅠ购自NEB公司,其余限制性内切酶购自TaKaRa公司;人结肠癌细胞株HT-29购自中科院上海细胞库;HEK293细胞、Ecoli DH5α、Ecoli XL10-Gold均由本实验室保存。
1.2 方法
1.2.1 PCR扩增Ser17hIFN-β基因 携带Ser17突变型IFN-β基因的质粒合成自南京金斯瑞生物科技公司(Genebank号:GI:568815589),序列合成时原始基因中第187位碱基由T突变为A,即设计成熟IFN-β肽链中第17位氨基酸Cys突变为Ser。原始hIFN-β基因全长为840个碱基对(bp),合成序列以编码区(CDS)起始密码子为起点,目的扩增编码区长度为564 bp。转录生成的肽链中前端含21个氨基酸的信号肽,成熟的hIFN-β是信号肽切除后含166个氨基酸的蛋白分子,合成时设计其第17位氨基酸由Cys突变为Ser。
以合成质粒pUC57-Ser17IFNβ为模板,PCR法扩增Ser17突变型IFN-β基因(表1)。反应条件:94℃预变性2 min;94℃30 s,60℃30 s,72℃45 s,扩增25个循环,72℃延伸10 min,反应结束4℃保存。
1.2.2 重组穿梭质粒pShuttle-Ser17hIFNβ的构建 PCR产物经1%琼脂糖凝胶电泳,切胶回收Ser17hIFN-β基因条带,KpnⅠ和XhoⅠ双酶切回收的Ser17hIFN-β片段和pShuttle-CMV载体,TaKaRa快速连接酶16℃连接目的片段和载体30 min。取5 μl连接产物转化DH5α感受态细胞,震摇45 min后涂布含卡那霉素的LB琼脂平板,37℃倒置平板孵箱内过夜培养。次日挑取得到的单克隆菌落转接入5 ml液体LB试管中,220 r/min摇床37℃孵育12~16 h增菌,取3 ml菌液小量提取质粒后KpnⅠ和XhoⅠ双酶切鉴定,酶切阳性的质粒经测序确认插入的Ser17hIFNβ基因序列无误。
1.2.3 重组腺病毒rAd-Ser17hIFNβ的构建和鉴定 将获得的pshuttle-Ser17hIFNβ用PmeⅠ单酶切线性化,再用CIAP进行5′去磷酸化处理,酶切产物与腺病毒骨架pAdEasy-1共同电转化Ecoli BJ 5183感受态细胞进行同源重组。转化电压为2.5 kV,电阻200 Ω,电容25 μF,转化产物涂布LB平板(Kan)37℃孵育18 h。PacⅠ单酶切鉴定重组质粒pAd-Ser17hIFNβ后,挑选酶切阳性的pAd-Ser17hIFNβ转化Ecoli XL10-Gold大量扩增质粒。经PacⅠ酶切线性化并纯化后收获重组质粒(4 μg),加入200 μl Opti-MEM后与脂质体Lipofection2000等量混合,常温放置20 min后转染HEK293细胞。 转染细胞6 h后换液,继续37℃,5%CO2孵箱培养9~12 d,待细胞出现明显病变后收获原代重组病毒:将细胞反复冻融3次,8 000 r/min离心10 min,取上清液。病毒液经磷钨酸负染后在透射电子显微镜下观察病毒颗粒形态。
1.2.4 rAd-Ser17hIFNβ的传代扩增与滴度检测 将1 ml原代病毒液在T25培养瓶中接种细胞密度为80%的HEK293细胞,培养瓶内换为含100 U/ml青霉素、100 U/ml链霉素和2%FBS的高糖DMEM细胞维持液,37℃,5%CO2孵育48~72 h,待细胞充分病变后反复冻融8 000 r/min离心收获第1代病毒。继续在T25瓶的HEK293细胞上接种200 μl第1代病毒,48~72 h后收获病毒。同样方法将重组腺病毒传代至第3代,Reed-Muench 法测定各代次重组腺病毒滴度。
表1 PCR扩增引物序列
Tab.1 Primer sequences used in PCR
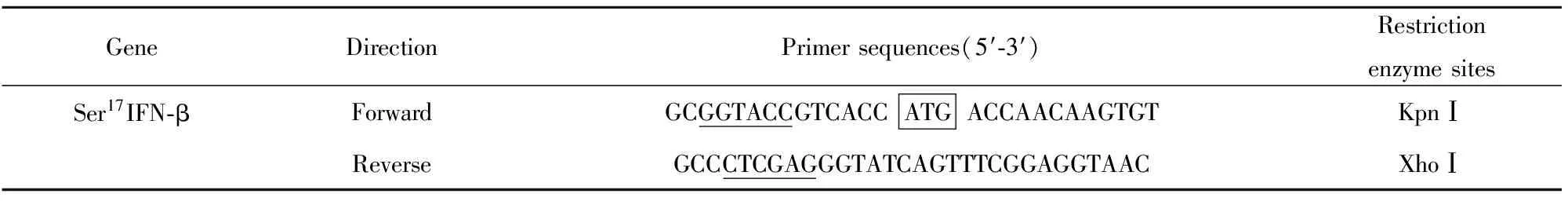
GeneDirectionPrimersequences(5′⁃3′)RestrictionenzymesitesSer17IFN⁃βForwardGCGGTACCGTCACCATGACCAACAAGTGTKpnⅠReverseGCCCTCGAGGGTATCAGTTTCGGAGGTAACXhoⅠ
1.2.5 Western blot检测rAd-Ser17hIFNβ在HT-29细胞中的表达 接种第3代重组腺病毒rAd-Ser17hIFNβ(MOI=20)至致密单层的六孔板HT-29细胞中,36 h后收获感染细胞。RIPA裂解细胞,12 000 r/min离心3~5 min后取上清,Western blot法检测其中目的蛋白Ser17hIFN-β的表达。10%SDS-PAGE分离蛋白样品,重组蛋白经4℃,40 V转移2 h至PVDF膜。电转结束后,用含3%BSA,0.05%Tween-20的PBS封闭60 min;小鼠抗人IFN-β一抗(1∶2 000稀释)37℃摇床孵育2 h;HRP标记的山羊抗小鼠IgG多克隆二抗(1∶2 000稀释),37℃摇床孵育60 min,DAB显色目的蛋白条带。
1.2.6 MTT法检测rAd-Ser17hIFNβ感染HT-29细胞的体外增殖情况 以100 μl/孔的体积将浓度为5 ×104ml-1的HT-29细胞接种96 孔板,待细胞贴壁后rAd-hIFNβ感染细胞(MOI=20),同一样本设8个复孔,并以未感染病毒的HT-29细胞作为对照。 37℃,5%CO2孵育16 h后,第1天开始每天同一时间取一块96孔板,每孔加入浓度为5 mg/ml 的MTT溶液20 μl,继续培养4 h,吸弃细胞上清,加入150 μl/孔DMSO充分溶解结晶,酶标仪测量各检测孔在490 nm波长下的吸光度值(OD490)。同样方法测定感染后第2~7天各样本的OD490值。以各观察天数的OD490值绘制细胞生长曲线。细胞生长抑制率=(1-实验组OD490值/对照组OD490值)×100%。
1.3 流式检测受rAd-Ser17hIFNβ感染的HT-29细胞周期 T25培养瓶中接种HT-29细胞,待生长至细胞密度30%~40%时,换为无血清RPMI-1640培养液24 h,使细胞同步静止于G0期。用rAd-hIFNβ感染HT-29细胞(MOI=20),4 d后收集细胞,70%乙醇4℃固定过夜,加入终浓度50 μg/ml的RNaseA 37℃作用1 h,再用终浓度100 μg/ml的荧光染料碘化丙啶(PI)室温避光染色30 min,流式细胞仪检测样品细胞周期各时相百分比构成情况。
2 结果
2.1 Ser17hIFN-β基因的扩增及pShuttle-Ser17-hIFNβ的鉴定 以质粒pUC57-Ser17hIFNβ为模板,PCR扩增Ser17hIFN-β基因,1%琼脂糖凝胶电泳在600 bp附近可观察到与预期大小相符的清晰特异性条带(图1);继而鉴定将Ser17hIFN-β片段克隆至pShuttle-CMV后转化生成的单克隆菌落,重组质粒经KpnⅠ和XhoⅠ双酶切后电泳可见接近600 bp的Ser17IFN-β基因片段和约7.5 kb大小的载体片段条带(图2),证明pShuttle-Ser17hIFNβ构建成功,酶切阳性质粒经测序确认插入的Ser17hIFN-β基因序列无误。
2.2 重组腺病毒rAd-Ser17hIFNβ的构建及电镜下形态学观察 线性化的pShuttle-Ser17hIFNβ穿梭质粒与腺病毒基因组骨架pAdEasy-1进行同源重组,成功重组和一条3 kb或4.5 kb的小片段。本实验筛选出的是电泳结果为4.5 kb 小片段的阳性克隆(图3)。
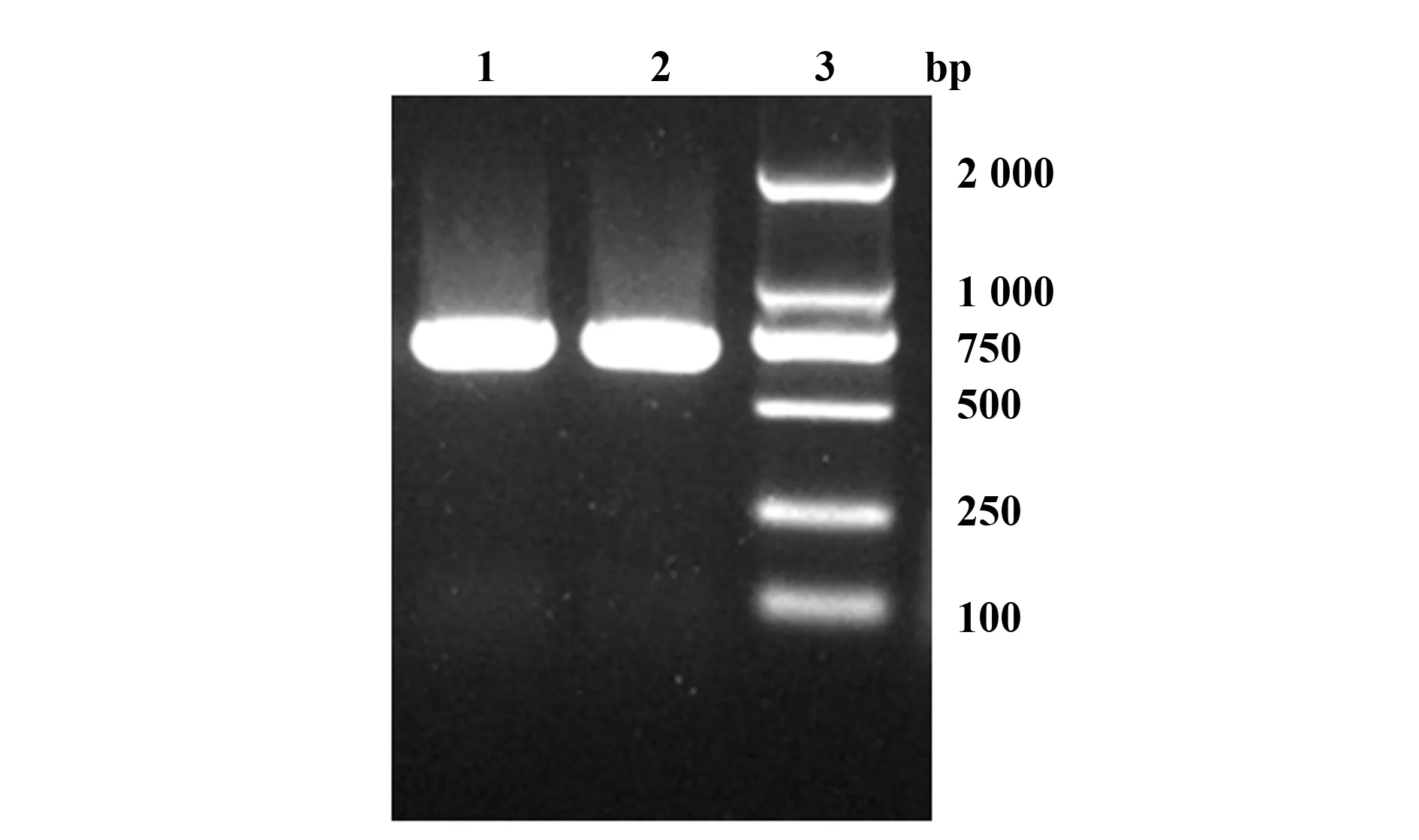
图1 Ser17hIFN-β基因PCR 扩增产物(564 bp)Fig.1 PCR amplification product of Ser17hIFN-β gene (564 bp)Note: Lane 1,2.Ser17 hIFN-β gene;Lane 3.DL 2000 marker.
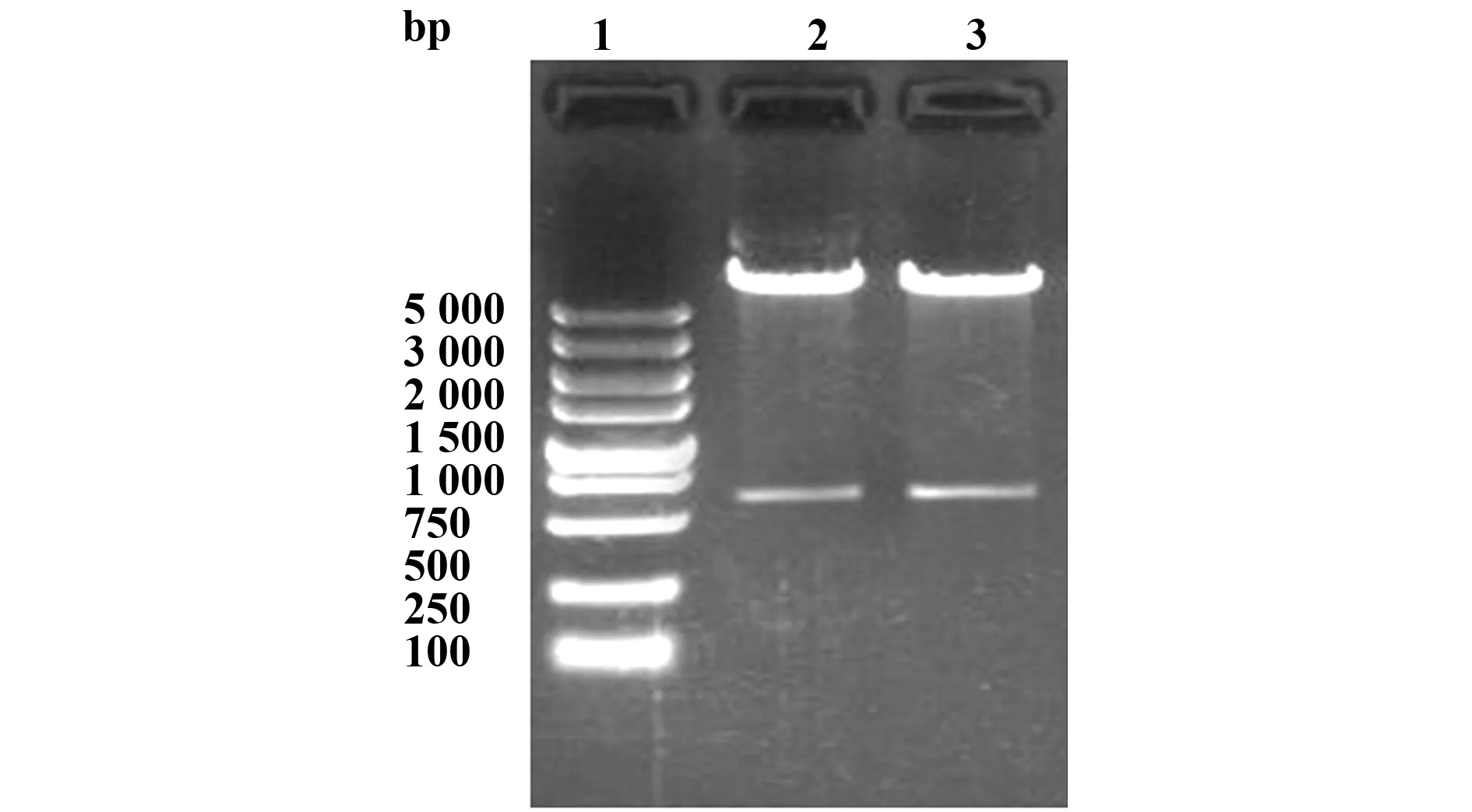
图2 重组质粒pshuttle-Ser17 hIFN-β酶切鉴定Fig.2 Restriction enzyme digestion of recombinant pshuttle-Ser17 hIFN-β Note: Lane 1.DL 5000 marker;Lane 2,3.Pshuttle-Ser17 hIFN-β plasmids.
在HEK293细胞中传代培养的重组腺病毒,细胞经反复冻融后离心获得病毒液,在透射电镜下观察可见无包膜,呈二十面体结构,直径约为80 nm的重组腺病毒颗粒(图4)。
2.3 Ser17hIFN-β在HT-29细胞中的表达 包装成功的原代重组腺病毒rAd-Ser17hIFNβ在HEK293细胞中连续传代3次,微量滴定法检测获得了滴度为109.125CCID50/ml的病毒收获液。用第3代rAd-Ser17hIFNβ感染HT-29细胞(MOI=20),36 h后RIPA裂解被感染的HT-29细胞进行WB检测,转膜后可见约23 kD的特异性蛋白条带,蛋白分子量与预期大小相符,证实Ser17hIFN-β可以经重组腺病毒在结肠癌细胞HT-29中成功表达(图5)。
2.4 rAd-Ser17hIFNβ感染HT-29后细胞生长曲线的变化 MTT法检测rAd-Ser17hIFNβ感染HT-29后的细胞增殖情况,结果显示:从感染后第3天开始,感染rAd-Ser17hIFNβ的HT-29细胞的OD490值显著低于未转染组HT-29细胞和空载体转染组HT-29(P<0.05),并一直持续至第7天,其中最大细胞生长抑制率出现于第6天,为45.7%(与未转染组HT-29对比)。而空载体转染组HT-29 的OD490值与未转染组HT-29细胞相比差异无统计学意义(P>0.05),见图6。
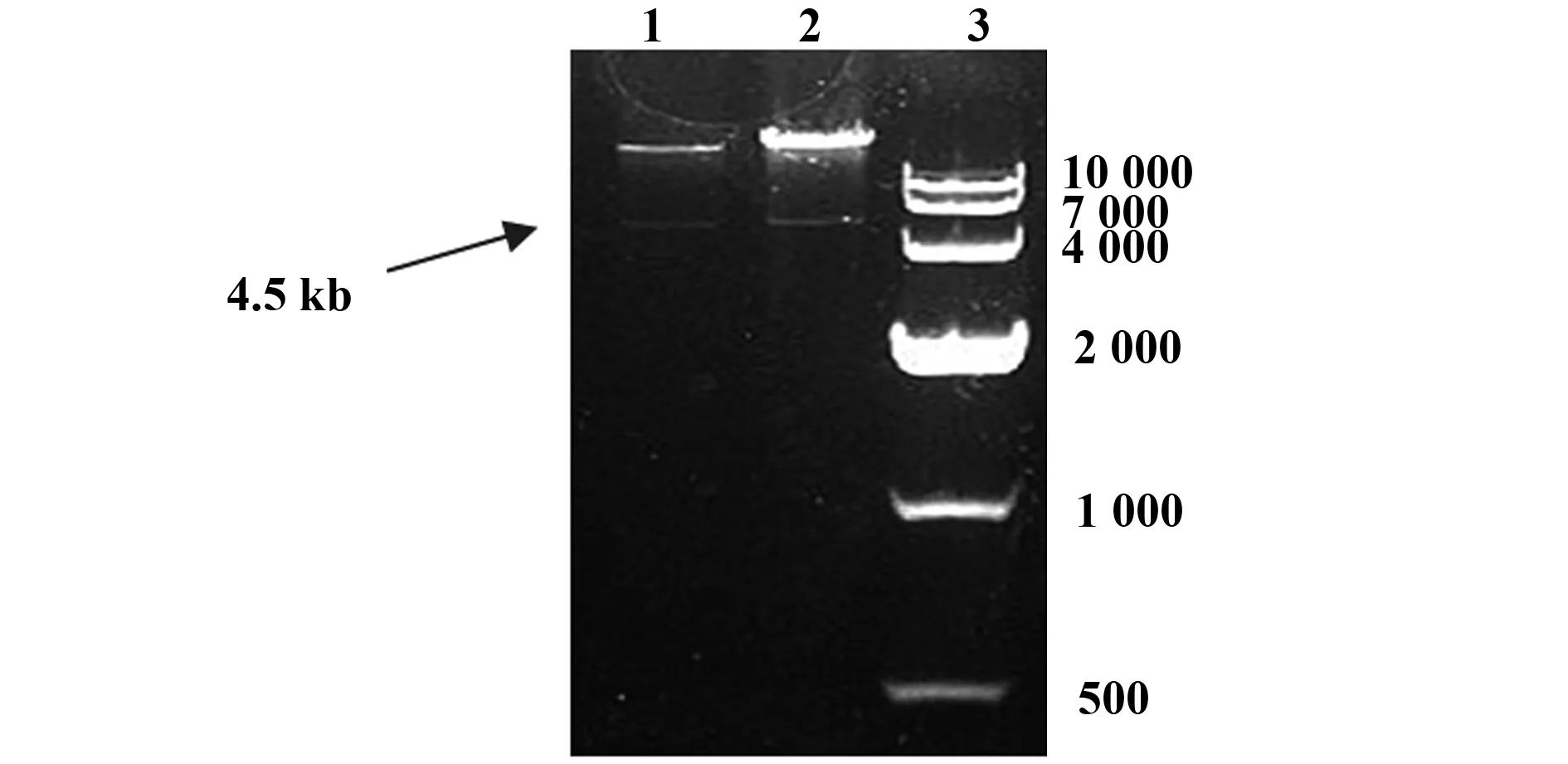
图3 PacI酶切鉴定重组质粒pAd-Ser17 hIFNβFig.3 Restriction enzyme digestion of recombinant pAd-Ser17hIFNβ by PacINote: Lane 1,2.pAd-Ser17 IFNβ plasmids;Lane 3.DL 10 000 marker.
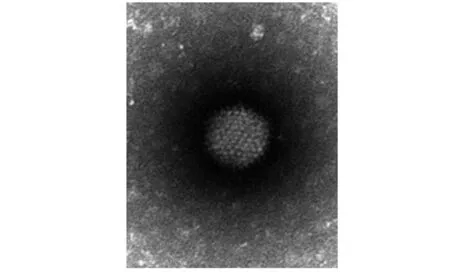
图4 透射电镜观察rAd-Ser17 hIFNβ重组腺病毒颗粒Fig.4 Morphology of recombinant rAd-Ser17hIFNβ particle observed by transmission electron microscope
2.5 Ser17hIFN-β基因对HT-29细胞周期的影响 流式细胞仪检测感染rAd-Ser17hIFNβ的HT-29细胞周期各时相的分布情况。结果显示:转染Ad-control空质粒的HT-29细胞和未转染外源基因的HT-29细胞周期各时相百分比分布接近(各时相百分比差异均<5%);转染了rAd-Ser17hIFNβ的HT-29细胞处于S期的构成比增加(与转染Ad-control的HT-29细胞和正常HT-29细胞相比均>10%),提示Ser17hIFN-β在细胞内的表达可能减缓细胞DNA的复制,从而抑制结肠癌细胞的生长。

图5 蛋白印迹检测rAd-Ser17hIFNβ感染HT-29细胞后Ser17hIFN-β的表达Fig.5 Expression of Ser17hIFN-β in rAd-Ser17hIFNβ infected HT-29 cells detected by Western blotNote: Lane 1 prestained protein ladder;Lane 2 HT-29 cell lysis infected with rAd-Ser17hIFNβ.

图6 HT-29细胞感染rAd-Ser17hIFNβ后的生长曲线变化Fig.6 Growth curves of HT-29 cells infected with rAd-Ser17hIFNβ by MTT assay
表2 Ser17hIFN-β基因对HT-29细胞周期各时相分布的影响
Tab.2 Effect of Ser17hIFN-β gene on cell cycle distribution in HT-29
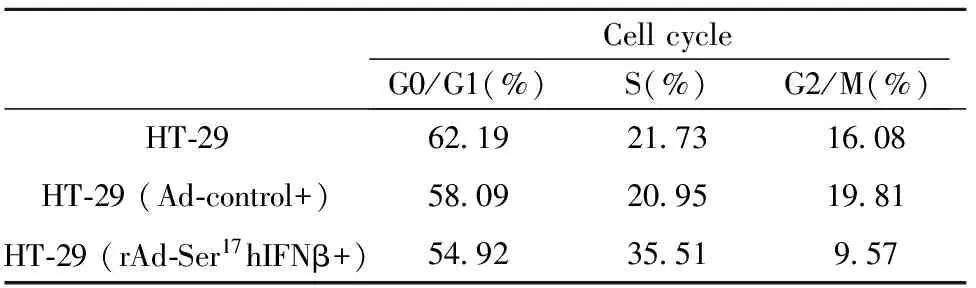
CellcycleG0/G1(%)S(%)G2/M(%)HT⁃29621921731608HT⁃29(Ad⁃control+)580920951981HT⁃29(rAd⁃Ser17hIFNβ+)54923551957
3 讨论
在肿瘤细胞因子疗法中,干扰素是被应用于治疗人类肿瘤最早、最广泛的细胞因子,多项研究显示干扰素可以延长肿瘤患者的无病生存期(DFS),在体内和体外试验中均表现出抑制增殖和免疫调节的作用[9,10]。
天然hIFN-β前体分子由187个氨基酸组成,其中前21个氨基酸为信号肽序列,引导hIFN-β分泌出胞外。成熟的hIFN-β分子含有166个氨基酸,分别在17、31和141位氨基酸含有3个半胱氨酸。IFN-β分子还含有一个糖基链,尚未发现糖基对其生物学活性有影响。IFN-β的生物学作用有较强的种属特异性[11]:例如小鼠IFN-β分子只有一个Cys17,分子内无二硫键。而人IFN-β 31与141位半胱氨酸之间形成的分子内二硫键对于IFN-β的生物学活性非常重要,Cys141被酪氨酸(Tyr)替代后完全丧失抗病毒作用,而Cys17被Ser替代后不仅不影响其生物学活性,反而可以增加IFN-β的分子稳定性[12,13]。
在与肿瘤相关的研究中,IFN-β显示出抑制瘤体血管生成和抗肿瘤细胞增殖的作用[14]。以IFN-β为目的基因对肿瘤进行基因治疗的探索已有诸多报道:Wilderman等[15]同样应用腺病毒载体携带IFN-β原位注射治疗小鼠支气管肺癌取得效果;Meijer等[16]利用腺相关病毒为载体脑室内注射IFN-β治疗小鼠脑胶质母细胞瘤可完全抑制原位肿瘤生长并有效延长小鼠生存期;另外,重组IFN-β与化疗药物联合使用也在不断探索中,Streck等[17]用腺相关病毒表达IFN-β联合低剂量环磷酰胺治疗小鼠神经母细胞瘤;Villaverde等[18]也进一步证明IFN-β无论单独转染或者联合常规抗肿瘤药物对多种人类肿瘤细胞系都有抑制增殖的效果。
结肠癌是最常见的消化系统恶性肿瘤之一,以手术为主辅助化疗的策略近40年来对治疗效果的提高并不显著。“治愈性切除”的患者术后5年总体生存率长期停滞于50%~60%,而且约20%的患者确诊时已存在转移性病灶,这部分患者5年生存期仅10%左右。进一步扩大手术范围并不能明显改善预后,随之而来的却是更大的手术损伤和更多并发症的风险,因此对结直肠癌的生物治疗探索也越来越受到研究者的重视。
本研究以Ad5型复制缺陷型腺病毒为载体携带Ser17突变型hIFN-β转染人结肠癌细胞HT-29。以Ad-easy为代表的复制缺陷型腺病毒系统作为成熟的真核表达载体可高效方便地表达各类外源基因,且病毒载体不能自我复制,外源基因不整合入基因组,具有较高的安全性。腺病毒是唯一已获准用于临床的基因治疗载体,被广泛应用于各类肿瘤疫苗的研究中[19]。我们的实验结果显示,Ser17hIFN-β基因可以有效地在HT-29细胞内表达,对比未转染Ser17hIFN-β的HT-29,细胞的增殖明显减缓,细胞周期变化受阻于S期,提示Ser17hIFN-β的导入可能诱导结肠癌细胞的生长抑制。虽然肿瘤的发生是多因素长期共同作用的结果,细胞因子对肿瘤直接或协同调节作用的复杂分子机制也尚未阐明,我们仍希望通过本实验对Ser17hIFN-β重组干扰素的研究,可以为临床肿瘤的辅助治疗提供参考。
[1] De Maeyer E,De Maeyer-Guignard J.Type I interferons[J].Int Rev Immunol,1998,17(1-4):53-73.
[2] Doly J,Civas A,Navarro S,etal.Type I interferons:expression and signalization[J].Cell Mol Life Sci,1998,54(10):1109-1121.
[3] Sarkar FH,Gupta SL.Receptors for human gamma interferon:binding and crosslinking of125I-labeled recombinant human gamma interferon to receptors on WISH cells[J].Proc Natl Acad Sci U S A,1984,81(16):5160-5164.
[4] Andzinski L,Kasnitz N,Stahnke S,etal.Type I IFNs induce anti-tumor polarization of tumor associated neutrophils in mice and human[J].Int J Cancer,2016,138(2):1982-1993.
[5] Kaynor C,Xin M,Wakefield J,etal.Direct evidence that IFN-beta functions as a tumor-suppressor protein[J].J Interferon Cytokine Res,2002,22(11):1089-1098.
[6] Sims TL,McGee M,Williams RF,etal.IFN-beta restricts tumor growth and sensitizes alveolar rhabdomyosarcoma to ionizing radiation[J].Mol Cancer Ther,2010,9(3):761-771.
[7] Yang X,Zhang X,Fu ML,etal.Targeting the tumor microenvironment with interferon-β bridges innate and adaptive immune responses[J].Cancer Cell,2014,25(1):37-48.
[8] 黄志斌,党建章,王 妍.重组人干扰素β表达体系及其适应证的研究进展[J].中国生物制品杂志,2011,24(1):117-120.
[9] Spaapen RM,Leung MY,Fuertes MB,etal.Therapeutic activity of high-dose intratumoral IFN-β requires direct effect on the tumor vasculature[J].J Immunol,2014,193(8):4254-4260.
[10] Vitale G,de Herder WW,van Koetsveld PM,etal.IFN-beta is a highly potent inhibitor of gastroenteropancreatic neuroendocrine tumor cell growth in vitro[J].Cancer Res,2006,66(1):554-562.
[11] Qin XQ,Beckham C,Brown JL,etal.Human and mouse IFN-beta gene therapy exhibits different anti-tumor mechanisms in mouse models[J].Mol Ther,2001,4(4):356-364.
[12] Mark DF,Lu SD,Crease AA,etal.Site-specific mutagenesis of human fibroblast interferon gene[J].Proc Natl Acad Sci U S A,1984,81:5662-5666.
[13] Shepard HM,Leung G,Stebbing N,etal.A single a mino acid change in IFN-beta1,abolishes its antiviral activity[J].Nature,1981,294:563-565.
[14] Jablonska J,Leschner S,Westphal K,etal.Neutrophils responsive to endogenous IFN-beta regulate tumor angiogenesis and growth in a mouse tumor model[J].J Clin Invest,2010,120(4):1151-1164.
[15] Wilderman MJ,Sun J,Jassar AS,etal.Intrapulmonary IFN-beta gene therapy using an adenoviral vector is highly effective in a murine orthotopic model of bronchogenic adenocarcinoma of the lung[J].Cancer Res,2005,65:8379-8387.
[16] Meijer DH,Maguire CA,LeRoy SG,etal.Controlling brain tumor growth by intraventricular ad ministration of an AAV vector encoding IFN-beta[J].Cancer Gene Ther,2009,16(8):664-671.
[17] Streck CJ,Dickson PV,Ng CY,etal.Adeno-associated virus vector-mediated systemic delivery of IFN-beta combined with low-dose cyclophosphamide affects tumor regression in murine neuroblastoma models[J].Clin Cancer Res,2005,11(16):6020-6029.
[18] Villaverde MS,Gil-Carden ML,Glikin GC,etal.Interferon-β lipofectionⅠ.Increased efficacy of chemotherapeutic drugs on human tumor cells derived monolayers and spheroids[J].Cancer Gene Ther,2012,19(7):508-516.
[19] Van Dijk KW,Kypreos KE,Fallaux FJ,etal.Adenovirus-mediated gene transfer[J].Methods Mol Biol,2011,693:321-343.
[收稿2016-07-19 修回2016-09-05]
(编辑 张晓舟)
doi:10.3969/j.issn.1000-484X.2017.02.009
Inhibited effects of a recombinant adenovirus expressing Ser17mutant human interferon-β on proliferation of a human colon carcinoma cell line in vitro
TANGLi-Yuan,LINan,MIAOXi-Song,WANGYuan,RUIDan-Yun,TONGYi,WANGBo,LIChen,XIELi.
Kun-mingUniversity,SchoolofMedicine,Kunming650214,China
Objective:To investigate the effect of replication-defective recombinant adenovirus expressing Ser17mutant human IFN-β on the cell proliferation and cycle regulation of a human colon carcinoma cell line in vitro. Methods: Ser17mutant human IFN-β gene was inserted into a shuttle plasmid (pshuttle-CMV).The pshuttle-Ser17hIFNβ was transformed into Ecoli BJ5183 to make a homologous recombination with adenovirus skeleton genome (pAdeasy).And the recombinant plasmid pAd-Ser17hIFNβ was transfected into HEK-293 cell to produce mature adenovirus particles.The change of proliferation and cell cycle of rAd infected HT-29 were analyzed by MTT assay and FACS,respectively.Results: The recombinant adenovirus (rAd-Ser17hIFNβ) with the titer of 109.125CCID50/ml was produced.HT29 cells could be infected with the rAd-Ser17hIFNβ in 20 MOI.The expression of Ser17hIFN-β in HT-29 could be detected by Western blot.Significantly,the rAd-Ser17IFNβ inhibited the growth of HT-29 cells and prevented cell cycle progression in S phage in vitro.Conclusion: The recombinant adenovirus expressing Ser17-mutant human IFN-β could suppress the proliferation of colon carcinoma cell in vitro.It provides an experimental basis to apply the IFN-β gene therapy for colon carcinoma in the future.
Ser17hIFN-β;Colon carcinoma;Recombinant adenovirus
①本文受昆明市科技计划重点项目(2015-1-S-00877)、昆明学院人才项目(YJ216002)和昆明学院科学研究项目资助(XJL12026)。
唐丽媛(1978年-),女,硕士,讲师,主要从事肿瘤的诊断及治疗研究。
及指导教师:谢 力(1978年-),男,博士,副教授,主要从事病毒疫苗与肿瘤的生物治疗研究,E-mail:xieli1022@163.com。
10.3969/j.issn.1000-484X.2017.02.007
R730.54
A
1000-484X(2017)02-0196-06
②昆明医科大学第三附属医院&云南省肿瘤医院,昆明650118。