核定位信号肽在超声靶向破坏微泡介导基因转染治疗犬心肌梗死中的促进作用
崔晶晶 曹省 陈金玲 邓倾 王益佳 周青 胡波
·实验研究·
核定位信号肽在超声靶向破坏微泡介导基因转染治疗犬心肌梗死中的促进作用
崔晶晶 曹省 陈金玲 邓倾 王益佳 周青 胡波
目的 探讨超声靶向破坏微泡(UTMD)技术联合核定位信号(NLS)肽增强犬心肌hAng-1基因体内转染效率的可行性及应用价值。方法构建犬急性心肌梗死模型并分组进行基因转染治疗,每组8只。A组:建模成功后未行治疗,即空白对照组;B组:建模成功后超声介导质粒DNA转染;C组:建模成功后超声介导质粒DNA加经典NLS肽转染;D组:建模成功后超声介导质粒DNA加突变NLS肽转染;E组:建模成功后超声介导质粒DNA加经典NLS肽和入核阻滞剂转染。建模后转染前,HE染色观察心肌梗死后病理变化情况。转染后3 d,心肌冰冻切片检测EGFP标记的hAng-1基因表达情况,RT-PCR和Western Blot分别从基因和蛋白水平方面检测心肌组织hAng-1基因表达效率。转染后28 d,α-SMA免疫组化定位新生毛细血管,并在显微镜下计数新生微血管密度;Masson染色及心脏大体标本评价心肌梗死区纤维化程度及面积。建模前、建模后1周基因转染前及基因转染后28 d分别应用二维超声心动图检测各组犬射血分数及室壁运动情况,比较各组基因治疗效果。结果①A、B、C组心肌组织中绿色荧光蛋白表达量逐渐增高,C、D、E组逐渐减少,Western Blot和RT-PCR检测结果显示hAng-1蛋白及基因表达趋势与绿色荧光蛋白一致,C组与其余各组比较差异均有统计学意义(均P<0.05)。②免疫组化结果显示C组毛细血管密度最高,与其余各组比较差异均有统计学意义(均P<0.05);Masson染色显示A、B、C组心肌纤维化程度依次减低,C、D、E组依次增高。③建模后1周,5组犬均可见节段性室壁运动减低且射血分数明显减低,组间比较差异无统计学意义。基因转染后28 d,A、E组心功能明显减低,B、D组轻度减低,C组轻度增高,C组与其余各组比较差异均有统计学意义(均P<0.05)。结论UTMD联合NLS可高效、靶向地介导质粒DNA在缺血心肌内的表达,并促进血管新生,改善心肌纤维化,这种非侵入性的技术在心脏基因治疗方面将有较好的应用前景。
非病毒载体;超声靶向破坏微泡;核定位信号;基因治疗;心肌梗死;犬
自1990年美国国立卫生研究院健康临床中心实施首例使用逆转录病毒治疗严重联合免疫缺陷病开始[1],基因治疗即成为分子生物学研究的热点。其成功的关键在于构建高效基因转染体系[2]。基因载体的靶向性、安全性及有效性是基因治疗领域需要攻克的难题。新型超声靶向微泡破坏系统、生物素-亲和素系统及抗原-抗体靶向结合(ultrasound-targeted microbubbles destruction,UTMD)等各种非病毒载体系统均有较好的靶向性和安全性,但在体实验转染效率不理想,主要原因是胞浆-胞核转运低效,尤其是细胞处于有丝分裂后期及静止期时。因此,让更多外源性基因功能片段从胞浆进入胞核是提高基因治疗效果的关键。研究[3-4]表明,外源性大分子入核需要核定位信号(nuclear localization signal,NLS)的协助,通过耗能主动转运至细胞核内。本实验应用UTMD联合NLS构建亲核型基因载体,通过研究该载体在大动物心肌梗死模型中的基因转染效率,观察NLS在功能正常及突变后的基因转染效应,探讨该载体能否在应用UTMD促进基因入胞的同时借助NLS促进基因入核,从而探索改善基因治疗效率的方法。
材料与方法
一、实验动物
雄性成年杂种犬48只,由武汉大学人民医院动物实验中心提供,平均体质量(16.3±3.2)kg。
二、实验试剂及制作方法
1.hANGPT1-EGFP质粒(上海吉凯基因化学技术有限公司),大肠杆菌中扩增,然后与WizardTM Maxiprep DNA纯化系统分离,该质粒含有巨细胞病毒,启动子调控的编码绿色荧光蛋白cDNA序列,其表达产物可在活细胞中直接检测。
2.声诺维微泡(意大利博莱科公司),59 mg六氟化硫微泡加入0.9%生理盐水5 ml,充分振荡形成微泡,平均直径约2.5 μm,浓度为2×108~5×108个/ml。
3.NLS肽(PKKKRKV,HPLC:98.61%,分子质量883.1,上海科肽生物科技有限公司),来源于SV40病毒的大T抗原,避光储存于-20℃冰箱,使用前室温放置30min后离心,300r/min,5min,无菌环境下将1mg粉剂溶于1ml磷酸盐缓冲液中,避光储存于-20℃冰箱。
4.明胶海绵颗粒(250 μm,杭州艾力康医药科技有限公司),0.5 ml明胶海绵颗粒与0.5 ml生理盐水混匀备用。
三、实验器械
5 F冠状动脉造影导管,2.8 F微导管,粗导丝,0.014微导丝,6 F动脉鞘管(上海泰尔茂医疗产品有限公司);GE Vivid Q便携式彩色多普勒超声诊断仪(频率1.7~3.3 MHz);Philips FD 20数字减影血管造影机,LEAD 7000心电生理监测仪(四川锦江电子科技有限公司),IX51激光共聚焦扫描荧光显微镜(日本奥林巴斯公司)。
四、模型制作
犬禁食、禁饮8h后,静脉注射戊巴比妥钠30mg/kg麻醉,根据动物反应情况每30~60 min静脉追加戊巴比妥钠50 mg。气管插管,机械通气,备皮,将犬仰卧固定于数字减影血管造影机台上,心电图监测,保温。建立静脉通路,静滴生理盐水及利多卡因,术区碘伏消毒,铺无菌被单。触摸犬右后肢股动脉搏动位置,分离股动脉,结扎远心端。穿刺股动脉并植入6F动脉鞘管,注入肝素1000U。经动脉鞘管引入5 F导管,透视下将导管头搭至左冠状动脉窦口,并行造影确认。经5 F导管引入微导管,精确导入至左冠状动脉第二对角支开口,经微导管将明胶海绵颗粒(约1.0 mm3)推注到左冠状动脉第二对角支远端,造影确认血流阻断,心电图ST段出现弓背样抬高,确认为急性左室心肌梗死模型制备成功。
五、实验方法及各参数检测
1.实验分组:根据转染方式不同将急性心肌梗死犬随机分为5组,每组8只。A组:建模成功后未行治疗,即空白对照组;B组:建模成功后超声介导质粒DNA转染;C组:建模成功后超声介导质粒DNA加经典NLS肽转染;D组:建模成功后超声介导质粒DNA加突变NLS肽转染;E组:建模成功后超声介导质粒DNA加经典NLS肽和入核阻滞剂转染。
2.NLS与hANGPT1-EGFP复合物的制备:按照本课题组前期研究方法[5],利用高效液相色谱法将NLS肽进行纯化,然后与hANGPT1-EGFP以最佳摩尔比104∶1混合,室温下温孵育30 min。
3.基因转染:动物模型建成后1周,各组分别经静脉注入1 ml治疗试剂,B、C、D、E组采用超声基因转染仪进行心前区超声辐照,1 MHz,1.5 W/cm2,辐照10 s,间隔5 s,共5 min[6]。
4.取材:建模后转染前随机挑选3只犬,取梗死区组织以备HE染色。转染3 d后,随机挑选3只犬,取梗死周边区心肌组织各100 g用于心肌冰冻切片、RT-PCR及Western Blot检测。转染后28 d,随机挑选2只犬,取梗死区心肌组织100 g用于Masson染色,取梗死周边区心肌组织100 g用于免疫组化及免疫荧光检测;随机挑选3只犬,取心脏大体标本行HE染色,观察心肌梗死情况。
5.心肌病理形态评价:取心肌组织于4%多聚甲醛溶液固定,常规脱水、石蜡包埋、切片、HE染色,镜下初步观察心肌病理组织学表现。
6.质粒表达情况评价:①心肌冰冻切片检测:取液氮冻存的心肌组织做冰冻切片,在激光共聚焦扫描荧光显微镜下评估EGFP标记的质粒表达情况,488 nm激发波长,每个样品重复测量8~10次;②基因转染效率及蛋白表达量检测:分别提取心肌组织总RNA及蛋白,Western Blot和RT-PCR法分别检测hAng-1基因蛋白表达效率及转染效率。
7.新生毛细血管密度评价:α-SMA免疫组化检测新生毛细血管密度,取心肌标本,石蜡包埋,脱蜡,H2O2浸泡,清洗,孵一抗,二抗,磷酸盐缓冲液清洗,加DAB显色,显微镜下观察,出现棕黄色颗粒即用清水清洗掉DAB,苏木素复染,烘干后用二甲苯透明,树胶封片显微镜(BX52/BX52)下观察,计数毛细血管数。
8.心脏功能的评价:每组各取5只犬于建模前、建模后1周基因转染前、基因转染后28 d应用二维超声心动图测量左室射血分数(LVEF)、左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室短轴缩短率(FS%)及收缩末期容量(ESV)。
9.心肌纤维化程度及梗死面积评价:Masson染色检测心肌纤维化程度,正常心肌纤维呈红色,胶原纤维呈蓝色,细胞核呈蓝黑色,以此区分正常心肌和纤维化瘢痕组织;比较各组心肌纤维化程度。
六、统计学处理
应用SPSS 20.0和Graphpad 6.01统计软件,计量资料以±s表示,所有数据行Kolmogorov-Smirnov检验判断是否符合正态分布。多组间参数比较采用ANOVA分析,进一步两两比较采用LSD法,两组间比较行独立样本t检验;多组间非参数比较行Kruskal-Wallis检验,两组间非参数比较行Mann-Whitney检验。P<0.05为差异有统计学意义。
结果
一、动物模型制作情况
48只犬因麻醉意外死亡2只,室颤死亡3只,术后死亡3只,最终40只出现心电图ST段抬高及冠状动脉造影血流阻断,成功建立心肌梗死模型,见图1。
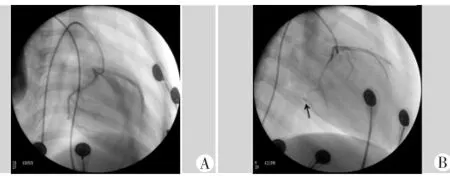
图1 心肌梗死前后DSA图
二、心肌病理形态评价
梗死后心肌组织HE染色可见梗死区心肌细胞核溶解消失,空泡样变及核固缩,代之以瘢痕纤维组织,新生血管少或不明显。见图2。
三、质粒表达情况评价
心肌冰冻切片检测hAng-1基因的表达结果显示各组均可见绿色荧光蛋白表达,且A、B、C组绿色荧光蛋白表达量逐渐增高,C、D、E组逐渐减少。见图3。
Western Blot及RT-PCR检测结果显示hAng-1蛋白及基因表达趋势与绿色荧光蛋白一致,C组与其余各组比较差异均有统计学意义(均P<0.05)。见图4~6。
四、新生毛细血管密度评价
免疫组化显示,新生毛细血管内皮细胞经α-SMA免疫组化染色后呈棕黄色,A、B、C、D、E组新生毛细血管密度计数分别为(4.7±1.6)mm2、(69.8±4.9)mm2、(87.6±4.9)mm2、(67.7±4.2)mm2及(12.3±2.4)mm2,C组与其余各组比较差异均有统计学意义(均P<0.05)。见图7。
五、心脏功能评价
建模前,各组犬室壁运动和心功能均正常;建模后1周基因转染前,各组犬左室运动幅度及射血分数均明显减低,差异无统计学意义;基因治疗后28 d,A、E组心功能明显减低,B、D组轻度减低,C组轻度增高,C组与其余各组比较差异均有统计学意义(均P<0.05)。见表1。
六、心肌纤维化程度及梗死面积评价
Masson染色显示心肌纤维化程度A、B、C组依次降低,D、E组增高(图8)。
讨论
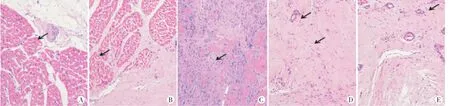
图2 心肌梗死区病理图(HE染色,×200)
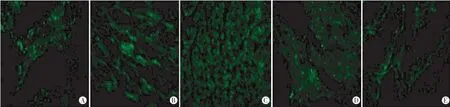
图3 各组心肌冰冻切片的绿色荧光蛋白表达图(×200)

图4 各组Western-Blot检测蛋白条带
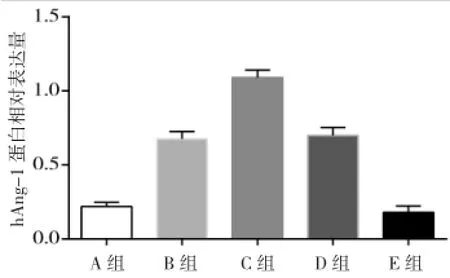
图5 各组hAng-1蛋白相对表达示意图

图6 各组mRNA相对表达量示意图
UTMD介导血管新生的基因治疗为难治性心肌缺血提供了新策略。但研究[7]表明UTMD仅可以增加基因进入细胞质的数量而不能增加其进入细胞核的数量,而外源性基因若要进行有效表达需解决以下问题:①影响细胞膜通透性有效穿过胞膜屏障;②可逆性结合并浓缩DNA的能力;③借助载体复合物顺利通过细胞核表面的核孔复合物(NPCs)穿过核膜屏障进入细胞核的能力。因此探究如何提高基因入核的数量有望进一步改善UTMD介导的非病毒转染体系。本实验结果证明,UTMD联合NLS肽的心肌转染效率明显高于单独UTMD介导的基因转染。

图7 各组梗死周边区新生毛细血管情况(×200)

图8 各组心肌梗死区Masson染色图(×200)
表1 二维超声测量基因转染前后各组犬心脏功能情况(±s)
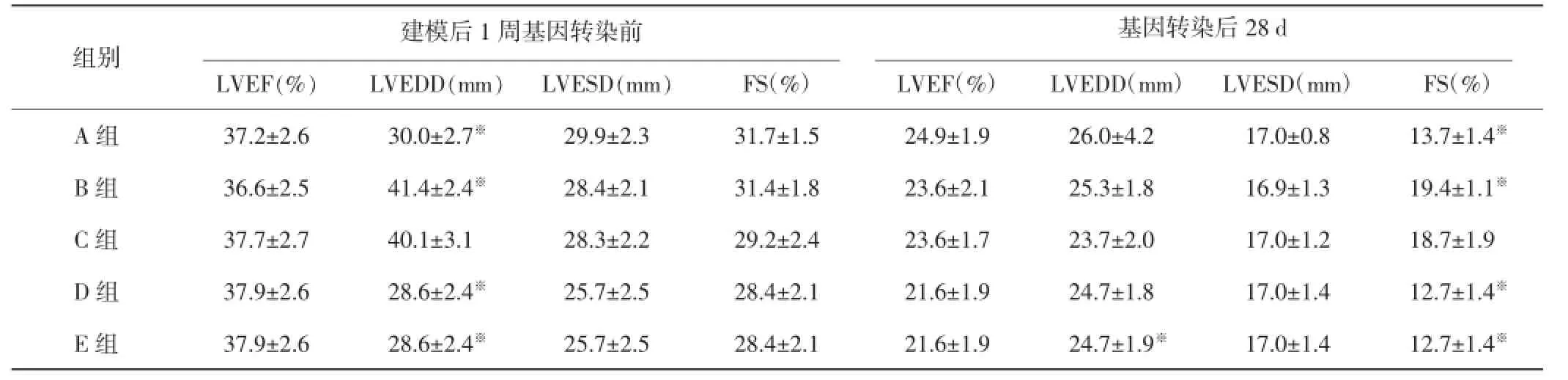
表1 二维超声测量基因转染前后各组犬心脏功能情况(±s)
与C组比较,※P<0.05。LVEF:左室射血分数;LVEDD:左室舒张末期内径;LVESD:左室收缩末期内径;FS:左室短轴缩短率。
建模后1周基因转染前组别基因转染后28 d LVEF(%)LVEDD(mm)LVESD(mm)FS(%)LVEF(%)LVEDD(mm)LVESD(mm)FS(%)A组37.2±2.630.0±2.7※29.9±2.331.7±1.524.9±1.926.0±4.217.0±0.813.7±1.4※B组36.6±2.541.4±2.4※28.4±2.131.4±1.823.6±2.125.3±1.816.9±1.319.4±1.1※C组37.7±2.740.1±3.128.3±2.229.2±2.423.6±1.723.7±2.017.0±1.218.7±1.9 D组37.9±2.628.6±2.4※25.7±2.528.4±2.121.6±1.924.7±1.817.0±1.412.7±1.4※E组37.9±2.628.6±2.4※25.7±2.528.4±2.121.6±1.924.7±1.9※17.0±1.412.7±1.4※
NLS肽是一段富含精氨酸、赖氨酸等碱性氨基酸的短肽,是介导外源性基因入核的一段必要信号片段,且NLS肽具有抵抗酶降解的能力,从而提高了外源性DNA的稳定性[8]。此外,NLS肽对外源性基因还具有压缩和保护功能[9]。Jeon等[10]将NLS肽与PLGA纳米微粒-质粒DNA复合物相结合,可增强该基因载体系统的转化效率,无NLS肽组纳米微粒转化释放可持续9d,但NLS肽结合组转染时间增长,可持续转染13d以上。
本实验设计了UTMD联合NLS肽的亲核型基因转导体系,在利用UTMD提高细胞膜通透性促进外源性DNA进入细胞浆的基础上,再利用NLS肽促使外源性DNA进入细胞核,同时为了进一步验证该亲核型转基因复合物转染效率及NLS肽在亲核型转基因复合物中的作用,本实验设计了NLS肽氨基酸突变组和核受体阻滞剂组。氨基酸突变可使NLS肽功能丧失,同时核受体阻滞剂可使携带hAng-1质粒的NLS肽无法与核输入受体相结合,因此无法通过核孔复合物进入细胞核。本实验中NLS肽与质粒以最佳摩尔比104∶1混合后,由于NLS肽富含精氨酸、赖氨酸等碱性氨基酸,因此在中性环境中带正电荷,能与带负电荷的NLS通过静电吸附非共价结合方式相偶联,且静电结合简单方便,可维护NLS肽和DNA骨架的完整性[11]。同时NLS肽还可与带负电荷的声诺维微泡相结合,使更多目的基因在微泡破裂时进入细胞内。由于超声辐照是一个释放能量的过程,超声辐照下微泡的塌陷和破裂产生的射流能升高组织局部温度,有助于NLS肽进一步联合超声辐照帮助外源性基因趋向核膜并突破核膜,增加基因的入核效率。同时,基因入胞后NLS肽能减少DNA在胞浆中的降解,从而保护治疗基因。
本实验基于以上理论,通过制备高效亲核型转基因复合物对心肌梗死后的大型动物进行基因转染,亲核型载体所载的hAng-1基因在犬缺血心肌内得到良好表达,与其他组比较,hAng-1基因转染及蛋白表达效率得到明显提高,从而验证了UTMD与NLS肽构建的亲核型双靶向载体可有效提高转染效率。同时本实验中C组新生毛细血管密度增多,心肌瘢痕组织面积和纤维化程度明显降低,有效改善了心功能,为缺血性心脏病的基因治疗提供一种新的基因转移途径。
虽然本实验结果表明NLS肽在超声靶向破坏微泡介导基因转染治疗犬心肌梗死中可有效增加目的基因的传递,提高目的基因转染和表达的效率,但是仍存在一些不足:①尽管NLS肽在分子生物学领域已被广泛研究,但其介导基因转染的核输入机制仍不够明确;②本实验所选用的超声参数参考了课题组前期研究成果及国外相关文献,今后的研究仍需要对这种亲核型非病毒载体复合物所用参数进一步优化,为深入研究提供可靠的实验基础。
综上所述,UTMD联合NLS肽可高效、靶向地促进心肌基因转染,这种非侵入性技术在心脏基因治疗上很有前景,将在心血管疾病的治疗中发挥重要作用。
[1]Aied A,Greiser U,Pandit A,et al.Polymer gene delivery:overcoming the obstacles[J].Drug Discov Today,2013,18(21-22):1090-1098.
[2]CarsonAR,McTiernanCF,LavervL,etal.Ultrasoundtargeted microbubble destruction to deliver siRNA cancer therapy[J].Cancer Res,2012,72(23):6191-6199.
[3]Meinema AC,Poolman B,Veenhoff LM.The transport of integral membrane proteins across the nuclear pore complex[J].Nucleus,2012,3(4):322-329.
[4]Marfori M,Mynott A,Ellis JJ,et al.Molecular basis for specificity of nuclear import and prediction of nuclear localization[J].Biochim Biophys Acta,2011,1813(9):1562-1577.
[5]曹省,周青,陈金玲,等.核定位信号肽在超声靶向微泡破坏介导基因转染中的增强效应[J].中华超声影像学杂志,2016,25(3):75-79.
[6]Ling ZY,Shu SY,Zhong SG,et al.Ultrasound targeted micribubble destruction promotes angiogenesis and heart function by inducing myocardial microenvironment change[J].Ultrasound Med Biol,2013,39(11):2001-2010.
[7]Geis NA,Katus HA,Bekeredjian R.Microbubbles as a vehicle for gene anddrugdelivery:currentclinicalimplicationsandfuture perspectives[J].Curr Pharm Des,2012,18(15):2166-2183.
[8]Chen ZY,Yang F,Lin Y,et al.New development and application of ultrasound targeted microbubble destruction in gene therapy and drug delivery[J].Curr Gene Ther,2013,13(4):250-274.
[9]Kim BK,Kang H,Doh KO,et al.Homodimeric SV40 NLS peptide formed by disulfide bond as enhancer for gene delivery[J].Bioorg Med Chem Lett,2012,22(17):5415-5418.
[10]Jeon O,Lim HW,Lee M,et al.Poly(L-lactide-co-glycolide)nanospheres conjugated with a nuclear localization signal for delivery of plasmid DNA[J].J Drug Target,2007,15(3):190-198.
[11]Zhang JP,Wang YG,Li GS,et al.Application of a nuclear localization signal gene in trans gene mice[J].Chinese Science Bulletin,2002,47(3):207-210.
The enhanced effect of nuclear localization signal petide on treating canine myocardial infarction with ultrasound targeted microbubbles destruction mediated gene transfection
CUI Jingjing,CAO Sheng,CHEN Jinling,DENG Qing,WANG Yijia,ZHOU Qing,HU Bo
Department of Ultrasound,Renmin Hospital of Wuhan University,Hubei Key Laboratory of Cardiovascular Disease,Wuhan 430060,China
ObjectiveTo explore the feasibility and application value on enhancing gene transfection by ultrasound targeted microbubbles destruction(UTMD)combined with nuclear localization signal(NLS)petide in treating canine myocardial infarction.MethodsForty canines were randomly divided into 5 groups after the models of myocardial infarction prepared.Group A:blank control group(n=8),group B:UTMD+pDNA(n=8),group C:UTMD+pDNA+cNLS(n=8),group D:UTMD+pDNA+mNLS(n=8),group E:UTMD+pDNA+cNLS+WGA(n=8).Before transfection,HE staining was used to observe the pathological changes after myocardial infarction.3 d after gene transfection,the hAng-1 gene expression was detected in the frozen sections of the myocardium,RT-PCR and Western Blot were used to detect the expression of hAng-1 from the gene and protein level.28 d after gene transfection,α-SMA immunohistochemistry was used to detect capillary density of peri-infarct area and microvessel density(MVD)was detected.Masson’s trichromatic staining and gross specimen were used to evaluate the degree and the area of myocardial fibrosis.Echocardiography was used before myocardial infarction,one week after myocardial infarction and 28 d after gene transfection,the left ventricular ejection fraction(LVEF)and the left ventricular wall motion were detected.The gene transfection efficiency of each group were evaluated and compared.Results①The expression of green fluorescence gradually increased from group A to group C,gradually decreased from group C to group E.Western Blot and RT-PCR showed that the hAng-1 protein expression trends and the gene expression trends in 5 groups was consistent with the expression of green fluorescence.②Immunohistochemical showed the capillary density of group C was the highest,the differences of group C was statistically significant compared with other groups(all P<0.05).Masson’s trichromatic staining and cardiac gross specimen showed that the degree and area of myocardial fibrosis were reduced in an order of group A,B,C and increased in an order of group C,D,E.③One week after myocardial infarction,the left ventricular walls motion and LVEF in 5 groups were significantly decreased,there was no significant difference among the groups;28 d after gene transfection,the LVEF of group A and group E were significantly reduced,the group B and group D were slightly reduced,the group C was slightly increased.The differences of group C was statistically significant compared with other groups(all P<0.05).ConclusionUTMD combined with NLS can be used to deliver plasmid DNA to the myocardium selectively and effectively,and it can promote neovascularization and improve myocardial fibrosis.This noninvasive technique is a promising method for cardiac gene therapy.
Nonviral vector;Ultrasound-targeted microbubbles destruction;Nuclear localization signal;Gene therapy;Myocardium;Canine
R542.2;R540.45
A
2016-10-23)
国家自然科学基金项目(81471674);国家青年科学基金项目(81501495)
430060武汉市,武汉大学人民医院超声影像科心血管病湖北省重点实验室
胡波,Email:115834683@qq.com

