响应面法优化大兴安岭金莲花多糖提取工艺研究
刘洋,余冬阳,李美琪,覃媚媚,赫珊,潘楚,周鸿立
(1.吉林化工学院生物与食品工程学院,吉林吉林132022;2.吉林武警总队医院药剂科,吉林长春130000;3.吉林化工学院化学与制药工程学院,吉林吉林132022)
响应面法优化大兴安岭金莲花多糖提取工艺研究
刘洋1,余冬阳2,李美琪1,覃媚媚1,赫珊1,潘楚1,周鸿立3,*
(1.吉林化工学院生物与食品工程学院,吉林吉林132022;2.吉林武警总队医院药剂科,吉林长春130000;3.吉林化工学院化学与制药工程学院,吉林吉林132022)
利用纤维素酶解法研究大兴安岭金莲花多糖提取工艺。考察温度、pH值、提取时间及加酶量对金莲花多糖提取的影响,利用响应面分析法对金莲花多糖提取条件进行优化。试验获得最佳工艺条件为:温度55℃,时间102min,pH值4.15,加酶量32.23U/g,金莲花多糖提取率达10.43%。
金莲花;多糖;酶解;响应面
金莲花为毛茛科植物,花瓣为金黄色,株高30 cm~100 cm高,主要分布我国北方的高山地区,如我国北方的内蒙和东北等地,金莲花资源都较为丰富[1-3]。在我国清代的《本草纲目拾遗》一书中,就出现了金莲花的药用记载。后经现代生物研究,经证实金莲花提取物具有较好的抗菌、抗病毒等药理作用,目前有关金莲花的应用也多以治疗呼吸道和肠道感染等疾病的药物为主[4-6]。金莲花中活性成分较多,其中黄酮、多糖、挥发油类及有机酸等物质含量较为丰富[7-9]。但目前金莲花的开发主要集中于药物开发,相关保健产品的开发较为少见。
目前的大量研究表明,植物多糖毒副作用小,来源广泛[10],适宜进行药物及保健食品的开发。水提法、酸碱法、酶法、微波辅助等方法,是利用率较高的多糖提取方法[11],其中水提法成本低、效果好,较适宜用于工业化生产。酶法辅助提取是指利用生物酶的专一性,降解细胞壁以及细胞间质中的一些组成物质,破坏细胞壁的结构及其屏障作用,有助于多糖等物质的溶出。果胶酶、木瓜蛋白酶、纤维素酶等是目前酶法提取中常选用的生物活性酶[12]。由于纤维素酶容易溶解,活性较高,因此本试验利用纤维素酶水解提取金莲花多糖。金莲花自古就素有“塞外龙井”的美誉,本研究可为金莲花提取物保健食品的开发提供必要的基础。
1 材料与方法
1.1 材料
大兴安岭地区野生干燥金莲花,碾磨粉碎后备用。
纤维素酶(3 000U/mg):湖南生物科技有限公司;乙醇、硫酸、苯酚等试剂(分析纯):成都市科龙化工试剂厂;AB-8大孔吸附树脂:天津开允公司。
1.2 仪器与设备
JYL-D0料理机:九阳股份有限公司;AL204电子天平(0.0001g):梅特勒托利多仪器(上海)有限公司;AKHL一Ⅲ.5804R离心机:德国Eppendo公司;UV-6100型紫外可见分光光度计:上海美谱达仪器有限公司。
1.3 方法
1.3.1 金莲花多糖提取工艺
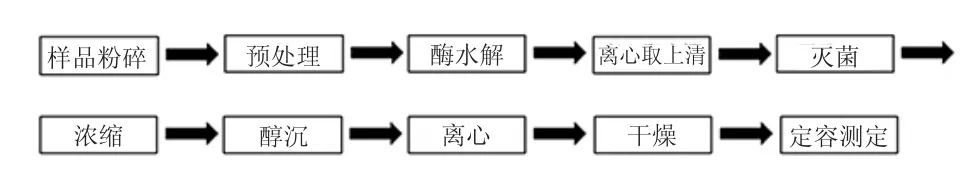
1)样品预处理:粉碎样品后,先用石油醚浸提2次,温度为40℃;再经丙酮浸提2次,温度为50℃;80%乙醇浸提2次,温度70℃。样品干燥至恒重,密封备用[13-14]。
2)离心条件:转速4 000 r/min,时间10min,取上清液备用。
3)灭酶:90℃,10min。
4)真空浓缩:浓缩多糖提取液,至原体积的1/5。
5)醇沉:4℃低温,80%乙醇溶液醇沉过夜。
6)干燥:冷冻干燥。
1.3.2 标准曲线的制作及多糖含量的测定
将葡萄糖放入烘箱,在105℃温度下烘干至恒重,精确称取0.050 0 g,配成浓度为1.0mg/mL的标准溶液。精确移取葡萄糖标准液0.02、0.04、0.06、0.08、0.10、0.12mL,分别以水补至1.0mL,加入6%苯酚溶液1.0mL,再迅速加入浓硫酸5.0mL,搅匀静置20min,以试剂空白为对比,于490 nm波长下测吸光值,以吸光度为横坐标,葡萄糖含量为纵坐标,得回归方程:C= 0.064 2A-0.001(A为样品液在波长490 nm处的吸光度;C为多糖浓度,mg/mL)。R2=0.9982,在葡萄糖浓度为0~1.4mg/mL的范围内,标准曲线呈现良好线性关系。
金莲花多糖含量与提取率的测定:精密称取金莲花粗多糖50mg,配成1.0mg/mL的样品溶液。精密吸取0.5mL溶液,按上法测吸光值,计算金莲花样品中多糖含量。多糖的提取率用下式计算:

1.3.3 单因素试验
在料液比固定在1∶20(g/mL)的条件下,分别考察不同提取温度(45、50、55、60℃)、不同pH值(3.5、4.5、5.5、6.5)、不同提取时间(30、60、90、120min)和不同加酶量(9、18、27、36U/g)对金莲花多糖提取率的影响。
1.3.4 响应面优化试验
以温度、pH值、时间及加酶量为主要影响因素,根据响应面原理,设计四因素三水平试验,见表1所示。

表1 响应面试验设计因素与水平Table1 Test design factors and levels of response surface
1.3.5 粗多糖纯化
试验选用大孔树脂吸附法进行脱色处理,选用Sevag法进行脱蛋白处理[15]。
静态吸附法脱色:取3.0 g处理好的AB-8树脂置于250mL三角瓶中,向其加入50mL浓度为5.0mg/mL金莲花多糖溶液,40℃震荡1.5 h后滤纸过滤测定。
Sevag法脱蛋白:配置混合溶剂,三氯甲烷∶正丁醇为4∶1(体积比)。将样品与溶剂混合,取上清液。平行操作3次,计算脱蛋白率。
脱色率计算公式:
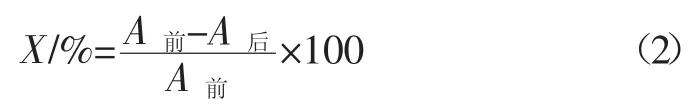
式中:A前为树脂处理前溶液在420 nm处的吸光度;A后为树脂处理后溶液在420 nm处的吸光度。
蛋白去除率计算公式:

式中:M前为树脂处理前蛋白质质量,μg;M后为树脂处理后蛋白质质量,μg。
多糖保留率计算公式:

式中:M前树脂处理前多糖质量,μg;M后分别为树脂处理后多糖质量,μg。
2 结果与分析
2.1 单因素试验
2.1.1 温度对金莲花多糖提取的影响
温度对金莲花多糖提取的影响见图1。

图1 温度对金莲花多糖提取的影响Fig.1 Effect of extraction temperature on the extraction of polysaccharide from Trollius chinensis
由图1表明:在45℃至55℃温度变化范围内,提取率逐渐上升,这是由于温度升高,导致料液分子的运动速率加大,增大了金莲花多糖向细胞外的溶出量;温度达55℃时,金莲花多糖提取率最大;当温度为60℃时,提取率下降。这可能由于温度超过了纤维素酶适宜温度,影响多糖物质的溶出。因此,金莲花多糖提取温度选择55℃为适宜温度。
2.1.2 pH值对金莲花多糖提取的影响
pH值对金莲花多糖提取的影响见图2。
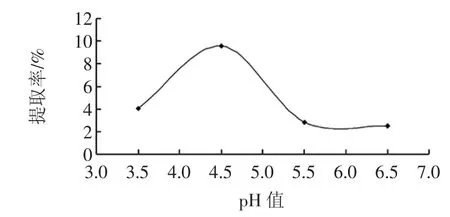
图2 pH值对金莲花多糖提取的影响Fig.2 Effect of pH on the extraction of polysaccharide from Trollius chinensis
从图2可知,金莲花多糖提取率随着当pH值提升而呈现先升后降的趋势。金莲花多糖提取率最大时溶液pH值为4.5,这可能是由于此时纤维素酶处于较为合适的pH值范围内,pH值处于不适合范围,会影响酶的活性。因此,确定pH值为4.5为适宜的提取pH值。
2.1.3 时间对金莲花多糖提取的影响
时间对金莲花多糖提取的影响见图3。

图3 时间对金莲花多糖提取的影响Fig.3 Effect of extraction time on the extraction of polysaccharide from Trollius chinensis
从图3可见,总体来看,金莲花多糖提取率随着提取时间的增加呈先升后降趋势,提取90min时,多糖提取率最大。提取120min后,多糖提取率呈下降趋势,这可能由于在长时间酶作用下,有效成分发生降解,致使多糖提取率降低。因此确定90min为适宜的提取时间。
2.1.4 加酶量对金莲花多糖提取的影响
加酶量对金莲花多糖提取的影响见图4。

图4 加酶量对金莲花多糖提取的影响Fig.4 Effect of enzyme dosage on the extraction of polysaccharide from Trollius chinensis
从图4可见,金莲花多糖得率随加酶量的增加而增加,在加酶量为9U/g~27U/g这一范围内,多糖提取率上升趋势较为明显。加酶量大于27U/g时,提取率增加不显著。推测其原因,可能为加酶量为27U/g时,酶解反应较充分,继续增加酶用量后,酶与底物的接触面积过剩反而会降低反应速率。导致多糖提取率增加不明显,甚至是下降。因此,酶加量控制在两者之间。
2.2 响应面优化试验结果
响应面试验设计方案及试验结果见表2,回归分析见表3。

表2 响应面试验设计及结果Table2 Response surface test design and results

续表2响应面试验设计及结果Continue table2 Response surface test design and results

表3 拟合二次多项式模型的方差分析Table3 Analysis of variance of two polynomial models
经软件分析,得到金莲花多糖提取的二次多项回归方程:
Y=10.08+0.16A+0.60B+0.079C+0.093D+0.056AB-0.63AC+0.04AD+0.26BC+1.18BD-0.33CD+0.063A2-0.84B2-0.62C2-0.78D2。其中,Y为多糖提取率。对模型进行方差分析,由表3可以看出:P<0.000 1,表明该模型极显著。
2.3 金莲花多糖提取的响应面分析
利用Design-Expert8.05软件对表3中的数据进行回归拟合分析,各因素响应效果如图5~图10所示。

图5 pH与温度对提取率的响应面图Fig.5 Effects of temperature and pH on extraction ratio

图6 温度与时间对提取率的响应面Fig.6 Effects of temperature and time on extraction ratio
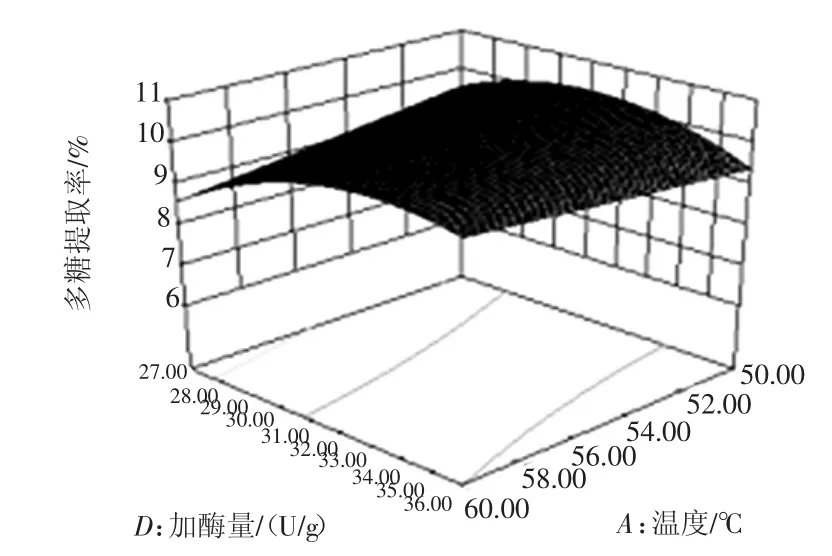
图7 温度与加酶量对提取率的响应面图Fig.7 Effects of extraction temperature and enzyme amount on extraction ratio
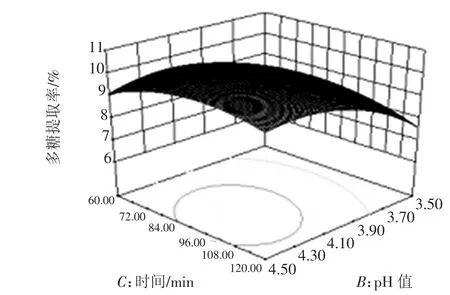
图8 pH值与时间对提取率的响应面图Fig.8 Effects of extraction pH and tim eon extraction ratio

图9 加酶量与pH对提取率的响应面图Fig.9 Effects of extraction pH and enzyme amount on extraction ratio
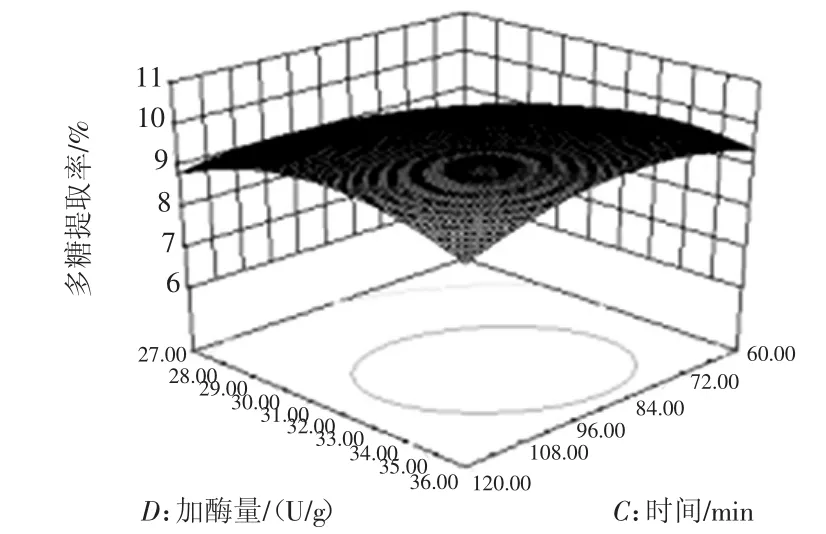
图10 加酶量与时间对提取率的响应面图Fig.10 Effects of extraction time and enzyme amount on extraction ratio
试验对温度、时间、pH及加酶量4个因素中的一个因素取零水平时,另两个因素对金莲花多糖提取的影响进行分析。据回归方程绘制响应面图,图形形状与3D图倾斜度都能反映出各因素之间的相互关系。等高线为圆形表示两因素交互作用不显著,椭圆形则表示两因素交互作用显著;3D图倾斜度越高,坡度越陡,说明两因素交互作用越显著[16-17]。从图可以直观地看出,各试验因素的交互作用较显著。pH值与温度为金莲花多糖提取率有显著影响的两个因素。经优化后,金莲花多糖的最佳提取工艺为:温度55℃,提取时间102min,pH值4.15,加酶量32.23U/g,金莲花多糖提取率达10.43%。
2.4 验证试验
以上述工艺进行3组平行试验,多糖提取率的平均值为10.40%,与预测值相比,两者相对误差仅为0.295%,证明响应面法优化金莲花多糖提取率回归模型较可靠。
2.5 多糖初步纯化试验试验结果
多糖初步纯化试验试验结果见表4。
从表4中可以看出粗多糖纯化试验采用AB-8树脂联合Sevag法纯化金莲花粗多糖,脱色率、脱蛋白率、多糖保留率分别为23.33%、41.778%、85.5%。

表4 多糖初步纯化结果Table4 Purification test results of crude polysaccharide
3 结论
利用酶解法提取金莲花多糖,响应面法优化金莲花多糖的最佳提取工艺,结果为:温度55℃、时间102min,pH值4.15,加酶量32.23 U/g,多糖提取率达10.43%。采用AB-8树脂与Sevag法对样品进行纯化金莲花多糖,样品脱色率、脱蛋白率及多糖保留率分别为23.33%、41.778%、85.5%。这为金莲花的保健食品开发提供了必要理论依据。
[1]钱庄,周哲,石雪静,等.金莲花化学成分及其提取分离的研究进展[J].中国药物经济学,2014(2):95-97
[2]An F,Yang GD,Tian JM,et al.Study on antioxidantion of orientin and vetixin in trollus chinesis in aging mice induce by D-galactose [J].Neural Regener Res,2012,7(33):2565-2575
[3]吴一飞,袁东亚,巩江,等.金莲花药学研究概况[J].山东中医药大学学报,2011,34(6):544-545
[4]侯滨滨.金莲花中黄酮类物质对食用油脂的抗氧化性能研究[J].天津化工,2011,25(2):42-43
[5]刘丽娟,王秀坤,付起凤,等.长瓣金莲花的抑菌作用及其总黄酮的含量测定[J].中草药,2005,23(9):461-463
[6]李超,王乃馨,郑义,等.大叶金花草总黄酮提取物的抗菌活性研究[J].安徽农业科学,2011(8):4470-4471
[7]王如峰,刘瑞凝,赓迪.短瓣金莲花的挥发性成分研究[J].时珍国医国药,2011,22(6):1382-1383
[8]刘洋,隋新,周鸿立,等.大兴安岭金莲花粗多糖提取工艺研究[J].吉林化工学院学报,2012,29(9):51-54
[9]魏金霞,李丹毅,华会明,等.金莲花化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(1):12-15
[10]叶敏.红拖竹荪多糖的提取工艺及其体外抗氧化性[J].贵州农业科学,2012,40(12):172-175
[11]刘洋,李克剑,詹冬玲,等.木瓜蛋白酶辅助提取大蒜水溶性粗多糖的工艺[J].食品研究与开发,2013,34(20):26-29
[12]汪建红,李迪.纤维素酶法提取荸荠皮中多糖的工艺研究[J].食品工业科技,2016,37(5):248-257
[13]陈建平,苏建裕,陈玲,等.梅片树叶挥发油的抗氧化活性研究[J].食品工业科技,2012,22(5):149-180
[14]魏桢元,钟耀广,刘长江.响应面优化法对香菇多糖提取的工艺研究[J].辽宁农业科学,2010(2):11-14
[15]孔凡利.荔枝果肉多糖的分离纯化与结构表征及抗氧化活性研究[D].广州:华南理工大学,2012
[16]张玉祥,邱蔚芬.银杏叶超声波提取工艺研究时[J].时珍国医国药,2006,7(5):784-785
[17]Xu Yaqin,Cai Fei,Yu Zeyuan,et al.Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity[J].Food chemistry,2016,194:650-658
Optimization of Extraction of Polysaccharide from Trollius chinensis Bunge in Daxing'an Mountain by Response Surface Method
LIU Yang1,YU Dong-yang2,LI Mei-qi1,QIN Mei-mei1,HE Shan1,PAN Chu1,ZHOU Hong-li3,*
(1.College of Biological and Food Engineering,Jilin Institute of Chemical Technology,Jilin132022,Jilin,China;2.Pharmacy Department,Jilin Armed Police Corps Hospital,Changchun 130000,Jilin,China;3.College of Chemical and Pharmaceutical Engineering,Jilin Institute of Chemical Technology,Jilin 132022,Jilin,China)
Enzymatic extraction and alcohol precipitation method was used to extract polysaccharide from Trollius chinensis Bunge.On the basis of single factor experiments,polysaccharide extraction conditions were studied by response surface analysis method,the effects of temperature,time,pH and enzyme amount on the polysaccharide extraction were studied.The best technological conditions were obtained:temperature 55℃,time 102min,pH 4.15,enzyme amount32.23 U/g,the extraction yield was up to 10.43%under this condition.
Trollius chinensis Bunge;polysaccharide;enzymatic extraction;response surface method
10.3969/j.issn.1005-6521.2017.03.011
2016-05-11
吉林市科技发展计划资助项目(20162011);吉林化工学院科研项目(2016065)
刘洋(1984—),男(汉),讲师,博士,主要从事现代食品检测及食品中活性成分的提取与分离方向的研究。
*通信作者:周鸿立,教授,主要研究方向:天然产物研究与开发。

