红枣核总黄酮的提取工艺及抗氧化活性研究
范艳丽,张博,李梓溢,仝瑶,张航,翟刚
(宁夏大学,宁夏银川750021)
红枣核总黄酮的提取工艺及抗氧化活性研究
范艳丽,张博,李梓溢,仝瑶,张航,翟刚
(宁夏大学,宁夏银川750021)
采用Box-Behnken Design(BBD)开展响应面试验,研究料液比、乙醇浓度、浸提温度、浸提时间和提取级数五因素及其互作效应对红枣核总黄酮提取率的影响,确定红枣核总黄酮的最佳提取工艺条件为:料液比1∶70(g/mL),乙醇浓度40%,浸提温度80℃,浸提时间4 h,提取级数3次,在此条件下黄酮提取率为16.64 mg/g。此外,以BHT和VC为阳性对照评价了提取物的抗氧化活性,结果表明在一定浓度范围内红枣核总黄酮对超氧阴离子自由基、羟基自由基、DPPH自由基、亚硝基离子自由基、ABTS自由基的最高清除率分别达到53%、85%、71%、68%、91%,总还原能力分别为BHT和VC的35%和36%,表明所提取的红枣核黄酮具有较强的体外抗氧化活性。
红枣核;黄酮;提取;抗氧化
红枣又称华枣、大枣,是鼠李科(Rhamnaceae)枣属植物枣(Ziziphus jujuba Mill.)的果实,原产于我国,在日本和韩国也有少量种植,主要分布在北纬23°~42.5°,东经76°~124°之间的广大区域[1]。现代营养学研究表明,红枣中含有丰富的蛋白质、糖类、有机酸、脂肪、氨基酸等营养成分以及铁、锌、磷、钙、硒等微量元素,还有多种维生素如VC、VP、VA、VB1、VB2等[2-3]。随着人们对红枣成分及其营养功效的深入研究,发现红枣还含有一些具有显著生理活性的特殊生物成分,包括红枣多糖、黄酮、三萜类化合物、腺苷、生物碱和甾醇等[4]。不仅如此,研究表明枣核中同样含有大量的多酚和黄酮类物质,且具有良好的DPPH自由基清除能力[3]和有效抑制α-淀粉酶、α-葡萄糖苷酶及透明质酸酶的活性[5-6]。目前,枣核作为红枣加工及食用后的下脚料绝大多数以废物的形式丢弃或作为燃料被燃烧掉,未能实现更高附加值的资源利用。本研究以枣核为研究对象,采用乙醇提取法制备总黄酮类化合物,通过响应面试验优化工艺参数,并对其进行体外抗氧化活性研究,以此筛选具有较强抗氧化能力的天然抗氧化剂,提高红枣核利用价值,为红枣核的开发利用提供思路和理论依据。
1 材料与方法
1.1 材料与设备
红枣核:由宁夏盛康源红枣酒业生物科技有限公司提供;芦丁、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、石油醚、氯化亚铁、氯化钾、过二硫酸钾,均为分析纯试剂。
RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂;DL-5-A型台式离心机:上海安亭科学仪器厂;JDG-0.2型真空冻干试验机:兰州科近冻干技术有限公司;7230G可见分光光度计:上海精密科学仪器有限公司。
1.2 方法
1.2.1 红枣核总黄酮的提取工艺研究
枣核清洗后,50℃真空干燥,粉碎过40目筛,避光贮存备用。准确称取3.00 g枣核粉,以一定料液比加入乙醇溶液中,用膜封口,水浴搅拌浸提一定时间,离心取提取液,测定黄酮提取率。
1.2.1.1 响应面试验
选取5个单因素,分别为料液比、乙醇浓度、浸提温度、浸提时间和提取级数,研究各单因素对黄酮提取率的影响,并确定各因素的适宜条件。根据各单因素试验结果,采用Box-Behnken Design(BBD)开展响应面试验,研究具有显著影响的因素之间的交互作用,拟合出多元二次回归模型并进行方差分析,最终确定红枣核总黄酮的最佳提取工艺条件。
1.2.1.2 黄酮提取率的测定方法
参照徐红艳等报道的方法[7],采用亚硝酸钠-硝酸铝法,以芦丁作标准品,测定提取物总黄酮含量,按照公式(1)计算提取率(mg/g)。
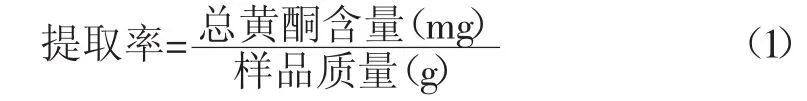
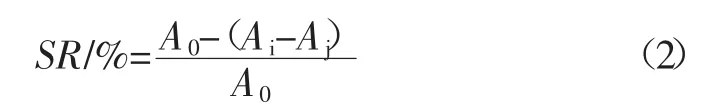
1.2.2.2 清除羟基自由基的活性测定[9]
取5支比色管加入1mL,0.15mg/mL的邻二氮菲溶液和2mL pH7.4的PBS缓冲溶液,混匀,之后加入0.2mg/mL的FeSO4溶液1mL摇匀。分别加入0.2mg/mL样品溶液0.5、1.0、1.5、2.0、2.5mL,混匀。同时做受损伤管和空白参照管。于37℃的水浴中恒温1 h,并在波长536 nm测定受损伤管(A1)、空白参照管(A2)、样品管(A3)和样品参照管(A4)的吸光度值,以VC和BHT作阳性对照,计算清除率SR(%)。

1.2.2 红枣核总黄酮的抗氧化活性研究
1.2.2.1 清除超氧阴离子自由基的活性测定[8]
取0.05mol/LTris-HCl缓冲溶液(pH8.2)5mL,置于25℃水浴中预热20min后,分别加入1mL不同浓度的试样溶液,混匀后加入25℃预热的3mmol/L邻苯三酚溶液0.5mL,混匀后于25℃水浴中反应5min,加入8mmol/L盐酸1mL终止反应,在299 nm处测定溶液的吸光度Ai,同时测定空白对照组吸光度A0。以0.5mL的蒸馏水代替邻苯三酚溶液,在299 nm处测得的吸光度为Aj,以VC和BHT为对照。由公式(2)计算清除率SR(%)。
1.2.2.3 清除DPPH自由基的活性测定[10]
准确称取DPPH 0.008 0 g,用无水乙醇定容于100mL的容量瓶,配制成2.0×10-4mol/L的溶液。量取2mL样品溶液分别放于10mL比色管,加入2mL无水乙醇溶液混匀,避光静置60min,在波长517 nm处测定其吸光度,其值记为Aj,再分别量取样品溶液和DPPH溶液各2mL置于比色管,振荡混匀避光静置60min,在波长517 nm处测定其吸光度,其值记为Ai;然后再量取无水乙醇溶液和DPPH溶液各2mL置于比色管,混匀避光静置60min,在波长517 nm处测定其吸光度,其值记为A0,以VC、BHT作阳性对照。由公式(3)计算得出其清除率SR(%)。

1.2.2.4 清除亚硝基离子的活性测定[11]
将0.2mg/mL的样品溶液0.5、1.0、1.5、2.0、2.5mL分别加入比色管中,分别加入5μg/mLNaNO2溶液1mL,置于37℃水浴锅中恒温30min,加入0.4%对氨基苯磺酸1mL,充分混匀后静置5min,再加入0.2%盐酸萘乙二胺0.5mL,混合均匀后加70%乙醇定容,静置15min,在540 nm处测定各样品管吸光度记为A1,以蒸馏水做空白测定吸光度值记为A0,同时以VC和BHT为阳性对照。由公式(4)计算得出清除率SR(%)。
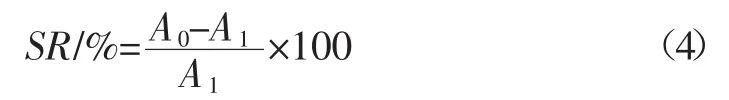
1.2.2.5 清除ABTS自由基的活性测定[12]
将ABTS用蒸馏水配制成浓度为7mmol/L的溶液,然后与等体积的浓度为2.45mmol/L过硫酸钾溶液混合均匀后,避光、4℃条件下放置12 h~16 h。用蒸馏水稀释ABTS溶液使其在734 nm下的吸光值在0.7± 0.02之间,取ABTS溶液(吸光度在0.7±0.02内)3.9mL加入到不同浓度的0.1mL样品溶液中,摇匀,在室温下放置6min,于734 nm波长处测定吸光度。用蒸馏水代替产物作为空白对照,同时以VC和BHT为阳性对照。由公式(5)计算得出其清除率SR(%)。式中:A0为空白管的吸光值;A1为产物吸光值。

1.2.2.6 总还原能力的测定[13]
分别量取1mL不同浓度的样品溶液置于比色管中,分别加入0.2mol/L的磷酸钠缓冲液(pH 6.6)2.5mL和1%铁氰化钾溶液2.5mL,充分混匀后将试管放于50℃水浴中恒温20min,再向其中分别加入10%三氯醋酸溶液2.5mL,3 000 r/min离心10min。分别取上清液2.5mL,加入蒸馏水2.5mL和0.1%FeCl3溶液1mL,振荡混匀静置10min,于波长700 nm处测定其吸光度,由吸光度的大小来判断还原能力的强弱,吸光度越高,还原能力越强。
2 试验结果与分析
2.1 响应面法优化红枣核总黄酮提取工艺
2.1.1 响应面试验结果
在单因素试验基础上,采用料液比1∶70(g/mL)、提取级数3次,以乙醇浓度(X1)、浸提时间(X2)、浸提温度(X3)3个因素作为自变量,黄酮的提取率作为响应值(Y)。根据Box-Behnken Design(BBD)试验设计原理制定因素水平表(见表1)。
采用Design Expertv8.0.7.0软件进行三因素三水平的Box-Behnken Design(BBD)试验设计。整个试验设计在中心点处共有17组试验,试验随机完成,结果见表2。
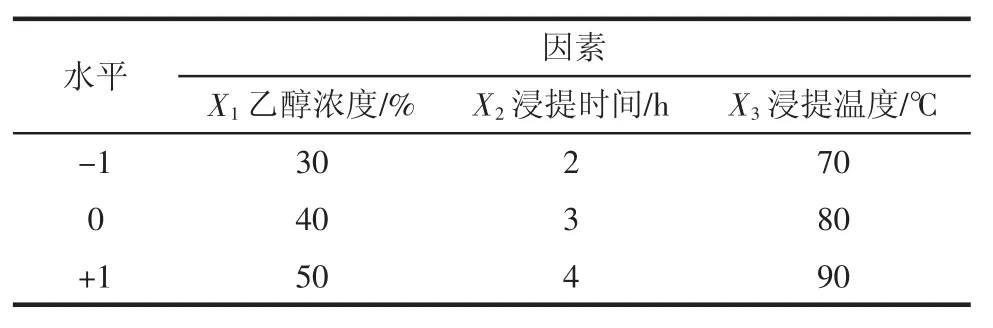
表1 响应面试验因素水平表Table1 Variables and levels in the response surface design
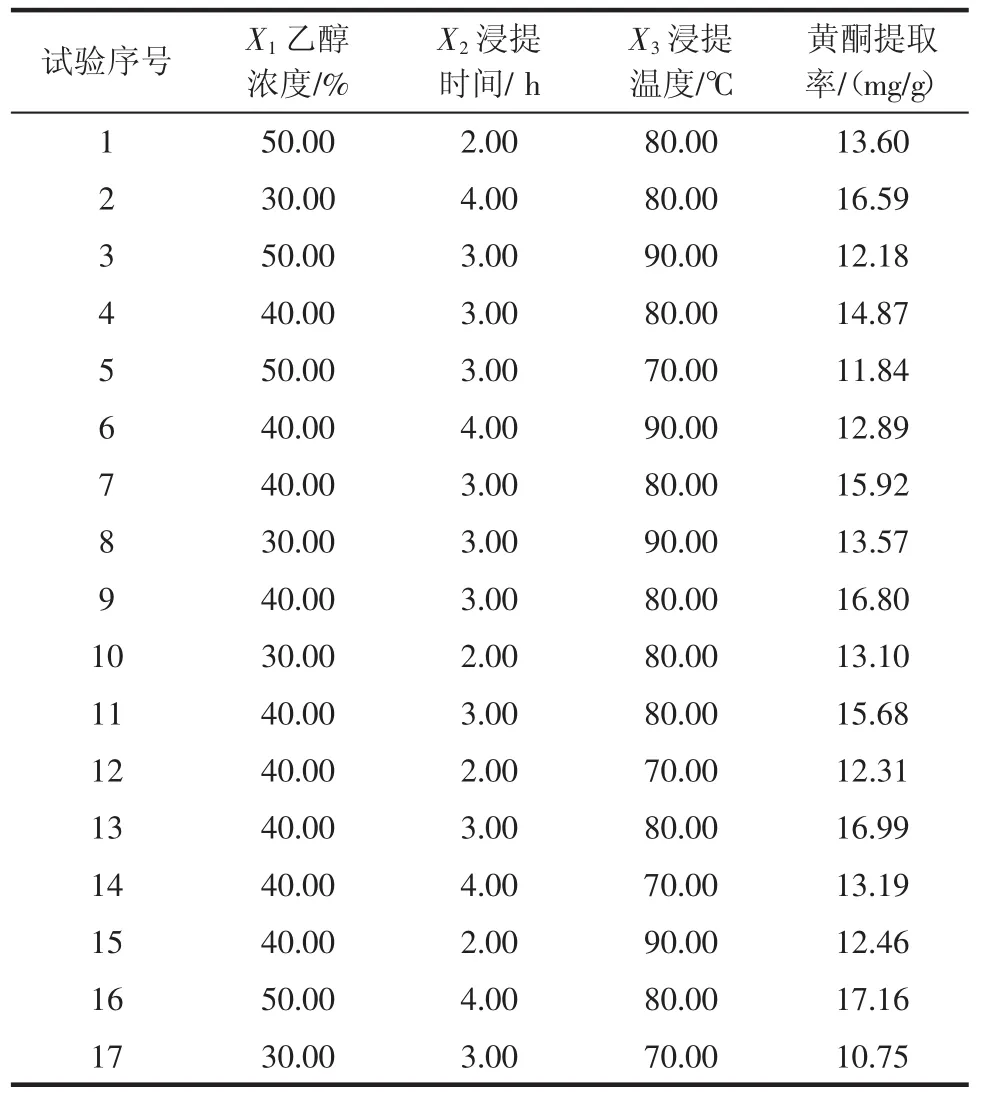
表2 响应面试验设计与结果Table2 Response surface Box-Behnken design arrangement and experimental results
2.1.2 二次多元回归模型的建立与方差分析
响应面回归模型的方差分析及显著性检验结果见表3。
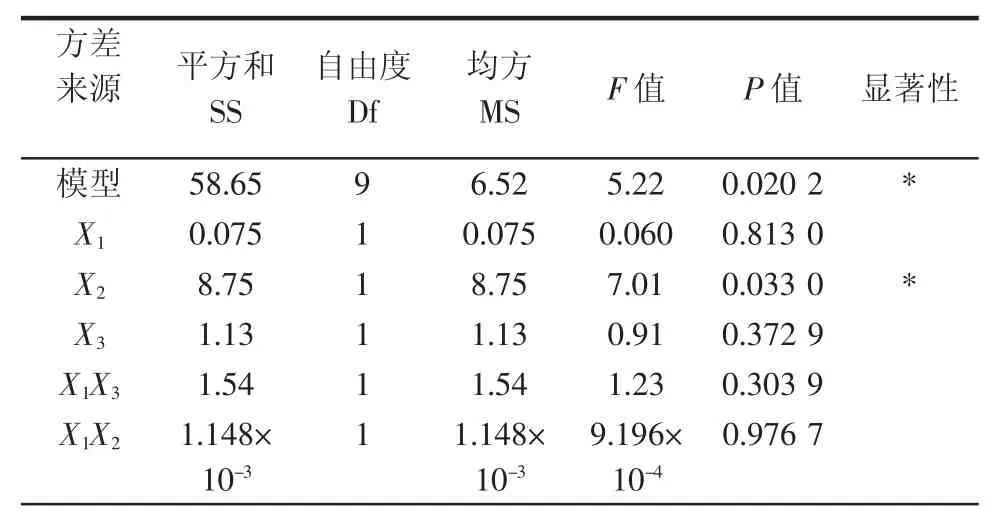
表3 响应面回归模型的方差分析及显著性检验Table3 Variances analysis and significance test for the created regression model

续表3响应面回归模型的方差分析及显著性检验Continue table3 Variances analysis and significance test for the created regression model
分别对X1、X2、X3各因素和响应值Y进行回归拟合,得到黄酮提取率(Y)的二次多元回归方程如下:

由表3方差分析可知,提取率回归模型P=0.020 2<0.05表明模型是显著的,一次项X2(浸提时间)=0.033 0<0.05有显著影响,二次项X3(浸提温度)=0.000 6<0.01有高度显著影响,交互项对回归模型影响不显著,回归模型失拟项P=0.193 1>0.05不显著,说明该回归模型能够很好的拟合试验结果。此外,影响红枣核总黄酮提取率的各因素按照影响大小排序依次为X2(浸提时间)>X3(浸提温度)>X1(乙醇浓度)。
2.1.3 各因素交互作用的响应面分析
图1~图3分别为乙醇浓度、浸提温度、浸提时间三因素交互作用对红枣核总黄酮提取率的响应曲面图。
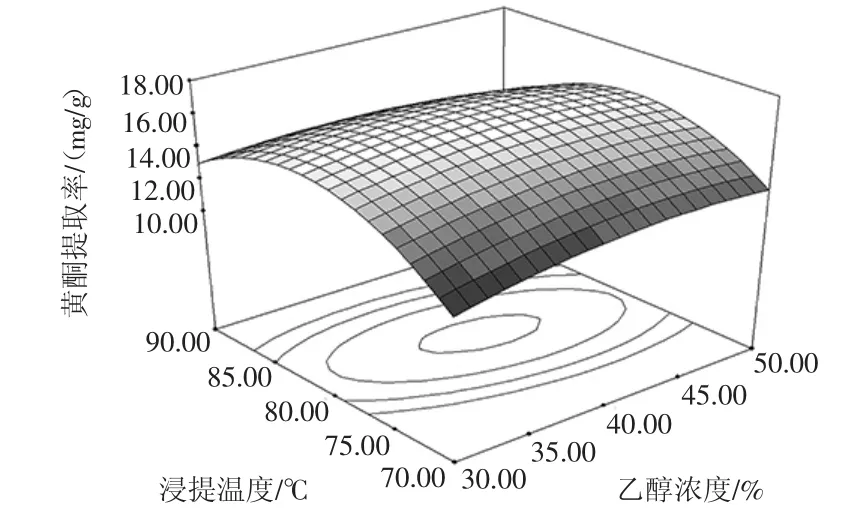
图1 乙醇浓度与浸提温度对红枣核总黄酮提取率影响的响应面图Fig.1 Response surface reflecting the interactive effects of ethanol concentration and extraction temperature on the yield of total flavonoids from Chinese jujube seeds

图2 乙醇浓度与浸提时间对红枣核总黄酮提取率影响的响应面图Fig.2 Response surface reflecting the interactive effects of ethanol concentration and extraction time on the yield of total flavonoids from Chinese jujube seeds
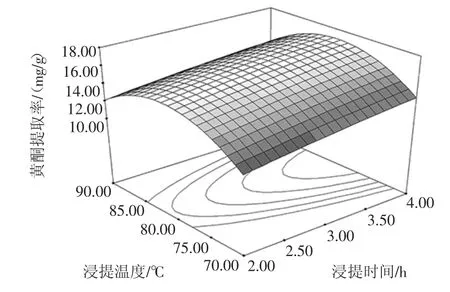
图3 浸提温度与浸提时间对红枣核总黄酮提取率影响的响应面图Fig.3 Response surface reflecting the interactive effects of extraction temperature and extraction time on the yield of total flavonoids in Chinese jujube seed
当浸提时间一定时,乙醇浓度与浸提温度对红枣核总黄酮提取率的交互影响如图1所示。可以看出,当乙醇浓度一定时,随着浸提温度的增加,红枣核黄酮提取率呈现先增加后降低的趋势。当浸提温度低于80℃时,黄酮提取率随着乙醇浓度的增大而增大;当浸提温度大于80℃时,黄酮提取率随着乙醇浓度的增加而增大。而当浸提温度一定时,黄酮提取率随乙醇浓度变化范围不大。
当浸提温度一定时,乙醇浓度与浸提时间对红枣核总黄酮提取率的交互影响如图2所示。可以看出,当乙醇浓度一定时,随着浸提时间的增加,黄酮提取率显著增加;当浸提时间一定时,黄酮提取率随着乙醇浓度的增大仅有小幅变化,表明延长浸提时间,能够有效提高红枣核黄酮提取率。
当乙醇浓度一定时,浸提温度与浸提时间对红枣核总黄酮提取率的交互影响如图3所示。可以看出,当浸提温度一定时,随着浸提时间的增加,红枣核总黄酮提取率呈现上升趋势,尤其在80℃附近显著增加;当浸提时间一定时,黄酮得率随浸提温度的升高先增加后降低。因此表明,一定程度上增加浸提时间并控制浸提温度于80℃,能够提高黄酮提取率。
2.1.4 最佳工艺参数的确定与模型验证
通过红枣核总黄酮提取率的二次多项数学模型,由软件分析得到红枣核总黄酮的最佳提取工艺条件为:乙醇浓度40.74%,浸提温度为79.52℃,浸提时间3.54 h,黄酮理论提取率为16.550 2mg/g,95%置信区间为13.662 4mg/g~19.437 9mg/g。考虑到实际操作问题,最终确定红枣核总黄酮提取工艺条件为:乙醇浓度40%,浸提温度80℃,浸提时间4 h。以此参数进行3组平行验证试验,测得黄酮提取率为16.64mg/g,与理论值基本一致,说明方程与实际情况拟合较好,所建模型适用于提取红枣核黄酮的工艺条件。
2.2 红枣核总黄酮的抗氧化活性评价
2.2.1 对超氧阴离子自由基的清除作用
红枣核总黄酮对超氧阴离子自由基的清除作用见图4。

图4 红枣核总黄酮对超氧阴离子自由基的清除作用Fig.4 Scavenging effect of total flavonoids from Chinese jujube seed on superoxide anion
试验结果显示,当样品浓度小于0.4mg/mL时,红枣核总黄酮对超氧阴离子自由基的清除效果优于BHT和VC。当样品浓度大于0.4mg/mL时,红枣核黄酮和BHT对超氧阴离子自由基的清除率都趋于稳定,而VC的清除率明显增加。红枣核黄酮对超氧阴离子自由基的最大清除率达53%。
2.2.2 对羟基自由基的清除作用
红枣核总黄酮对羟基自由基的清除作用见图5。
如图5所示,红枣核黄酮、VC和BHT对羟基自由基均具有显著的清除作用,但红枣核黄酮的清除作用较VC和BHT略低,但最大清除率仍达到85%。
2.2.3 对DPPH自由基的清除作用
红枣核总黄酮对DPPH自由基的清除作用见图6。
如图6所示,在试验浓度范围内,红枣核黄酮对DPPH自由基的清除效果低于VC,但随浓度的增加,红枣核黄酮的清除效果趋近BHT的清除效果,对DPPH自由基的最大清除率达71%,表明红枣核黄酮对DPPH自由基具有明显的清除效果。

图5 红枣核总黄酮对羟基自由基的清除作用Fig.5 Scavenging effect of total flavonoids from Chinese jujube seed on·OH

图6 红枣核总黄酮对DPPH自由基的清除作用Fig.6 Scavenging effect of total flavonoids from Chinese Jujube seed on DPPH radical
2.2.4 对亚硝基离子的清除作用
红枣核总黄酮对亚硝基离子的清除作用结果见图7。
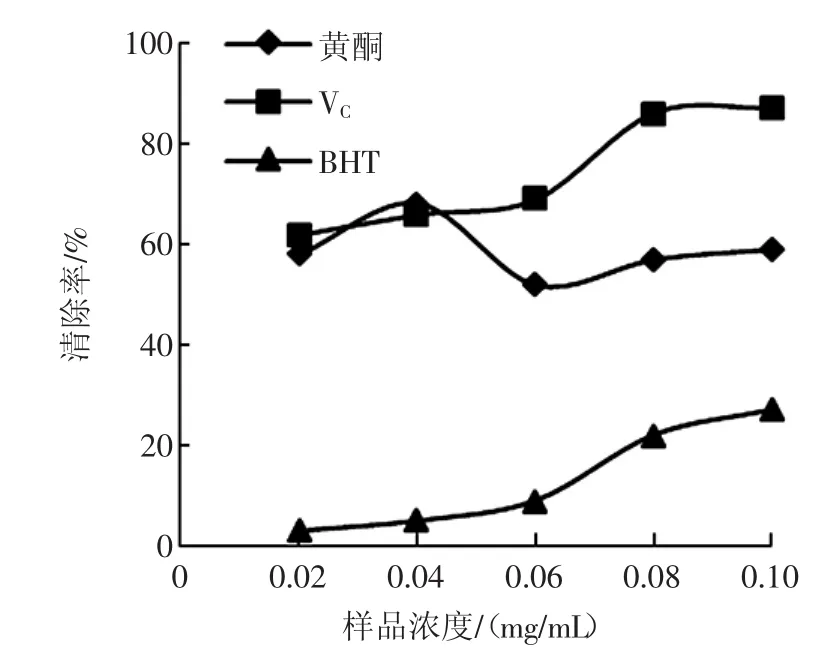
图7 红枣核总黄酮对亚硝基离子的清除作用Fig.7 Scavenging effect of total flavonoids from Chinese jujube seed on nitrite ion
试验表明(如图7),在试验浓度范围内BHT对亚硝基离子的清除率较低,红枣核黄酮和VC对亚硝基离子具有显著的清除效果。其中,VC对亚硝基离子的清除效果优于红枣核黄酮,红枣核黄酮对亚硝基离子的最大清除率为68%。
2.2.5 对ABTS自由基的清除作用
红枣核总黄酮对ABTS自由基的清除作用见图8。
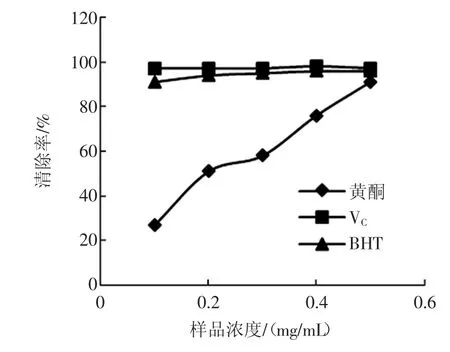
图8 红枣核总黄酮对ABTS自由基的清除作用Fig.8 Scavenging effect of total flavonoids from Chinese jujube seed on ABTS radical
研究发现(如图8),红枣核黄酮、VC和BHT对ABTS自由基均具有显著的清除作用。在试验浓度内,VC和BHT对ABTS自由基的清除效果优于红枣核黄酮,但红枣核黄酮对ABTS自由基的清除率随浓度的增加显著增高。在0.5mg/mL时,红枣核黄酮对ABTS自由基的清除率趋近于VC和BHT,达最大清除率91%。2.2.6红枣核总黄酮的总还原能力
红枣核总黄酮的总还原能力试验结果见图9。
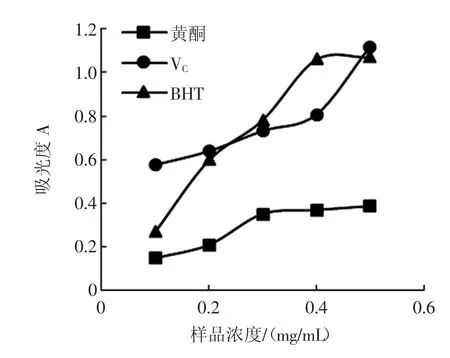
图9 红枣核总黄酮的总还原能力Fig.9 Ferric reducing ability of total flavonoids from Chinese jujube seed
如图9所示,红枣核黄酮在试验浓度范围内和VC、BHT一样随浓度的升高,总还原能力增强,但始终低于VC和BHT的总还原能力。当红枣核黄酮浓度达0.3mg/mL时,其总还原能力趋于稳定,其总还原能力最大达到BHT的35%,VC的36%。
3 结论
1)以提取率(Y)为指标,采用BBD试验设计和响应面分析法得出红枣核黄酮提取工艺参数的回归方程为:Y=16.05+0.097X1+1.05X2+0.38X3+0.017X1X2-0.62X1X3-0.11X2X3-0.78X12-0.16X22-3.18X32
对该模型进行方差和显著性分析,最终得到最优提取条件为:料液比1∶70(g/mL),乙醇浓度40%,浸提温度80℃,浸提时间4 h,提取级数3次。在此工艺条件下黄酮提取率为16.64mg/g。
2)在一定浓度范围内红枣核总黄酮对超氧阴离子自由基、羟基自由基、DPPH自由基、亚硝基离子自由基、ABTS自由基的最高清除率分别达到53%、85%、71%、68%、91%,总还原能力分别是BHT和VC的35%和36%,表明红枣核总黄酮提取物具有较强的体外抗氧化能力。
[1]雷昌贵,陈锦屏,卢大新.红枣的营养成分及其保健功能[J].现代生物医学进展,2006,6(3):56-57,62
[2]张吉祥,欧来良.枣核总黄酮的微波辅助提取工艺优化[J].食品科学,2012,33(16):45-49
[3]张春兰,张锐利,张建花,等.枣核中黄酮类化合物的提取工艺[J].食品研究与开发,2011,32(9):33-36
[4]张吉祥,欧来良.正交试验法优化超声提取枣核总黄酮[J].食品科学,2012,33(4):18-21
[5]张志国,陈锦屏,邵秀芝,等.红枣核类黄酮清除DPPH自由基活性研究[J].食品科学,2007,28(2):67-70
[6]刘杰超,张春岭,刘慧,等.超临界CO2萃取枣核多酚工艺优化及其生物活性[J].食品科学,2013,34(22):64-69
[7]徐红艳,包怡红.响应面法优化胡桃楸种仁壳总黄酮微波提取工艺[J].食品科学,2013,34(18):32-35
[8]吴玉兰.金樱子总黄酮对氧化损伤HUVEC保护作用的研究[D].衡阳:南华大学,2012:15
[9]崔珏,李超,王乃馨,等.大叶金花草总黄酮的抗氧化活性研究[J].中国食品添加剂,2011(4):117-120
[10]李铉军,崔胜云.抗坏血酸清除DPPH自由基的作用机理[J].食品科学,2011(1):86-90
[11]李彩霞,李复兴,李鹏,等.国槐叶黄酮的抗氧化活性研究[J].天然产物研究与开发,2013,25(5):676-680,683
[12]徐红艳,褚凤艳,包怡红.胡桃楸种仁壳黄酮的纯化及抗氧化性研究[J].食品工业科技,2012,33(22):113-118,122
[13]杨桂林,胡祥宇,袁叶飞,等.青果总黄酮体外抗氧化作用研究[J].泸州医学院学报,2012,35(4):397-398
Study on Extraction Process and Anti-oxidative Activity of Total Flavonoids from Chinese Jujube Seeds
FAN Yan-li,ZHANG Bo,LI Zi-yi,TONG Yao,ZHANG Hang,ZHAI Gang
(Ningxia University,Yinchuan 750021,Ningxia,China)
The extraction effects of solid to liquid ratio,ethanol concentration,extraction temperature,extraction time,extraction times and their interaction on total flavonoids from Chinese jujube seeds were studied using response surface methodology by Box-Behnken Design(BBD).The optimum extracting condition of total flavonoids was ascertained as solid to liquid ratio1∶70(g/mL),ethanol concentration 40%,extraction temperature 80℃,extraction time 4 h and 3 times,and the extraction rate of total flavonoids on this condition was 16.64mg/g.Moreover,the antioxidant activity of the product was evaluated taking VCand BHT as positive controls.The results showed that the optimum scavenging rate of the product on oxygen free radical,hydroxyl radicals,DPPH free radicals,nitroso ion and ABTS radicals was 53%,85%,71%,68%and 91%respectively,and the total reductive ability was 35% of BHT and 36%of VC,revealing the significant antioxidant activity of the extracted flavonoids from Chinese jujube seeds in vitro.
Chinese jujube seeds;flavonoids;extraction;anti-oxidation
10.3969/j.issn.1005-6521.2017.03.021
2016-05-14
宁夏大学科学研究基金项目(ZR1437)
范艳丽(1980—),女(汉),副教授,博士,研究方向:生物资源利用与开发。

