基于化学发光磁酶免疫分析技术检测单增李斯特菌
范龙兴,宁保安,孙智勇,白家磊,彭媛,曲晓辰,刘超,乌恩琦,高志贤,*,刘颖,*
(1.内蒙古医科大学公共卫生学院,内蒙古呼和浩特010110;2.军事医学科学院卫生学环境医学研究
所天津市环境与食品安全风险监控技术重点实验室,天津300050;3.中国人民解放军第十一医院,新疆伊宁835000)
基于化学发光磁酶免疫分析技术检测单增李斯特菌
范龙兴1,2,宁保安2,孙智勇3,白家磊2,彭媛2,曲晓辰1,刘超2,乌恩琦1,高志贤2,*,刘颖1,*
(1.内蒙古医科大学公共卫生学院,内蒙古呼和浩特010110;2.军事医学科学院卫生学环境医学研究
所天津市环境与食品安全风险监控技术重点实验室,天津300050;3.中国人民解放军第十一医院,新疆伊宁835000)
探索化学发光磁酶免疫分析技术在单核细胞增生性李斯特菌检测中的应用,并初步建立和优化检测方法及条件。将抗LM兔多抗与磁性微球偶联构建免疫磁分离原件,应用双抗夹心法ELISA检测LM全菌抗原,应用化学发光法进行定量检测,应用正交设计优化主要反应条件,建立标准曲线,测试灵敏性与特异性。通过正交试验优化的反应条件为37℃条件下,免疫磁珠用量20μL、含0.1%BSA的PBS封闭15min,捕获抗原2 h,HRP标记的抗LM单抗稀释至1∶10 000(体积比)特异性结合反应30min后进行化学发光检测,标准曲线拟合优度0.954,最低检出限104CFU/mL,特异性良好,检测时限为3h~4 h。
化学发光;免疫磁珠;单增李斯特菌
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)简称单增李斯特菌,是有着强大致死能力的食源性致病菌之一,其感染致命性仅次于沙门氏菌[1-3]。单增李斯特菌广泛存在于自然环境中,且在4℃条件下仍能缓慢生长,人类主要通过受其污染的肉乳及其制品感染而发病[4-5]。因此,我国对食源性单增李斯特菌的检测十分重视。目前,我国检测单增李斯特菌的金标准仍然是传统的培养法[6],但过长的检测周期和繁琐的操作仍然无法满足快速检验的要求。酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)自提出以来,广泛应用于食品安全检测,但常规的ELISA需要复杂的样品前处理和繁琐的洗脱程序,这同样使检测过于耗时,且灵敏性和特异性受到一定影响[7-8]。化学发光免疫分析技术(chemiluminescence immunoassay,CLIA)有着较高的灵敏性,近年来备受学者们的关注[9-10]。同时,随着新兴的磁性纳米材料的研究和发展,应用免疫磁分离技术(immunomagnetic separation,IMS)使得简化样品前处理和快速富集目标物成为可能[11-13]。本研究以单增李斯特菌为目标物,将化学发光测定技术、磁分离技术与夹心法ELISA相结合,旨在探索并建立一个快速灵敏的食源性致病菌检测方法。
1 材料与方法
1.1 材料
1.1.1 试验动物
雄性新西兰白兔:军事医学科学院实验动物中心。
1.1.2 菌株
单核细胞增生性李斯特菌(L.monocytohenes,LM)、英诺克李斯特菌(L.Innocua,LI)、威尔斯李斯特菌(L.Welshimeri,LW)、大肠杆菌O157:H7(E.Coli O157:H7,O157:H7)、沙门氏菌(Salmonella,Sal)、金黄色葡萄球菌(S.Aureus,SA):军事医学科学院卫生学环境医学研究所冻存。
1.1.3 主要试剂
含0.6%酵母浸膏的胰酪胨大豆肉汤TSB-YE:中国Solarbio公司;弗氏完全/不完全佐剂:美国Sigma公司;Protein A琼脂糖凝胶亲和层析柱、PD-10脱盐柱:美国General Electric公司;Dynabeads M-270环氧基磁珠抗体偶联试剂盒、Pierce增强型化学发光底物液:美国Themo Fisher公司;HRP标记抗LM鼠源单抗:英国abcam公司。
1.1.4 主要仪器
DRP-9162电热恒温培养箱:中国森信公司;ZWY-100H温控回旋台式震荡器:中国上海智诚公司;涡旋振荡器;HS-3型垂直混合仪:中国宁波新芝公司;DynaMag-2磁分离器、Multiskan MK3酶标仪、Fluoroskan AscentFL荧光/化学发光分析仪:美国Themo Fisher公司。
1.1.5 主要分析软件
Image J1.45:美国softonic公司;SPSS 22.0:美国IBM公司。
1.2 方法
1.2.1 全菌灭活抗原的制备
将上述保存于-80℃的菌株复苏纯化,接种于含0.6%酵母浸膏的胰酪胨大豆肉汤培养基中,37℃震荡增菌16 h,4℃、4 000 r/min离心10min去除培养基,重悬于pH7.4PBS缓冲液中,进行平板计数。应用终浓度0.4%甲醛溶液37℃灭活24小时,4℃、4 000 r/min离心10min更换缓冲液除去甲醛,将灭活抗原浓度定溶至109CFU/mL,4℃保存。
1.2.2 免疫磁珠的制备
取成年健康雄性新西兰白兔2只行四点免疫(颈背部皮下2点、后肢肌肉2点),每只1mL抗原量,每次免疫追加抗原用量,每次免疫间隔2周,第3次免疫后进行间接ELISA检测抗血清效价,梯度至1∶104~1∶105(体积比)时,腹腔麻醉后行颈总动脉取血。兔源抗LM IgG多克隆抗体粗纯化采用辛酸-硫酸铵法,再采用亲和层析法进一步纯化多克隆IgG抗体,最后进行蛋白定量及特异性检测。参照DynabeadsM-270环氧基磁珠抗体偶联试剂盒说明书,按30μg抗体/mg磁性微珠比例偶联,免疫磁性微球定溶至10mg/mL,4℃保存。
1.2.3 检测方法的建立及条件优化
偶联有兔源抗LM IgG多抗的免疫磁性微珠作为捕获元件,HRP标记的抗LM鼠源IgG单抗作为检测抗体,建立200μL反应体系的双抗夹心化学发光磁酶免疫分析法检测单增李斯特菌。抗原浓度为106CFU/mL,根据正交设计进行试验对反应条件进行优化。
1.2.4 确定检出限及特异性
用pH7.4 PBS缓冲液将单增李斯特菌全菌抗原稀释至103CFU/mL~108CFU/mL,根据1.2.3建立的方法进行灵敏性检验,并绘制标准曲线。应用浓度为106CFU/mL的单增李斯特菌、英诺克李斯特菌;威尔斯李斯特菌、大肠杆菌O157:H7、沙门氏菌、金葡菌灭活全菌抗原对1.2.3建立的方法进行特异性检验。
1.2.5 模拟实际样品检测
将单增李斯特菌灭活全菌按105、106、107CFU/mL加入牛肉浸膏培养基中混匀,应用1.2.3建立的方法进行回收检测。
2 结果
2.1 兔源抗LM IgG多抗效价及特异性
第5次免疫后间隔1周耳缘静脉采血检测抗血清效价及特异性。抗血清效价见图1,将抗血清按梯度稀释后与106数量级各灭活全菌抗原进行间接ELISA检测。各梯度吸光值与阴性血清1∶1 000(体积比)稀释吸光值之比大于2.1为判断标准,效价可达1∶64 000~ 1∶128 000(体积比),抗血清特异性良好,仅对英诺克李斯特菌和威尔斯李斯特菌有轻微非特异性反应。多抗效价见图2,抗血清纯化后多抗效价可达1∶6 400~ 1∶12 800(体积比),仍有轻微非特异性反应。

图1 兔源抗血清效价及特异性检测结果Fig.1 The titer and specificity of rabbit antiserum were detected

图2 纯化兔源多克隆抗体效价及特异性检测结果Fig.2 The titer and specificity of purified rabbit polyclonal antibody were detected
2.2 检测方法关键条件优化
以107CFU/mL单增李斯特菌灭活抗原为检测目标物,根据正交试验设计L27(35×24)对化学发光磁酶免疫分析检测方法的关键条件进行优化,主要优化因素见表1。检测指标以相对化学发光值比表示,计算方法见公式1。试验结果见表2,方差分析结果见表3。

表1 化学发光磁酶免疫分析检测优化正交设计因素水平Table1 Factor level of chemiluminescent magnetic enzyme immunoassay were optimized by orthogonal design

表2 化学发光磁酶免疫分析检测优化正交试验结果Table2 The optimization results of orthogonal design for chemiluminescent magnetic enzyme immunoassay

续表2化学发光磁酶免疫分析检测优化正交试验结果Continue table2 The optimization results of orthogonal design for chemiluminescent magnetic enzyme immunoassay

表3 化学发光磁酶免疫分析检测优化正交试验方差分析结果Table3 Analysis of variance of orthogonal design for chemiluminescent magnetic enzyme immunoassay

如结果所示,免疫磁球用量A(F=5.365,p=0.036)、捕捉孵育温度C(F=92.902,p=0.000)、捕捉孵育时间D(F=8.757,p=0.003)和检测洗脱次数H(F=6.384,p= 0.024)的主效应有统计学意义,其余因素差异不显著。故根据正交试验结果并综合专业理论及经济条件,选择A1B2C2D3E1F2J2H2(即取20μL免疫磁球、封闭或冲洗15min、37℃捕捉目标物2 h、洗脱1次、1∶10 000(体积比)稀释检测抗体37℃孵育30min、洗脱3次后进行检测)为最佳条件,进行后续试验。
2.3 绘制标准曲线确定检出限
根据2.2优化条件,将单增李斯特菌灭活抗原按梯度稀释至104CFU/mL~108CFU/mL,重复试验每次试验设立3个平行孔,绘制标准曲线,确定检出限。标准曲线见图3。

图3 化学发光磁酶免疫分析检测单增李斯特菌灵敏性试验结果(±S)Fig.3 Sensitivity test results of Listeria monocytogenes detected by chemiluminescent magnetic enzyme immunoassay(x±S)
相对化学发光值比与浓度变化近似呈线性关系,线性拟合优度R2=0.954。根据公式1,相对化学发光值比已排除背景值影响,故检出限为104CFU/mL(相对化学发光值比0.203)。
2.3 化学发光磁酶免疫分析的特异性检测
将单增李斯特菌及其他菌株作为抗原,检测化学发光磁酶免疫检测方法的特异性。特异性检测结果见图4。
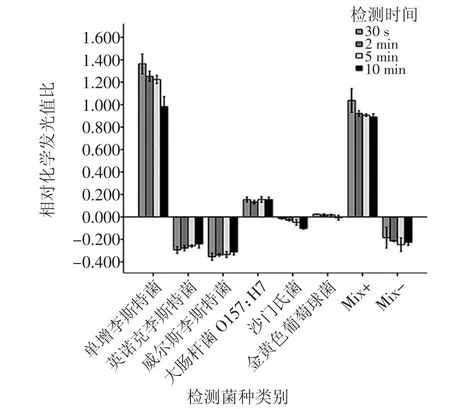
图4 化学发光磁酶免疫分析检测特异性试验结果(x±S)Fig.4 Specific test results of chemiluminescent magnetic enzyme immunoassay(x±S)
单增李斯特菌检测值和单增李斯特菌混合抗原(Mix+)检测值呈显著阳性结果,混合抗原较单纯单增李斯特菌抗原相对化学发光值比偏低,可能与多抗非特异性吸附有关。其他抗原检测值均小于0.2,故本检测方法对单增李斯特菌有显著的特异性。
2.4 食物样品加标模拟检测
将单增李斯特菌灭活全菌抗原稀释至105、106、 107CFU/mL,分别加入至灭菌牛奶、灭菌牛肉膏溶液、灭菌卤肉汤中,调节pH值至7.2~7.4后进行模拟检测试验。不同食物样品加标模拟试验结果见图5。
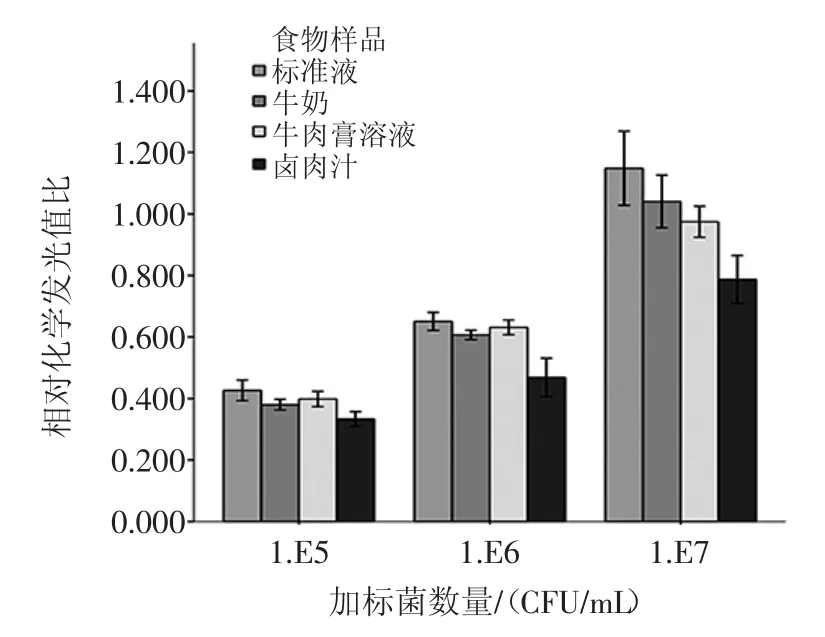
图5 不同食物样品加标模拟试验结果(x±S)Fig.5 Simulation test results of different food samples(x±S)
如图5所示,与标准液(pH7.4,0.01mol PBS缓冲液)相比,牛奶与牛肉膏溶液回收值较好,卤肉汁检测结果偏低,可能与卤肉汁中盐离子强度过高,影响抗体识别活性有关。
3 分析与讨论
本研究以传统的免疫分析为基础,结合磁分离技术和化学发光检测技术初步建立并优化了一个针对食品中单增李斯特菌为检测目标物的化学发光磁酶免疫分析方法。众所周知,传统的免疫分析(ELISA)方法主要依赖于高特异性抗体,而目前全国乃至全球,能识别单增李斯特菌的高特异性抗体仍然不多且售价昂贵。我们以本所冻存的单增李斯特菌菌株为抗原制备兔源抗单增李斯特菌多克隆抗体,在我们的研究中得到了识别能力良好的多抗,虽然其对英诺克李斯特菌和威尔斯李斯特菌存在一定程度的非特异性识别,但将其与磁性微球偶联和传统的酶标板固相载体相比大大增加了反应面积,有利于捕获检测样品中的单增李斯特菌,同时相比识别能力相差不多的进口多抗,我们节约了大量生产成本有着重要的经济效益。
目前食源性单增李斯特菌的主要有培养法、ELISA和PCR法等,培养法的主要缺点是用时过长;ELISA法虽然检测较为快速但其繁琐的洗脱过程导致检测的灵敏性和特异性不高且难以达到定量的要求[14-16];PCR法检测同样较为迅速,但其需要一个精细的样品前处理环节,同时以来于高特异性的扩增引物,在实际检测中往往因此出现非特异性扩增,从而导致误判[17-19]。化学发光检测技术十分灵敏曾广泛应用于痕迹检测[20],本研究将传统ELISA与其结合,增加了检测中的灵敏度。应用免疫磁微球识别检测样品中的目标物简化了样品的前处理过程,使目标物容易分离[21]。捕获识别过程在一个动态溶液中进行,相比传统ELISA静置孵育,大大增加了识别载体与目标物的接触机会,有利于对目标物的捕获。
我们应用正交试验设计优化了检测方法的主要反应条件,简化了多余的洗脱次数,将检测时间优化到最少,3 h~4 h即可进行一次试验。在试验中我们还发现,化学发光检测技术虽然灵敏性很高,但其发光稳定性并不好。针对这一问题,我们在试验中将检测的发光值进行换算,以相对化学发光值比为检测指标,同时每次检测需要绘制标准曲线,排除批间试验差异过大的问题,使检测结果稳定容易比较。
4 结论
本研究将免疫分析技术、磁分离技术和化学发光检测技术相结合,初步建立并优化了一个以食品中单增李斯特菌为目标物的快速检测方法。根据正交试验设计,我们发现该检测方法对检测环境要求不高,整个试验在37℃条件下进行,所需时间3 h~4 h即可完成。试验操作较为简便,检测限可达104CFU/mL,与其他菌株交叉反应极低,具有良好的灵敏性和特异性。本研究初步建立的检测方法一些反应条件仍可进一步优化,其社会效益和经济效益均不容小觑,它为快速检验食品中单增李斯特菌和其他食源性致病菌提供了一个良好思路。
[1]Goulet V,Hedberg C,Le M A,et al.Increasing incidence of listeriosis in France and other European countries[J].Emerging Infectious Diseases,2008,14(5):734-740
[2]崔焕忠,乔立桥,王义冲.单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J].中国畜牧兽医,2010(1):128-133
[3]Pamer EG.Immune responses to Listeria monocytogenes[J].Nature Reviews Immunology,2004,4(4):812-823
[4]朱小花,李燕杰,杜冰,等.食品工业中生物被膜态与浮游态单核细胞增生性李斯特菌的危害及其控制[J].食品研究与开发, 2010,31(10):212-216
[5]郭宏华,贾芙蓉,韩晓英,等.单核细胞增生性李斯特菌研究进展[J].中国实验诊断学,2013,17(1):197-199
[6]中华人民共和国卫生部.GB 4789-2010食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验[S].北京:中国标准出版社,2010:3-26
[7]Portanti O,Di F T,Luciani M,et al.Development and validation of an antigen capture ELISA based on monoclonal antibodies specific for Listeria monocytogenes in food[J].Veterinaria Italiana,2011,47 (3):271-280
[8]Cavaiuolo M,Paramithiotis S,Drosinos EH,et al.Development and optimization of an ELISA based method to detect Listeria monocytogenes and Escherichia coli O157 in fresh vegetables[J].Analytical Methods,2013,5(18):4622-4627
[9]Zhang Y,Tan C,Fei R,et al.Sensitive chemiluminescence immunoassay for E.coli O157:H7 detection with signal dual-amplification using glucose oxidase and laccase[J].Analytical Chemistry, 2014,86(2):1115-1122
[10]Chen L,Zhang Z,Zhang X,et al.A novel chemiluminescence immunoassay of staphylococcal enterotoxin B using HRP-functionalised mesoporous silica nanoparticle as label[J].Food Chemistry, 2012,135(1):208-212
[11]Estrada C SM L,Velázquez L D C,Favier G I,et al.Detection of Yersinia,spp.in meat products by enrichment culture,immunomagnetic separation and nested PCR[J].Food Microbiology,2012,30(1): 157-163
[12]Zhao W,Zhang W P,Zhang Z L,et al.Robust and highly sensitive fluorescence approach for point-of-care virus detection based on immunomagnetic separation[J].Analytical Chemistry,2012,84(5): 2358-2365
[13]董乾,王君,郝红,等.磁性微球的制备方法及应用[J].离子交换与吸附,2015(5):472-480
[14]Cavaiuolo M,Ferrante A,Botticella G,et al.Evaluation of an ELISA method to detect Listeria monocytogenes in fresh-cut rocket[J].Acta Horticulturae,2015(1071):369-372
[15]段霞,黄欣,黄岭芳,等.双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌[J].食品科学,2010,31(24):272-276
[16]刘雅莉,刘芳,韩舜愈,等.九种单核细胞增生性李斯特菌检测技术效果比较及评价[J].中国生物工程杂志,2012,32(6):84-92
[17]Oliveira M A D,Ribeiro EGA,Bergamini A M M.Quantification of Listeria monocytogenes,in minimally processed leafy vegetables using a combined method based on enrichment and 16S rRNA realtime PCR[J].Food Microbiology,2010,27(1):19-23
[18]Garrido-Maestu A,Chapela M J,Vieites JM,et al.Application of real-time PCR to detect Listeria monocytogenes,in a mussel processing industry:Impact on control[J].Food Control,2014,46(12): 319-323
[19]冯可,胡文忠,姜爱丽,等.单核细胞增生性李斯特菌分子生物学检测技术的研究进展[J].食品工业科技,2014,35(4):392-396
[20]汪晨,吴洁,宗晨,等.化学发光免疫分析方法与应用进展[J].分析化学,2012,40(1):3-10
[21]唐瑶,许宙,丁利,等.磁性纳米材料在食品组分分离和安全检测领域的研究进展[J].食品与机械,2015(6):224-227
Detection of Listeria monocytogenes through Chemiluminescent Magnetic Enzyme Immunoassay
FAN Long-xing1,2,NING Bao-an2,SUN Zhi-yong3,BAI Jia-lei2,PENG Yuan2,QU Xiao-chen1,LIU Chao2,WU En-qi1,GAO Zhi-xian2,*,LIU Ying1,*
(1.College of Public Health,Inner Mongolia Medical University,Hohhot010110,Inner Mongolia,China;2.Tianjin Key Laboratory of Risk Assessment and Control Technology for Environment and Food Safety,Tianjin Institute of Health and Environmental Medicine,Tianjin 300050,China;3.Chinese PLA Eleventh Hospital,Yining 835000,Xinjiang,China)
To explore the application of chemiluminescent magnetic enzyme immunoassay in the detection of Listeria monocytogenes,and to establish and optimize the detection methods and conditions.The magnetic beads were coupled with rabbit anti LM polyclonal antibody to structure the original of immunomagnetic separation.L.monocytogenes was detected by chemiluminescence through double antibody sandwich ELISA.Orthogonal design was used to optimize the reaction conditions,and to establish the standard curve,the sensitivity and specificity were tested.Through orthogonal design,the optimization of reaction conditions were in 37℃,immunomagnetic bead dosage of20μL,containing 0.1% BSA in PBS blocking 15min,antigen captured 2 h and HRP labeled anti LM monoclonal antibody dilution to1∶10 000(体积比)specificity binding reaction 30min after chemiluminescence detection.The goodness of fit of standard curve is 0.954,the minimum detection limit is104CFU/mL,the specificity is good,and the detection time is3 h-4 h.
chemiluminescence immunoassay;immunomagnetic beads;Listeria monocytogenes
10.3969/j.issn.1005-6521.2017.03.027
2016-07-18
国家重大科学仪器设备开发专项(2013YQ14037106)
范龙兴(1988—),男(汉),硕士研究生,研究方向:流行病与食品安全相关工作。
*通信作者:刘颖(1973—),女,副教授,硕士生导师;高志贤(1963—),男,研究员,博士生导师。

