AMPK、NF-κB、COX-2及PGE2在非小细胞肺癌中的表达*
李韶今,张相民,刘联斌,曾汶,李荣,梁婷,王冬梅,周茂华
(赣南医学院附属肿瘤医院 肿瘤防治研究所,江西 赣州 341000)
临床研究·论著
AMPK、NF-κB、COX-2及PGE2在非小细胞肺癌中的表达*
李韶今,张相民,刘联斌,曾汶,李荣,梁婷,王冬梅,周茂华
(赣南医学院附属肿瘤医院 肿瘤防治研究所,江西 赣州 341000)
D O I:10.3969/j.i s s n.1005-8982.2017.03.010
目的探讨腺苷酸活化蛋白激酶(AM PK)、核因子κB(N F-κB)、环氧合酶2(C O X-2)及前列腺素E2(PG E2)在非小细胞肺癌(N SC LC)中的表达及其关系。方法采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连接法检测N SC LC和正常肺组织标本中可以直接反映AM PK激活状态的乙酰辅酶A羧化酶磷酸化后的产物(P-AC C)、N F-κB、C O X-2的表达,实时荧光定量聚合酶链反应(qR T-PC R)和W es t ern bl ot检测N SC LC标本及血液、正常肺组织标本及血液中AM PK、C O X-2及PG E2受体的表达。结果免疫组织化学法检测发现,P-AC C在N SC LC中低表达,N F-κB和C O X-2在N SC LC中高表达,其阳性率分别为33.9%、75.8%和66.1%,且与正常肺组织中的表达差异有统计学意义;qR T-PC R和W es t ern bl ot检测发现,在N SC LC标本及血液中,AM PK m R N A表达降低,C O X-2和PG E2受体m R N A表达升高。结论在N SC LC中,AM PK低表达,N F-κB、C O X-2及PG E2高表达,其相互作用可能在N SC LC的增殖、凋亡耐受、侵袭及转移过程中占据重要位置,其表达情况为临床治疗N SC LC提供新的思路。
非小细胞肺癌;聚合酶链反应;P-AC C;核因子κB;环氧合酶2
非小细胞肺癌(non-sm al l-cel l l ung cancer,NSCLC)的发病机制是包含基因突变的复杂过程,基因突变导致细胞凋亡受阻、增殖失控、转移侵袭、血管生成等恶性行为[1-3]。表皮细胞向间叶细胞化生是癌变的一个重要过程,其发生是由于人体内解除控制的炎症反应,从而导致细胞免疫的削弱和恶性肿瘤的发生[4-8]。大量失控的炎症反应使机体罹患NSCLC的风险大大增加[9-11]。
炎症相关基因腺苷酸活化蛋白激酶(AM P-act ivat ed prot ei n ki nase,AM PK)、核因子κB(nucl ear f act orκB,NF-κB)、环氧合酶 2(cycl ooxygenase,COX-2)及前列腺素E2(prost agl andi n E2,PGE2)在慢性炎症启动致癌信号通路过程中具有重要作用,且可以相互作用,共同促进肿瘤的增殖、凋亡及转移过程[12]。本研究初步探讨AM PK、NF-κB、COX-2及PGE2在NSCLC发生、发展中的作用,可望为进一步阐明NSCLC发生、发展的分子生物学机制,为相关疾病的临床诊断、治疗、预后提供理论与实验依据,为NSCLC的三级预防提供新的视角。
1 资料与方法
1.1 病例资料
选取2008年1月1日-2010年12月31日在赣南医学院附属肿瘤医院就诊,有完整临床病理资料,病理检查证实为NSCLC的62例患者作为NSCLC组;同时选取20例因其他原因行肺叶切除患者作为正常组。NSCLC组,男性48例,女性14例;年龄21~69岁,平均55.65岁,中位年龄58.00岁;其中鳞癌33例,腺癌16例,腺鳞癌8例,大细胞癌2例,类癌1例,淋巴上皮样癌1例,原位癌1例。选取2015年1月-2015年10月在赣南医学院附属肿瘤医院就诊的肺部疾病患者30例作为实验组,男性25例,女性5例;年龄38~80岁,平均59.43岁,中位年龄60岁;其中21例鳞癌,8例腺癌,1例大细胞癌。对照组11例因其他原因行肺叶切除术的患者。NSCLC组和正常组作为免疫组织化学法标本,取实验组和对照组的新鲜组织及血液标本做实时荧光定量聚合酶链反应(quant i t at i ve real-t i m e pol ym erase chai n react i on,qRT-PCR)和W est ern bl ot检测。
1.2 主要试剂
改良伊格尔培养基、胎牛血清、胰蛋白酶购自美国Gbi co公司,多克隆抗体AM PK、乙酰辅酶A羧化酶磷酸化后的产物(acet yl-coa carboxyl ase product of phosphoryl at i on,P-ACC)抗体、COX-2抗体、前列腺素E2受体(prost agl andi n E recept or 2,EP2)抗体购自美国 Cel l Si gnal i ng Technol ogy公司,NF-κB(美国Sant a Cruz公司),二抗(美国Sant a Cruz公司),Tri zol(美国 Invi t rogen公司),二喹啉甲酸(bi ci nchoni ni c aci d,BCA)蛋白定量试剂盒(美国H ycl one公司),qRT-PCR试剂盒(日本TaKaRa公司),增强化学发光法(enhanced chem i l um i nescence,ECL)试剂盒(瑞典Am ersham公司),qRT-PCR仪器(日本TaKaRa公司)。
1.3 免疫组织化学法检测 P-ACC、NF-κB、COX-2的表达
免疫组织化学法主要参照免疫组织化学链霉菌抗生物素蛋白 -过氧化物酶连接法(st rept avi di n-perosi dase,SP)检测试剂盒说明书进行操作,主要步骤为:标本用10%福尔马林固定、脱水,石蜡包埋,高压抗原修复、内源性过氧化物酶灭活、封闭,一抗孵育、二抗孵育、二氨基联苯氨显色,苏木精复染、脱水、透明,封片、镜检。
1.4 免疫组织化学法结果判定
由2位高年资病理医师双盲评判。在400倍视野下,每例随机选取不重复5个视野,然后按阳性细胞占全部细胞的百分率分为:表达阴性(-),即无阳性细胞或仅有个别细胞;表达弱阳性(+),即阳性细胞数为10%~25%;表达中度阳性(++),即阳性细胞数为25%~50%;表达强阳性(+++),即阳性细胞数≥50%。
1.5qRT-PCR检测P-ACC、NF-κB、COX-2及PGE2受体mRNA的表达
引物根据Prem er pri m er 5.0设计,由上海吉凯基因化学技术有限公司合成。采用Tri zol法提取组织和血液总RNA,根据日本TaKaRa公司M-M LV逆转录试剂盒步骤逆转录合成cDNA,置入-20℃冰箱冷冻保存。Super Peal PreM i x(SYBR Green)作为荧光指示剂进行PCR扩增反应,PCR反应体系共50μl,SYBR Green 25 μl,cDNA模板2 μl,正、反向引物各1μl,ddH2O 20μl。反应条件:95℃预变性15m i n,95℃变性10 s,63℃退火20 s,72℃延伸30 s,共40个循环。以甘油醛-3-磷酸脱氢酶(gl yceral dehyde-3-phosphat e dehydrogenase,GAPDH)作为内参照。采用Li vak(2-△△Ct)法分析基因的相对表达差异,每个样本每个基因进行3个复孔平行实验。△△Ct=实验组(Ct目的基因-CtGAPDH)-对照组(Ct目的基因-CtGAPDH)。见表1。

表1 PCR引物序列
1.6 Western blot检测P-ACC、NF-κB、COX-2及PGE2受体蛋白的表达
用蛋白裂解酶裂解组织或血液中蛋白,用BCA蛋白定量试剂盒测定各组样品蛋白总蛋白浓度。提取总蛋白,定量,按比例加上样缓冲液,混匀,95℃变性10 m i n,十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,电转移至聚偏二氟乙烯膜(pol yvi nyl i dene f l uori de,PVDF)上,5%牛血清白蛋白室温封闭1 h,然后将PVDF膜分别与一抗APM K(1∶1 000)、COX-2(1∶1 000)、PGE2(1∶1 000)孵育,4℃过夜。TBST洗涤3次,每次10 m i n。加入辣根过氧化物酶标记的二抗,室孵育2 h。ECL试剂盒显色,凝胶成像仪显相。实验以β-act i n为内参照,采用Im age J软件分析各组蛋白表达条带的灰度值,该灰度值减去对应背景灰度值后得到该蛋白表达的灰度值,再除以内参GAPDH的灰度值即为该蛋白表达的含量水平。
1.7 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,用独立样本t检验,等级资料用等级表示,计数资料以百分率(%)表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 P-ACC在NSCLC中的表达
免疫组织化学法检测发现,P-ACC在正常肺组织中阳性表达率为80%,且着色较强,均为(++)或(+++),而在NSCLC中阳性表达率为33.9%,经χ2检验,差异有统计学意义(χ2=21.971,P=0.000),NSCLC组织低于正常肺组织。P-ACC是AM PK的下游直接靶蛋白,可以直接反映AM PK的激活状态,因此在NSCLC组织中,AM PK m RNA和蛋白的表达低于正常肺组织,差异有统计学意义(P=0.045),见表2和图1~3。

表2 两组P-ACC蛋白的表达比较
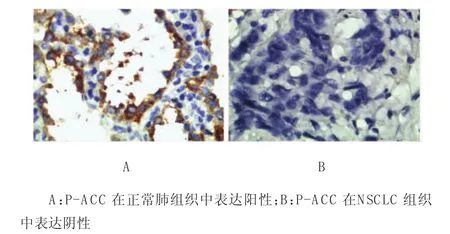
图1 正常肺组织及NSCLC组织中P-ACC蛋白表达(SP×400)

图2 不同样本中AMPK、COX-2、EP2蛋白表达

图3 qRT-RCR检测AMPK mRNA的表达 (±s)
2.2NF-κB在NSCLC中的表达
NF-κB在正常肺组织中阳性表达率为15%,而在NSCLC中阳性表达率为75.8%,经χ2检验,差异有统计学意义(χ2=23.608,P=0.000),NSCLC组织高于正常肺组织。见表3和图4。
2.3COX-2在NSCLC中的表达
COX-2在正常肺组织中阳性表达率为20.0%,而在NSCLC组织中阳性表达率为66.1%,经χ2检验,差异有统计学意义(χ2=12.836,P=0.004),NSCLC组织高于正常肺组织。在NSCLC组织中,COX-2 m RNA和蛋白的表达高于正常肺组织,差异有统计学意义(P=0.007);在NSCLC组与正常组的血清中,COX-2 m RNA和蛋白表达差异有统计学意义(P= 0.032),见表4和图2、5、6。

表3 NF-ΚB蛋白的表达比较

图4 正常肺组织及NSCLC组织中NF-κB蛋白表达(SP×400)

表4 COX-2蛋白的表达比较

图5 正常肺组织及NSCLC组织中COX-2蛋白表达(SP×400)
2.4PGE2在NSCLC中的表达
在NSCLC组织中,PGE2受体m RNA和蛋白的表达高于正常肺组织,差异有统计学意义(P=0.028);在NSCLC组与正常组的血清中,PGE2 m RNA和蛋白表达差异有统计学意义(P=0.004)。见图2、7。

图6 qRT-RCR检测COX-2 mRNA的表达 (±s)
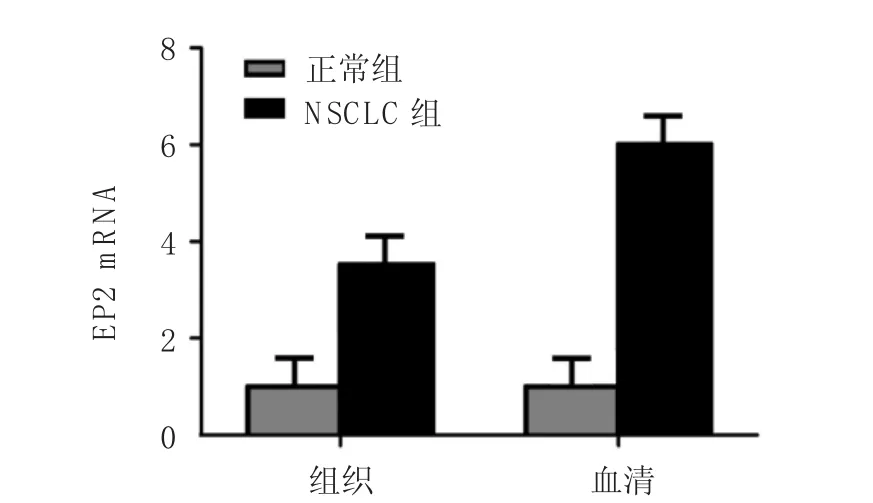
图7 qRT-RCR检测EP2 mRNA的表达 (±s)
3 讨论
P-ACC是腺苷酸活化蛋白激酶被激活后,乙酰辅酶A羧化酶磷酸化失活而形成的,P-ACC是AM PK的下游直接靶蛋白,可以直接反映AM PK的激活状态[13]。AM PK激活后可显著减轻机体炎症介质的表达,减少组织的炎症损伤。STEINBERG等[14]研究发现,AM PK的活性可以被肿瘤坏死因子α上调蛋白磷酸酶2C的表达抑制。另有学者观察到,抗炎细胞因子白细胞介素10和转化生长因子β可提高老鼠和人类的巨噬细胞中AM PK的活性,而脂多糖则降低AM PK的活性[15]。该研究说明,AM PK的活性可以调节炎症反应,AM PK的失活促进炎症的发展。
NF-κB是一种重要的转录因子蛋白,参与多个基因表达的调节。NF-κB是在B细胞免疫球蛋白的κ轻链上被发现,对细胞的生长、黏附、炎症反应和分化具有重要作用,当细胞受到炎症因子、免疫相关因子和肿瘤坏死因子等多种信号刺激时,NF-κB被激活,其与调控DNA上的κB序列相结合后能够启动下游与肿瘤形成及转移相关的基因转录,在肿瘤增殖、侵袭、转移过程中发挥重要作用[16-17]。NF-κB是促炎反应的关键分子,能够调节各种细胞因子及趋化因子的表达及功能,激活上皮细胞生长,促进肿瘤细胞恶性转化。
COX-2在肺癌发生、发展过程中具有重要作用。COX-2能够通过抑制凋亡通路,促进血管生成、肿瘤侵袭转移等途径促进NSCLC的发生、发展。通过在细胞系中对比分析COX-2与凋亡相关基因表达的相关性发现,COX-2能通过降低凋亡相关基因Bcl-2的表达,以及促进其磷酸化,抑制肺癌细胞凋亡,且可促进survi vi n蛋白泛素化,促进肺癌细胞产生凋亡耐受[18]。此外,COX-2与肺癌的侵袭及转移具有相关性,上调肺癌细胞系COX-2的表达后,基质金属蛋白酶7(m at ri x m et al l oprot ei nase,M M P-7)及迁移诱导蛋白7等转移及迁移相关基因表达增高,促进肺癌细胞侵袭及转移[19]。
PGE2为启动肿瘤致癌信号通路的重要基因,在肺癌的发生、发展中具有重要作用。磷脂酰肌醇-3激酶/蛋白激酶B、蛋白激酶、c-Jun氨基末端激酶、细胞外信号调节激酶等信号通路是促进肺癌细胞增殖、凋亡、转移的关键通路,而PGE2能够活化磷脂酰肌醇-3激酶/蛋白激酶B、c-Jun氨基末端激酶、细胞外信号调节激酶信号通路,刺激肺癌细胞生长[20]。肺癌的侵袭及转移是多个基因改变的结果,PGE2能够调节M M P-2和上皮细胞钙黏蛋白的表达,促进肺癌细胞的侵袭及转移[21]。PGE2在NSCLC和炎症细胞上表达增高,可使c-M yc表达上调,促进肿瘤细胞产生凋亡耐受,使肿瘤细胞存活[22]。
炎症相关基因AM PK、NF-κB、COX-2及PGE2在慢性炎症启动致癌信号通路过程中具有重要作用,且可以相互作用,共同促进肿瘤的增殖、凋亡及转移过程[23]。本研究结果显示,P-ACC在NSCLC中低表达,NF-κB和COX-2在NSCLC中高表达,q RT-RCR和W est ern bl ot检测也发现,AM PK m RNA表达降低,COX-2和PGE2 m RNA表达升高。其相互作用可能在NSCLC的增殖、凋亡耐受、侵袭及转移过程中占据重要位置,其表达情况为临床治疗NSCLC提供新的思路。
[1]赵静,赵金银,赵肖,等.ARM S技术联合Taqm an探针检测100例非小细胞肺癌EGFR基因突变[J].中国肺癌杂志,2013,16(1):25-32.
[2]朱洪源,陈成.晚期非小细胞肺癌的药物治疗进展[J].中国现代医学杂志,2011,21(33):4154-4147.
[3]YEH P,CH EN H,ANDREW S J,et al.DNA-m ut at i on Invent ory t o Ref i ne and Enhance Cancer Treat m ent (DIRECT):a cat al ogue of cl i ni cal l y rel evant cancer m ut at i ons t o enabl e genom e-di rect ed cancer t herapy[J].Cl i n Cancer Res,2013,19(7):1894-1901.
[4]JEONG H W,H SU K C,LEE J W,et al.Berberi ne suppresses proi nf l am m at ory responses t hrough AM PK act i vat i on i n m acrophages[J].Am J Physi ol Endocri nol M et ab,2009,296(4):955-964.
[5]KIM Y W,LEE S M,SH IN S M,et al.Ef f i cacy of sauchi none as a novel AM PK-act i vat i ng l i gnan f or prevent i ng i ron-i nduced oxi dat i ve st ress and l i ver i nj ury[J].Free Radi c Bi ol M ed,2009,47(7):1082-1092.
[6]LIAO W L,W ANG W C,CH ANG W C,et al.The RNA-bi ndi ng prot ei n H uR st abi l i zes cyt osol i c phosphol i pase A2α m RNA under i nt erl euki n-1β t reat m ent i n non-sm al l cel l l ung cancer A549 Cel l s[J].J Bi ol Chem,2011,286(41):35499-35508.
[7]GASKIN F S,KAM ADA K,ZUIDEM A M Y,et al.Isof orm-sel ect i ve 5'-AM P-act i vat ed prot ei n ki nase-dependent precondi t i oni ng m echani sm s t o prevent post i schem i c l eukocyt e-endot hel i al cel l adhesi ve i nt eract i ons[J].Am J Physi ol H eart Ci rc Physi ol,2011, 300(4):1352-1360.
[8]ATTFIELD M D,SCH LEIFF P L,LUBIN JH,et al.The di esel exhaust i n m i ners st udy:a cohort m ort al i t y st udy wi t h em phasi s on l ung cancer[J].J Nat l Cancer Inst,2012,104(11):869-883.
[9]TAKEUCH I O,AKIRA S.Pat t ern recogni t i on recept ors and i nf l am m at i on[J].Cel l,2010,140(6):805-820.
[10]RENNARD S I.Chroni c obst ruct i ve pul m onary di sease:l i nki ng out com es and pat hobi ol ogy of di sease m odi f i cat i on[J].Proc Am Thorac Soc,2006,3(3):276-280.
[11]ENGELS E A,W U X,GU J,et al.Syst em at i c eval uat i on of genet i c vari ant s i n t he i nf l am m at i on pat hway and ri sk of l ung cancer[J].Cancer Res,2007,67(13):6520-6527.
[12]CH ANG H H,SONG Z,W ISNER L,et al.Ident i f i cat i on of a novel cl ass of ant i-i nf l am m at ory com pounds wi t h ant i-t um or act i vi t y i n col orect al and l ung cancers[J].Invest New Drugs,2012, 30(5):1865-1877.
[13]LIU L,CASH T P,JONES R G,et al.H ypoxi a-i nduced energy st ress regul at es m RNA t ransl at i on and cel l growt h[J].M ol Cel l, 2006,21(4):521-531.
[14]STEINBERG G R,M ICH ELL B J,van DENDEREN B J,et al. Tum or necrosi s f act or al pha-i nduced skel et al m uscl e i nsul i n resi st ance i nvol ves suppressi on of AM P-ki nase si gnal i ng[J].Cel l M et ab,2006,4(6):465-474.
[15]SAG D,CARLING D,STOUT R D,etal.Adenosi ne 5'-m onophosphat e-act i vat ed prot ei n ki nase prom ot es m acrophage pol ari zat i on t o an ant i-i nf l am m at ory f unct i onal phenot ype[J].J Im m unol,2008, 181(12):8633-8641.
[16]冯水土,陈毅德,陈玉强,等.Gadd45α、NF-κB在胃癌中表达情况及其相关性研究[J].中国现代医学杂志,2016,26(8):33-36.
[17]OLTULU Y M,COSKUNPINAR E,OZKAN G,et al.Invest i gat i on ofNF-κB1 and NF-κBIA gene pol ym orphi sm i n non-sm al l cel l l ung cancer[J].Bi om ed Res Int,2014,2014:DOI:10.1155/ 2014/530381.
[18]H O M Y,H UNG S W,LIANG C M,et al.Recom bi nant vi ral capsi d prot ei n VP1 suppresses l ung cancer m et ast asi s by i nhi bi t i ng COX-2/PGE2 and M IG-7[J].Oncot arget,2014,5(11):3931-3943.
[19]罗爱华,丰大利,付娟,等.Ⅰ、Ⅱ期宫颈癌组织H IF-1α与COX-2蛋白共表达对预后的影响及机制[J].中国现代医学杂志,2016, 26(16):67-71.
[20]M OURADIAN M,KIKAW A K D,JOH NSON E D,et al.Key rol es f or GRB2-associ at ed-bi ndi ng prot ei n 1,phosphat i dyl i nosit ol-3-ki nase,cycl ooxygenase 2,prost agl andi n E2 and t ransf ormi ng growt h f act or al pha i n l i nol ei c aci d-i nduced upregul at i on of l ung and breast cancer cel l growt h[J].Prost agl andi ns Leukot Essent Fat t y Aci ds,2014,90(4):105-115.
[21]DOH ADW ALA M,YANG S C,LUO J,et al.Cycl ooxygenase-2-dependent regul at i on of E-cadheri n:prost agl andi nE(2)i nduces t ranscri pt i onal repressors ZEB1 and snai l i n non-sm al l cel l l ung cancer[J].Cancer Res,2006,66(10):5338-5345.
[22]KRYSAN K,KUSKO R,GROGAN T,et al.PGE2-dri ven expressi on of c-M yc and oncom i R-17-92 cont ri but es t o apopt osi s resi st ance i n NSCLC[J].M ol Cancer Res,2014,12(5):765-774.
[23]CH ANG H H,SONG Z,W ISNER L,et al.Ident i f i cat i on of a novel cl ass of ant i-i nf l am m at ory com pounds wi t h ant i-t um or act i vi t y i n col orect al and l ung cancers[J].Invest New Drugs,2012, 30(5):1865-1877.
(童颖丹 编辑)
Expressions of AMPK,NF-κB,COX-2 and PGE2 in non-small cell lung cancer*
Shao-jin Li,Xiang-min Zhang,Lian-bin Liu,Wen Zeng,Rong Li, Ting Liang,Dong-mei Wang,Mao-hua Zhou
(Institute of Cancer Research,the Affiliated Tumor Hospital of Gannan Medical University, Ganzhou,Jiangxi 341000,China)
ObjectiveTo discuss the expressions and relations of AMP-activated protein kinase(AMPK), nuclear factor-κB(NF-κB),cyclooxygenase 2(COX-2)and prostaglandin E2(PGE2)in non-small cell lung cancer (NSCLC).MethodsThe expressions of phosphorylation product of acetyl coenzyme A carboxylase (PACC,which could directly reflect active AMPK),NF-κB and COX-2 in NSCLC and normal lung tissue specimens were detected by immunohistochemical SP method.The expressions of AMPK,COX-2 and EP2 in NSCLC,normal lung tissues and blood specimens were detected by qRT-PCR and Western blot.The SPSS 22.0 software package was used for statistical analysis.ResultsThe positive expression rate of P-ACC in the NSCLC specimens was 33.9%which was significantly lower than that in the normal lung tissue;while the positive expression rates of NF-ΚB and COX-2 in the NSCLC specimens were 75.8%and 66.1%respectively, which were significantly higher than those in the normal lung tissue.The expression of AMPK mRNA was reduced,while the expressions of COX-2 mRNA and PGE2 mRNA increased in the NSCLC specimens and blood,there were significant differences.ConclusionsLow-expression of AMPK and high-expressions of NF-κB, COX-2 and EP2 in NSCLC may play important roles in NSCLC proliferation,apoptosis tolerance,invasionand metastasis.These different expressions provide a new idea for clinical treatment of NSCLC.
non-small cell lung cancer;AMP-activated protein kinase;phosphorylation product of acetyl coenzyme A carboxylase;nuclear factor κB;cyclooxygenase 2
1005-8982(2017)03-0053-06
R 734.2
A
2016-08-18
国家自然科学基金(No:81441069)

