高负载中空介孔二氧化硅微粒的可控药物释放
梁 樱,马 莹,陈 霞
(东华大学a. 纺织学院; b. 纺织面料技术教育部重点实验室,上海201620)
高负载中空介孔二氧化硅微粒的可控药物释放
梁 樱a, b,马 莹a, b,陈 霞a
(东华大学a. 纺织学院; b. 纺织面料技术教育部重点实验室,上海201620)
高负载性药物可控释放在药物释放系统中起着重要的作用. 合成具有高负载量的中空介孔二氧化硅(HMS),在其表面聚合一层pH敏感的聚多巴胺膜,得到具有高负载、可控释放的纳米微球.试验结果表明:外径为(420±10) nm、内径为(290±5) nm的HMS比介孔二氧化硅(MSN)具有更高的载药率(28.60%)与释放速度;最终得到的pH敏感载药纳米微粒在癌细胞酸性环境(pH=3.0)与血液弱碱性环境(pH=7.4)两种环境下皆在1~10 h内均匀释放,达到可控释放,且在癌细胞环境(pH=3.0)下最终释放量是血液环境(pH=7.4)下最终释放量的2.7倍,具有pH敏感性特点.
二氧化硅; 中空微球; 高负载; 药物释放; 可控释放
在过去的十几年中,各种疾病药物的研究在改善药物分子的物理化学性质以及细胞摄取方向有了重大突破.目前疾病的治疗方法主要依赖于使用常规毒性药物,这种方法有副作用且效果有限. 针对这个问题,目标特异性药物传递系统被设计出来,它的载体具有生物相容性好、负荷量高、零泄漏、释放可控的优点. 刺激响应性能使药物传输过程中药物载体不仅只有传递的作用,而且成为一个积极的参与者,主动调节释放的速度与时间[1-3]. 在药物传递系统中,通过调节或外部的刺激使客体分子高效释放[4].例如:文献[5]对合成的介孔二氧化硅纳米容器修饰了具有对酸、碱两个方向的pH刺激性响应释放药物的性能;文献[6]对合成的磁性纳米粒子通过二硫键将聚乙二醇(PEG)修饰,使其具有对癌细胞靶向释药的特点等. 文献[7]指出多巴胺(DA)可以作为智能聚合物涂层,其后这种由贻贝所分泌的黏附蛋白在材料领域迅速发展. DA在pH值大于7.5的碱性溶液中自聚合,形成聚多巴胺(PDA)的薄膜,且DA可由人体自身分泌,因此,这种膜具有优异的相容性和细胞毒性低的特点,同时对外界环境的pH比较敏感,在不同pH环境下会有不同的破坏程度[7].
目前,常见的药物载体有脂质体、高分子聚合物、金纳米颗粒(Au)、介孔二氧化硅(MSN)、量子点(QD)等. MSN由于具有尺寸离散性小、可调节的介孔结构、较高的比表面积、优良的生物相容性,以及表面功能基团易于被修饰等特性,成为药物传输体系研究的热点[8-13]. 自1994年Science杂志第一次报道中空介孔二氧化硅(HMS)合成以来,由于其具有高渗透、低密度、稳定的热力学、MSN自身的优良性能与特点,主要应用于纳米级传感器、催化反应、药物载体、生物医用等领域,尤其作为载体在药物传输系统中被广泛应用[14-15]. 在过去的20多年中,HMS的合成、表征与修饰方面有了很大的发展,对其形貌有了更深一步的研究,通过在合成过程中对其外壳厚度与孔隙大小的调节,使HMS在不同应用中的结构有所不同[16]. HMS应用于药物传输系统中时,一般通过修饰外层使药物从微孔中控制性地释放,但是一般修饰所用的化学品会对人体产生不良反应,生物相容性不好[6],因此,采用生物相容性优异的材料制得药物载体显得十分必要.
本文采用DA在高负载性的HMS表面聚合形成一层对pH敏感的薄膜,使纳米微球达到可控药物释放.首先合成HMS和MSN纳米微粒,将两种纳米微粒加载罗丹明B荧光染料(RhB)进行加载量与释放的对比,在HMS纳米微粒内部加载RhB后表面包覆PDA作为pH敏感纳米载药体. 通过一个简单的方法制成一个生物相容性高、对pH有刺激性响应的高负载量的控制释放系统.
1 试 验
1.1 试剂与仪器
正硅酸四乙酯(TEOS),十六烷基三甲基溴化铵(CTAB),碳酸钠(Na2CO3),玫瑰红B,磷酸氢二钠,磷酸二氢钾(以上试剂均为分析纯,国药集团,上海);氢氧化钠(NaOH)、盐酸(HCl),分析纯,平湖化工试剂厂,平湖);乙醇(分析纯,鸿盛精细化工有限公司,常熟);氨水(质量分数25%~28%,凌峰化学试剂有限公司,上海);三羟甲基氨基甲烷(Tris),多巴胺盐酸盐(西格玛奥德里奇(上海)贸易有限公司);去离子水用于整个试验.
JEM-2100型透射电子显微镜(TEM),TM-3000型扫描电子显微镜(SEM),ZEN 3600型纳米粒度与电位分析仪,Micromeritics TriStar II 型表面积和孔隙率测量仪,SK1200H型超声波清洗器,FE20型实验室pH计,DF-101S型集热式搅拌器,84-1型磁力搅拌器,DHG-9023A型电热恒温鼓风干燥箱,SG-XL1200型箱式高温炉,YP2001N型电子天平,半微量电子天平.
1.2 HMS的合成
制备实心二氧化硅纳米微粒(sSiO2).首先将74 mL乙醇、10 mL去离子水、3.15 mL氨水混合搅拌均匀;然后加入6 mL TEOS,室温下搅拌1 h,最终形成白色胶状悬浮液,通过离心,用去离子水和乙醇反复冲洗,经过沉淀在60 ℃干燥箱内干燥得到sSiO2白色粉末.
称量10 mL去离子水,加入200 mg的sSiO2白色粉末,超声20 min均匀分散. 量取60 mL去离子水、60 mL乙醇及1.1 mL氨水均匀混合,加入300 mg CTAB后超声10 min使溶液透明,将混合溶液与sSiO2溶液混合. 室温下磁力搅拌20 min后加入0.5 mL TEOS. 室温下搅拌6 h后离心得到白色沉淀后,将沉淀物分散在40 mL去离子水中超声30 min使其均匀分散. 在混合溶液中加入848 mg的Na2CO3,在50 ℃下反应10 h后离心收集. 离心后用去离子水与乙醇分别再次溶解离心清洗. 将得到的沉淀在60 ℃烘箱中过夜干燥,在550 ℃的马弗炉里煅烧6 h后得到白色粉末状HMS.
1.3 MSN的合成
量取480 mL去离子水,将1 g CTAB加入其中,超声使其均匀分散. 在混合溶液中加入3.5 mL浓度为2 mol/L的NaOH溶液,水浴加热至80 ℃后逐滴加入5 mLTEOS保持80 ℃并搅拌2 h,离心得到白色沉淀. 将沉淀分散在去离子水和乙醇中,超声离心清洗,烘箱保持60 ℃内过夜干燥,在550 ℃的马弗炉里煅烧6 h后得到白色粉末状MSN.
1.4 MSN与HMS加载RhB
为了模拟药物加载释放系统,选用RhB作为标记,模拟药物. 称量10 mL质量浓度分别为0.05,0.10和0.15 mg/mL的RhB溶液两组,共计6份,一组3种溶液中分别加入2 mg的MSN粉末,另一组3种溶液中分别加入2 mg的HMS粉末,分别超声2 min使粉末均匀溶于溶液内. 将6份溶液分别标记室温下磁力搅拌记录时间,通过离心分离,提取上清液对比存放.
RhB有很强的紫外可见吸收特征,在553 nm处出现最大吸收峰,因此,可用紫外可见分光光度计在553 nm波长下测定RhB吸收值,对比载药前后溶液中RhB浓度的变化,按照式(1)计算出载药率.
(1)
其中:m1为负载RhB的质量;m2为HMS-RhB的质量.
1.5 HMS的药物加载与PDA包覆
称量50 mL去离子水,在其中加入0.005 mol的Tris,超声使其溶解至透明溶液,逐滴加入0.1 mol/L 的盐酸,用pH计测量pH值为8.5时停止滴加.用去离子水将上述溶液稀释至100 mL,Tris-HCl缓冲液(0.05 mol/L, pH=8.5)配制完成. 称量50 mL的Tris-HCl缓冲液,加入25 mg的RhB,超声使溶液均匀. 称量50 mg的HMS白色粉末加入混合溶液中,黑暗条件下室温搅拌24 h. 在混合溶液中加入25 mg多巴胺盐酸盐,黑暗条件下室温搅拌24 h后离心得到褐色沉淀,将沉淀溶于去离子中超声10 min再次离心,去除多余PDA.
1.6 药物释放
释放过程一般通过溶液释放取液离心或透析直接取液获得.由于直接取液离心过程中会将纳米微粒部分取出从而加大误差,因此本文使用透析的方法进行药物释放(如图1所示),并采用透析标准方法(提取释放液进行标记后会在透析袋外溶液内加入对应pH值的磷酸盐缓冲溶液(PBS)).

图1 透析释放照片Fig.1 Photo of dialysis released
因1.4节已对比HMS与MSN的加载量,此处仅对比二者的释放速度.分别将2 mg的HMS-RhB与MSN-RhB粉末溶于2 mL的去离子水中,超声2 min,分别提取1.5 mL放入透析袋内,封口后将透析袋分别放到90 mL去离子水中. 从溶于去离子水中开始计时,前12 h时,每隔1 h提取透析袋外3 mL溶液存放标记,并在透析袋外溶液内加入3 mL去离子水,24 h提取溶液.
人体内不同部位的pH值有所不同,人体血液中的pH值为7.4左右,癌细胞内环境的pH值小于3,本文设计的PDA包覆的HMS((HMS-RhB)@PDA)纳米微球释放条件主要在这两种环境下. 按PBS标准浓度称量0.02 mol/L磷酸氢二钠,磷酸二氢钾分别配制pH值为3.0与7.4的两种PBS.
称量两份5 mg的(HMS-RhB)@PDA粉末分别溶于2 mL pH值为3.0和7.4的PBS,超声2 min,分别提取0.5 mL放入透析袋内,封口后将透析袋分别放到90 mL pH值为3.0和7.4的PBS中. 从溶于PBS中开始计时,每隔1 h提取透析袋外3 mL溶液存放标记,并在透析袋外溶液内加入对应pH值的PBS. 12 h后每隔24 h提取溶液并补充PBS.
2 结果与讨论
2.1 HMS的表征
HMS纳米微粒的TEM图如图2(a)所示.由图2(a)可知,HMS纳米微粒具有中空结构,且外壳具有垂直孔道的介孔结构. 从图2(a)可得到HMS纳米微粒的直径为(420±10) nm,内腔直径为(290±5) nm,外壳厚度为(65±5) nm. 这证明HMS纳米微粒确实具有大负载量的特点.图2(b)为HMS纳米微粒的动态光散射测得的纳米粒度曲线,电势为-28 mV,得到HMS纳米微粒的直径主要分布在531 nm,与TEM所表现稍有偏差.这是由于TEM测试时干态的纳米微粒要比动态光散射测试在溶液中膨胀的纳米微粒尺寸小. 同时,从图2(b)还可以发现,纳米微粒尺度的离散度较大.

(a) TEM图
sSiO2纳米微粒与HMS纳米微粒的小角X射线衍射图如图3所示.

图3 sSiO2纳米微粒与HMS纳米微粒的小角X射线衍射图 Fig.3 Small angle X-ray diffraction of sSiO2 nanoparticleand HMS nanoparticle
由图3可知,sSiO2纳米微粒是一个实心的球体,并不存在任何介孔结构. HMS纳米微粒在2.40° 有一个对应介孔材料特征的衍射峰,证明了HMS纳米微粒具有介孔结构;在4.24°有一个小衍射峰,没有(110)、(200)的特征峰,这说明HMS的孔道规整性较差,这是由合成过程中刻蚀步骤中的误差导致的,在煅烧过程中部分孔道产生坍塌的现象. 根据布拉格方程计算得HMS的孔径为3.7 nm.
2.2 MSN的表征
MSN的TEM图如图4所示.由图4可知,MSN具有介孔结构,其直径为(92.3±10) nm. 这证明MSN有一定的负载程度,并且可以看到相较于HMS纳米微粒,MSN的直径离散度低且尺寸集中.

图4 MSN透射电子显微镜图Fig.4 TEM image of MSN
2.3 HMS与MSN加载对比
HMS与MSN的粒径差别比较明显,HMS不仅具有空腔的结构,而且粒径相比MSN较大,使得其负载量较高. 本文通过称量相同质量的两种粉末来对比负载量与释放速度.
HMS与MSN分别在质量浓度为0.05, 0.10和0.15 mg/mL的RhB溶液中经不同加载时间离心所得上清液如图5所示. RhB是一种具有明显紫外和荧光的染料,溶液的颜色可以比较RhB浓度的高低,浓度越高颜色越深. 若单独离心不会有沉淀,与石墨烯混合离心后石墨烯离心沉淀,证明RhB自身并不会通过离心或是物理吸附沉淀. 加载RhB后的二氧化硅通过离心得到的上清液中含有未加载的药物,因此,上清液颜色的深浅可以得到未加载入二氧化硅的RhB浓度大小,从而对比二氧化硅对RhB的加载量的区别,上清液颜色越深说明RhB浓度越高,加载入二氧化硅中的RhB含量越低,并且当上清液颜色为无色时说明其中并无RhB,即加载并没有达到饱和.
由图5(a)与5(b)可以看到,HMS与MSN离心上清液明显不同,负载量有明显差异,HMS具有比MSN更高的负载程度,RhB质量浓度为0.05与0.10 mg/mL的条件下上清液中RhB浓度很低,HMS对RhB的加载明显过量,MSN对RhB的加载已达到饱和.对比图5中3张图的1#上清液可看到,随着RhB质量浓度从0.05 mg/mL到0.15 mg/mL,在0.15 mg/mL 条件下HMS对RhB的加载程度达到饱和;3张图中2#、3#上清液进行对比可以看到,由于在质量浓度0.05 mg/mL时MSN已达到负载饱和,因此,在质量浓度继续增加的条件下,上清液颜色与该质量浓度下RhB溶液颜色差别不大.为了使药物加载中达到最大负载量,后文包覆DA时选择RhB过量、质量浓度为0.5 mg/mL的溶液进行加载.
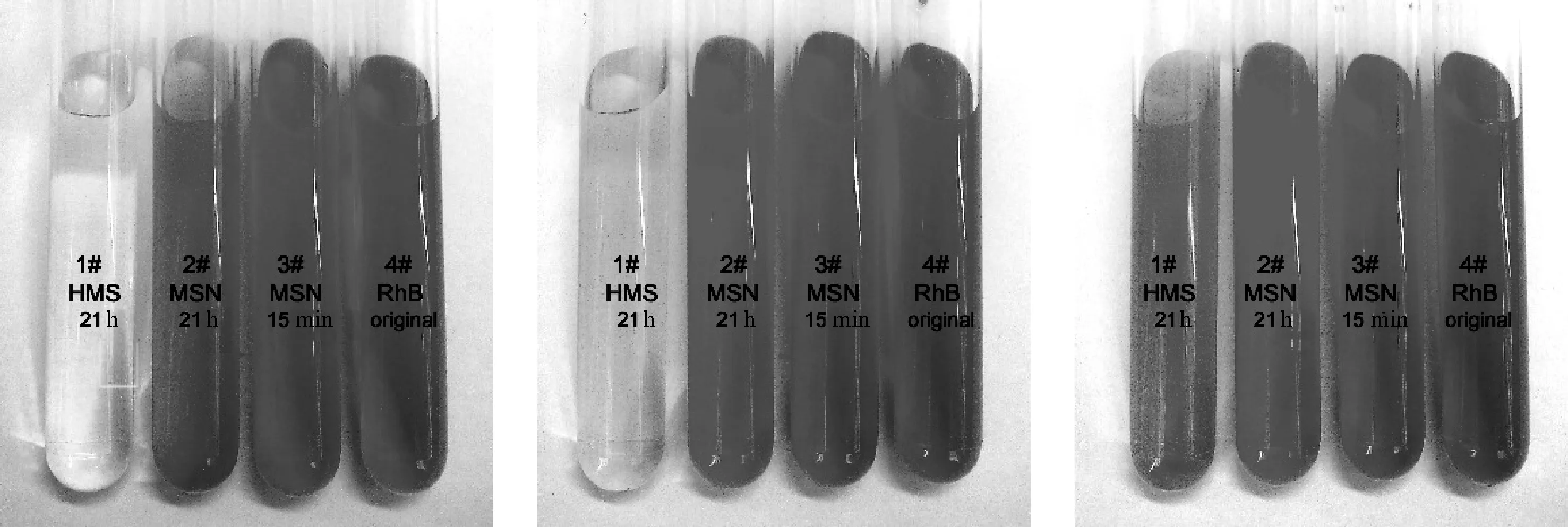
(a) 0.05 mg/mL (b) 0.10 mg/mL (c) 0.15 mg/mL
图5 加载后离心上清液照片
Fig.5 Photos of centrifuge supernatant
由图5可知,载药率与加载溶液浓度有密切关系,在不同质量浓度的RhB溶液中载药率有所不同.以去离子水为背景,分别测定50 mg 的HMS与MSN在50 mL质量浓度为0.5 mg/mL的RhB溶液中,加载RhB前后溶液在紫外可见分光光度计下的光谱曲线,得到HMS和MSN最大释放量分别为13.40 mg和8.24 mg,根据式(1)计算出HMS与MSN对RhB的载药率分别为26.80%与8.24%.
2.4 HMS与MSN释放速度对比

图6 HMS与MSN对RhB的释放动力学曲线Fig.6 Release kinetic curves of RhB of HMS and MSN
HMS与MSN在质量浓度为0.15 mg/mL的RhB溶液中加载后得到的纳米微粒在水中的释放动力学曲线如图6所示. 由图6可知,HMS与MSN释放动力学曲线整体呈上升趋势,释放速度较为均匀,其中MSN速度更为均匀,这是由HMS内部结构复杂导致的. 两条曲线对比而言,HMS对RhB的释放更为迅速,这是由于HMS孔道尺寸较大的缘故.
2.5 (HMS-RhB)@PDA的表征
HMS、HMS-RhB与(HMS-RhB)@PDA的粉末与示意图如图7所示. 其中,HMS纳米微粒为白色,由于RhB的加载使HMS-RhB纳米微粒颜色变深,PDA对微粒的包覆后使(HMS-RhB)@PDA纳米微粒颜色加深.(HMS-RhB)@PDA纳米微粒通过包覆PDA达到药物的可控释放,包覆后通过清洗,去除表面物理吸附的RhB.
(HMS-RhB)@PDA纳米微粒的TEM图如图8所示.由图8可以明显看到,HMS纳米微粒包覆了一层薄膜,这层片状薄膜厚度为(7.15±0.50) nm.薄膜是由多巴胺盐酸盐在pH=8.5的Tris缓冲液溶液中氧化聚合而形成的PDA膜,包覆在HMS纳米微粒表面,使HMS内的RhB粒子不会扩散. 从图8中还可以看到,PDA薄膜厚度明显不匀,这是由于在不同部位DA接触量不同以及氧化程度不同所致. 而在药物释放阶段较薄的部分先行被破坏,从而使HMS内RhB粒子扩散,由 “短板效应”可知,每一个(HMS-RhB)@PDA纳米微粒释放药物的关键是在外层薄膜的最薄处.

(a) HMS (b) HMS-RhB (c)(HMS-RhB)@PDA

图8 (HMS-RhB)@PDA纳米微粒TEM图Fig.8 TEM image of(HMS-RhB)@PDA
2.6 (HMS-RhB)@PDA药物释放
由2.5节可知,因每一个(HMS-RhB)@PDA纳米微粒的不同部位PDA薄膜的厚度不同,其释放药物的关键是在外层薄膜的最薄处. 因此,在pH值较低的环境下,对PDA薄膜的破坏较大,释放的药物较多;pH值在中性温和环境下,对PDA薄膜的破坏小,释放的药物少. 人体血液主要处在弱碱性环境下,有病毒感染部分在酸性条件下,因此,本试验主要选择pH值为3.0和7.4环境下进行药物释放.
图9所示为加载RhB包覆PDA的(HMS-RhB)@PDA纳米微粒在pH值为3.0的环境下第1~10 h的药物释放紫外图,其中,RhB的最大吸收波长为552 nm. 从图9中可以看到,在前10 h内,随着时间的增加,RhB接近恒速释放,所以(HMS-RhB)@PDA纳米微粒在1~10 h内可控制药物释放[17].

图9 (HMS-RhB)@PDA 药物释放紫外图(pH=3.0条件下1~10 h)Fig.9 UVs of(HMS-RhB)@PDA drug release (pH=3.0, 1-10 h)
图10所示为(HMS-RhB)@PDA在pH值为3.0和7.4的环境下1~8 d的药物释放动力学曲线. 由图10可以明显看出:在pH=3.0的环境下更有利于药物的释放,在1 d内释放量达到了54.80%,在4 d以后释放过程平稳地结束,8 d后最终释放量在93.21%,在高负载的基础上释放量也很高; pH=7.4的环境抑制药物的释放,前2 d的释放速率相近,2 d后释放量达到30.53%,基本达到饱和,8 d后最终释放量为34.34%.
两条曲线对比来看,pH=3.0达到释放饱和的时间相对更长,pH=3.0的环境下最大释放量是pH=7.4环境下的2.7倍,很明显可知这种药物释放系统释放主要因素为环境pH值的改变.

图10 (HMS-RhB)@PDA在pH值为3.0与 7.4的释放动力学曲线Fig.10 Release kinetic curves of RhB of (HMS-RhB) @PDA at the pH of 3.0 and 7.4
3 结 语
本文利用多巴胺在高负载性的中空介孔二氧化硅表面聚合形成一层对pH敏感的薄膜,得到的(HMS-RhB)@PDA纳米微粒具有可控药物释放的性能. 制备了外径为(420±10) nm和内径为(290±5) nm的中空介孔二氧化硅,而介孔二氧化硅作为对比,采用同种原理制备. 将两种纳米微粒分别加载不同浓度的罗丹明B(RhB)溶液后提取离心上清液进行对比,其中HMS经21 h加载后的离心上清液中RhB含量明显较低,加载量具有明显优势,同时HMS与MSN在质量浓度为0.5 mg/mL的RhB溶液中的载药率分别为26.80%与8.24%.将两种负载RhB的纳米微粒在水中进行观测释放,从释放动力学曲线对比明显可以看到,HMS纳米微粒具有释放快速的特点. 将最终得到的(HMS-RhB)@PDA纳米微粒分别在酸性(pH=3.0)和弱碱性(pH=7.4)的PBS环境下药物释放试验表明:pH=3.0的环境中1~10 h内释放速度保持稳定,具有控制药物释放的特点;两个释放环境释放动力学曲线相对比可以得到,在酸性条件(pH=3.0)下药物最终释放量(93.21%)是弱碱性条件(pH=7.4)下药物最终释放量(34.34%)的2.7倍.本文这种简单方法在可控药物释放领域具有较大应用前景.
[1] WILLIAMS D F. On the mechanisms of biocompatibility [J]. Biomaterials, 2008, 29(20):2941-2953.
[2] BANGHAM A D,HORNE R W. Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope [J]. J Mol Biol, 1964, 8(5): 660-668.
[3] RIEHEMANN K, SCHNEIDER S W, LUGER T A, et al. Nanomedicine: Challenge and perspectives [J]. Angew Chem Int Ed, 2009, 48(5): 872-897.
[4] LAI C Y,TREWYN B G,JEFTINIJA D M, et al. A mesoporous silica nanosphere-based carrier system with chemically removable cds nanoparticle caps for stimuli-responsive controlled release of neurotransmitters and drug molecules [J]. J Am Chem Soc, 2003, 125(15): 4451-4459.
[5] 杨年旺.pH刺激相应性介孔二氧化硅纳米容器制备及其可控放性能研究[D]. 南京:南京理工大学化工学院,2014.
[6] 崔彦娜.靶向性纳米药物载体的制备及其在肿瘤质料中的应用[D].上海:同济大学材料科学与工程学院,2013.
[7] LIU Y L, AI K L, LIU L H. Polydopamine and its derivative materials:Synthesis and promising applications in energy, environmental, and biomedical fields [J]. Chem Rev, 2014, 114(9): 5057-5115.
[8] LI Z, BARNES J C, BOSOY A. Mesoporous silica nanoparticles in biomedical applications [J]. Chem Soc Rev, 2012, 41(7): 2590-2605.
[9] LEE J E, LEE N, KIM T. Multifunctional mesoporous silica nanocomposite nanoparticles for theranostic applications [J]. Acc Chem Res, 2011, 44(10): 893-902.
[10] YANG P P, GAI S, LIN J. Functionalized mesoporous silica materials for controlled drug delivery [J]. Chem Soc Rev, 2012, 41(9):3679-3698.
[11] TANG F Q, LI L, CHEN D. Mesoporous silica nanoparticles: Synthesis, biocompatibility and drug delivery [J]. Adv Mater, 2012, 24(12): 1504-1534.
[12] XING L, ZHENG H Q, CAO Y Y. Coordination polymer coated mesoporous silica nanoparticles for pH-responsive drug release [J]. Adv Mater, 2012, 24(48): 6433-6437.
[13] CHEN Y, CHEN H R, SHI J L. Inorganic nanoparticle-based drug codelivery nano-systems to overcome the multidrug resistance of cancer cells [J]. Molecular Pharmaceutics, 2014, 11(8): 2495-2510.
[14] FENG X M, MAO C J, YANG G, et al. Polyaniline/Au composite hollow spheres: Synthesis, characterization, and application to the detection of dopamine [J]. Langmuir, 2006, 22(9): 4384-4389.
[15] LI L L, CHU Y, LIU Y, et al. Template-free synthesis and photocatalytic properties of novel Fe2O3hollow spheres [J]. J Phys Chem C, 2007, 111(5): 2123-2127.
[16] SLOWING I, VIVERO-ESCOTO J L ,WU C W, et al. Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers [J]. Adv Drug Del Rev, 2008, 60(11): 1278-1288.
[17] 田燕,于莲. 药剂学[M]. 北京: 清华大学出版社, 2011:321.
(责任编辑: 于冬燕)
Controlled Drug Release of Hollow Mesoporous Silica Particles with High Loading
LIANGYinga, b,MAYinga, b,CHENXiaa
(a. College of Textiles; b. Key Laboratory of Textile Science & Technology, Ministry of Education, Donghua University, Shanghai 201620, China)
A carrier with high loading plays an important role in drug delivery systems. A layer of pH-sensitive polymer-dopamine on hollow mesoporous silica(HMS) was polymerized to get the controlled release nanoparticles((HMS-RhB) @PDA) with high loading. The results show that compared to the mesoporous silica(MSN), HMS with outer diameter of (420±10) nm and inner diameter of (290±5) nm exhibits the excellent loading and higher release rate capabilities.(HMS-RhB) @PDA nanoparticles keep a constant speed at the pH value of 3.0 and 7.4 in the first 1-10 h and the final release in pH=3 is 2.7 times as in pH=7.4.
silica; hollow microspheres; high loading; drug delivery; controlled release
1671-0444(2017)01-0064-07
2015-10-15
国家自然科学基金资助项目(21304016);中央高校基本科研业务费专项资金资助项目(KLTST201304);博士学科点专项科研基金课题资助项目(20130075120004);东华大学“励志计划”资助项目
梁 樱(1991—),女,甘肃金昌人,硕士研究生,研究方向为功能化纺织品. E-mail: 491022372@163.com 马 莹(联系人),女,副教授, E-mail: yingma@dhu.edu.cn
R 94
A

