XRCC1基因Arg194Trp位点多态性与胃癌铂类药物化疗敏感性的关系
钟兰,黄涛,谢贤和,符生苗,高允锁,吴华,钟佩君
(1海南省人民医院,海口570311;2福建医科大学附属第一医院)
XRCC1基因Arg194Trp位点多态性与胃癌铂类药物化疗敏感性的关系
钟兰1,黄涛1,谢贤和2,符生苗1,高允锁1,吴华1,钟佩君1
(1海南省人民医院,海口570311;2福建医科大学附属第一医院)
目的 探讨X射线损伤交叉互补蛋白1(XRCC1)Arg194Trp位点多态性与胃癌铂类药物化疗敏感性的关系。方法 选择接受铂类药物化疗的胃癌患者80例,采用聚合酶链式反应-连接酶检测反应技术检测XRCC1基因Arg194Trp位点基因型。所有患者术后接受以奥沙利铂为主的一线化疗方案,根据化疗效果分为化疗敏感者和化疗耐药者,分析XRCC1基因Arg194Trp位点多态性与化疗敏感性的关系。结果 XRCC1基因Arg194Trp位点存在Arg/Arg、Arg/Trp、Trp/Trp三种基因型,分布频率分别为42.5%(34/80)、50.0%(40/80)、7.5%(6/80);三种基因型分布满足Hardy-Weiberg基因遗传平衡定律,具有群体代表性。Arg/Arg、Arg/Trp、Trp/Trp基因型患者性别、年龄、组织类型、TNM分期、化疗方案等临床病理参数比较差异均无统计学意义(P均>0.05)。80例患者中,化疗敏感(完全缓解+部分缓解)39例(48.8%),耐药(稳定+进展)41例(51.2%);Arg/Trp、Trp/Trp基因型者化疗敏感率均显著高于Arg/Arg者(P均<0.05),Arg/Trp与Trp/Trp基因型患者化疗敏感率比较差异无统计学意义(P>0.05)。结论 XRCC1基因Arg194Trp位点多态性与胃癌患者铂类药物化疗敏感性有关;检测Arg194Trp位点多态性可为胃癌化疗的个体化用药提供依据。
胃癌;X射线损伤交叉互补蛋白1;单核苷酸多态性;铂类耐药
胃癌病情隐匿,大部分患者确诊时已属进展期。化疗是进展期胃癌的主要治疗手段,可使患者生存明显获益[1~3];以氟尿嘧啶和铂类药物为基础的联合化疗是进展期胃癌的一线治疗方案[4,5]。铂类药物进入细胞后主要通过引起DNA损伤而发挥抗肿瘤作用。如果肿瘤细胞DNA修复能力强,则化疗效果较差,反之化疗效果较好[6]。X射线损伤交叉互补蛋白1(XRCC1)是一种与碱基切除修复/单链断裂修复直接有关的蛋白,可参与铂类药物引起的DNA损伤修复过程。研究发现,XRCC1基因Arg194Trp位点多态性可影响其碱基切除修复和单链断裂修复能力,导致铂类药物化疗耐药[7,8]。本研究分析XRCC1基因Arg194Trp位点多态性与胃癌铂类药物化疗敏感性的关系,旨在探讨胃癌铂类药物化疗耐药的遗传机制。
1 资料与方法
1.1 临床资料 选择2013年1月~2015年1月海南省人民医院收治的胃癌患者80例。纳入标准:①经术后组织病理检查证实为胃腺癌;②至少有一个可测量病灶;③术前未接受过任何抗肿瘤治疗,纳入本研究后均行胃癌根治性切除并接受系统规范化治疗;④预计生存期≥3个月;⑤年龄18岁以上,性别不限;⑥接受以奥沙利铂为基础的化疗。排除标准:①骨髓造血功能不全者;②心、肝、肾功能明显异常者;③妊娠、哺乳期妇女;④合并其他重要脏器疾病或急慢性感染未得到控制者;⑤合并胃癌以外的其他恶性肿瘤者;⑥有精神神经症状,治疗依从性差者。其中,男52例、女28例,年龄28~75(53.5±7.9)岁;组织分化程度:高分化23例,中低分化57例;TNM分期[9]:Ⅱ期27例,Ⅲ期53例。
1.2 XRCC1基因Arg194Trp位点多态性检测 采用聚合酶链式反应-连接酶检测反应(PCR-LDR)技术。患者化疗前抽取外周静脉血2 mL,置于乙二胺四乙酸钠抗凝管中,3 000 r/min离心10 min,弃去白细胞层,置于1.5 mL EP管中,-30 ℃低温冰箱保存备用。按Axygen全基因组DNA抽提试剂盒说明提取基因组DNA。引物和探针由上海生工生物工程股份有限公司设计、合成。rs1799782上游引物:5′-CAAGCTTGGCCAGTTCCG-3′,下游引物:5′-ACTACCCTCCTCCCTCAGAC-3′。PCR反应体系共20 μL:上下游引物各1 μL,dNTP 2 μL,Taq酶0.2 μL,基因组DNA溶液1 μL,1×Buffer 2 μL,Mg2+0.6 μL,ddH2O 12.2 μL。反应条件:95 ℃预变性2 min,94 ℃ 30 s,45 ℃ 90 s,65 ℃ 30 s,35个循环,最后65 ℃延伸10 min。多重LDR反应体系共10 μL:1×Buffer 1 μL,探针各1 μL,2 U DNA连接酶0.05 μL,ddH2O 4 μL,PCR产物4 μL。其中,上游探针为G C T G AAGAASAGAGCCCCCGGCCTCTTTTTTTTTTT-TTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTT-TTT,G探针为TTTTTTTTTTTTTTTTTTTTTTTTTTTT-T T T TTTTTTTTTTTTTTTTTTTTGGGGATGTCTTGTTG-ATCC,A探针为TTTTTTTTTTTTTTTTTTTTTTTTTTT-T T T TTTTTTTTTTTTTTTTTTTTTTTGGGGATGTCTTG-TTGATCCA,充分混匀后短暂离心,95 ℃ 2 min,94 ℃ 15 s,50 ℃ 25 s,共40个循环。取出1 μL LDR产物,利用测序仪检测核苷酸序列,确定XRCC1基因Arg194Trp位点基因型。
1.3 化疗方法及化疗敏感性评价 于术后1~3天开始接受以奥沙利铂为主的一线化疗方案。51例行FOLFOX方案化疗:奥沙利铂130 mg/m2静滴2 h,第1天;亚叶酸钙130 mg/m2静滴2 h,第1~5天;5-FU 300 mg/m2静滴4 h,第1~5天。29例患者接受XELOX方案化疗:奥沙利铂130 mg/m2静滴2 h,第1天;卡培他滨1 000 mg/m2口服,2次/d,第1~14天。FOLFOX与XELOX方案均以3周为1个周期。所有患者完成4个化疗周期,参考实体瘤疗效评价标准[10](RECIST 1.0):完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶最大径总和缩小≥30%;稳定(SD):基线病灶最大径总和缩小但未达PR程度,或有增加但未达进展(PD)程度。PD:基线病灶最大径总和增加≥20%或出现新病灶,或存在非目标病灶进展。化疗敏感指初次化疗后获得CR+PR,或初次化疗6个月以上病情未进展;化疗耐药指初次化疗期间获得SD+PD,或6个月内肿瘤复发。
1.4 统计学方法 采用SPSS19.0统计软件。采用Hardy-Weinberg遗传平衡定律检验样本的群体代表性。计数资料比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 XRCC1基因Arg194Trp位点基因型分布 野生型纯合子Arg/Arg被酶切为1个508 bp的片段;突变型杂合子Arg/Trp被酶切为3个片段,分别为319、191、508 bp;突变型纯合子Trp/Trp被酶切为2个片段,分别为319、191 bp。三种基因型分布频率分别为Arg/Arg 34例(42.5%),Arg/Trp 40例(50.0%),Trp/Trp 6例(7.5%),其基因型分布符合Hardy-Weinberg遗传平衡(χ2=1.179,P>0.05)。见图1。
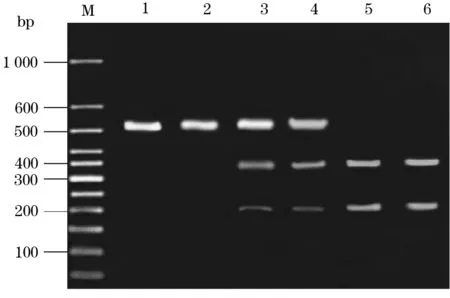
注:M:marker;1、2:野生型纯合子Arg/Arg;3、4:突变型杂合子Arg/Trp;5、6:突变型纯合子Trp/Trp。
图1 XRCC1基因Arg194Trp位点酶切电泳图
2.2 XRCC1基因Arg194Trp位点多态性与胃癌患者临床病理参数的关系 见表1。
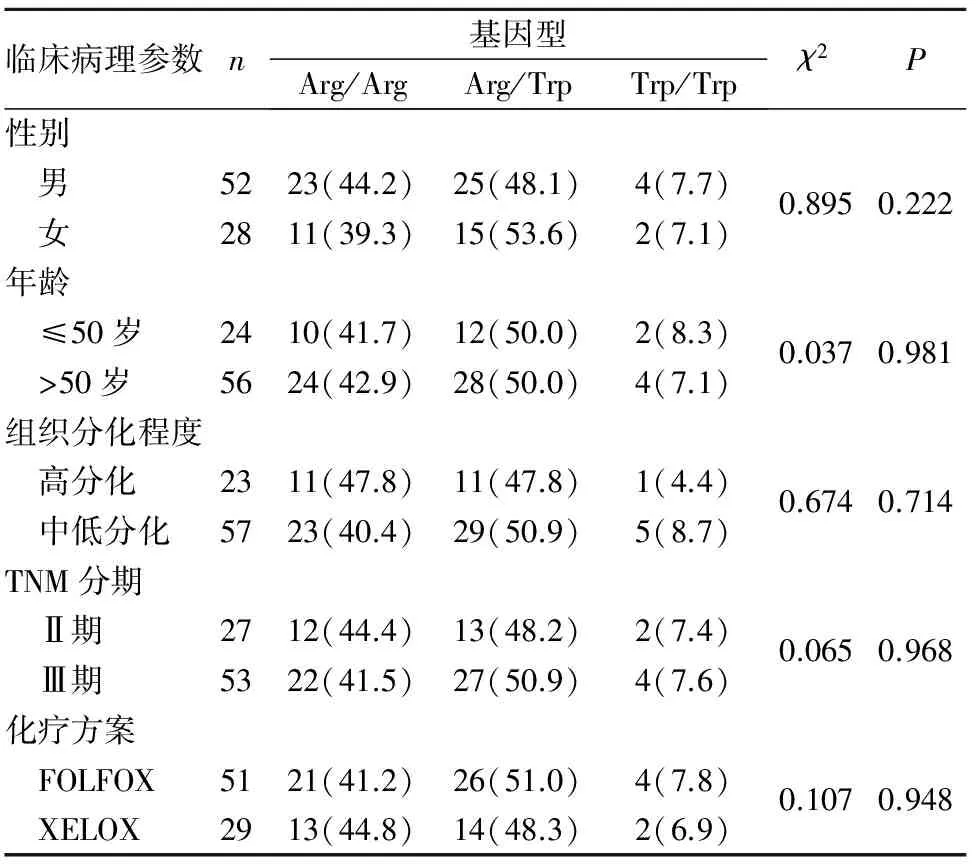
表1 XRCC1基因Arg194Trp位点多态性与胃癌患者临床病理参数的关系[例(%)]
2.3 XRCC1基因Arg194Trp位点多态性与化疗敏感性的关系 所有患者经4个周期化疗,CR 0例,PR 39例,SD 24例,PD 17例,化疗敏感39例,化疗耐药41例。其中,Arg/Arg基因型化疗药物敏感率为17.6%(6/34)、Arg/Trp基因型为70%(28/40),Trp/Trp基因型为83.3%(5/6)。Arg/Trp、Trp/Trp基因型者化疗药物敏感率均高于Arg/Arg基因型者(χ2分别为20.282、11.037,P均<0.05),而Arg/Trp基因型者与Trp/Trp基因型者化疗药物敏感率比较差异无统计学意义(χ2=0.457,P>0.05)。
3 讨论
胃癌是全世界范围内发病率最高的恶性肿瘤之一。近年来,虽然胃癌的诊疗水平有所提高,但患者生存期仍然较短,特别是中晚期胃癌。中晚期胃癌患者多无法进行根治性切除,以铂类为主的化疗在其治疗中具有不可替代的作用,但由于化疗敏感性存在个体差异,故其疗效不一[11]。近年研究发现,DNA损伤修复转变可能是铂类药物化疗耐药的主要原因[12~14]。DNA损伤修复能力差的肿瘤患者手术治疗后存活率不高,但经过辅助化疗后,其疗效明显提升。韩婧等[15]研究发现,DNA损伤修复能力强的肿瘤患者接受单纯手术治疗后,虽然生存期长,但对辅助化疗却易产生耐药性,其死亡风险是DNA损伤修复能力差者的2倍。DNA损伤修复有四种基本形式,即碱基切除修复、核苷酸切除修复、双链断裂修复和酶修复。XRCC1基因属于碱基切除修复基因,其位于人染色体19q13.2-13.3,是由编码633个氨基酸组成的蛋白质,全长约33 kb,包含17个外显子[16]。XRCC1基因参与单链断裂修复和碱基切除修复[17,18]。有研究表明,XRCC1基因可与含铂的DNA双链结合[19]。这些研究均提示,XRCC1基因可能与铂类介导的DNA损伤修复相关[20]。目前,XRCC1基因中共发现3个多态性位点,分别为G27466A、C26304T及G28152A,分别导致相应氨基酸残基的改变[21~23]。单核苷酸多态性是人类遗传常见的多态形式[24,25],由单核苷酸引起的DNA多态性可导致个体对恶性肿瘤易感性、化疗/射线敏感性存在差异,进而影响肿瘤的治疗效果。Pramanik等[26]研究认为,XRCC1基因Arg194Trp位点多态性能够引起所编码的氨基酸发生变化,导致XRCC1蛋白功能破坏,从而使DNA的修复功能减弱,避免铂类药物化疗耐药,提高了药物的敏感性。
本研究显示,胃癌XRCC1基因Arg194Trp位点主要存在三种基因型:野生型纯合子Arg/Arg、突变型杂合子Arg/Trp和突变型纯合子Trp/Trp,其中Arg/Arg占42.5%, Arg/Trp占50.0%,Trp/Trp占7.5%。成莉等[27]研究发现,卵巢癌XRCC1基因Arg194Trp位点有Arg/Trp、Trp/Trp、Arg/Arg三种基因型,其分布频率分别为47.6%、43.9%和8.5%,说明Arg194Trp位点多态性可能是恶性肿瘤某些生物学行为改变的原因。本研究中,Arg/Arg、Arg/Trp、Trp/Trp基因型胃癌患者性别、年龄、组织类型、TNM分期、化疗方案等临床资料比较差异均无统计学意义,说明Arg194Trp位点多态性可能与胃癌的TNM分期、组织分化程度无关。魏嘉等[28]研究认为,携带A突变等位基因是患者预后差、组织学分级较高的独立危险因素。黄朝晖等[29]研究亦证实,XRCC1基因第6个外显子Arg194Trp碱基出现突变会导致DNA修复功能受到损伤,并增加机体对胃癌的易感性。本研究所选择的样本量偏少,可能是导致结果与既往报道不完全一致的主要原因。因此,还需要增加样本量以进一步证实研究结果的可靠性。本研究还发现,Arg/Trp、Trp/Trp基因型者化疗药物敏感率显著高于Arg/Arg基因型者,而Arg/Trp基因型者与Trp/Trp基因型者化疗药物敏感率比较差异无统计学意义,说明XRCC1基因Arg194Trp位点突变型者铂类药物化疗敏感性高于野生型者。
综上所述,XRCC1基因Arg194Trp位点与铂类药物化疗敏感性有关;检测Arg194Trp位点多态性可为胃癌化疗的个体化用药提供依据。
[1] 王超,任彩丽,王宏革,等.XRCC1基因和ERCC2基因多态与胃癌的研究[J].现代预防医学,2014,41(15):2800-2803.
[2] 李江奇,赵永勋,姜雷,等.中国人群X线交错互补修复基因1 Arg399Gln多态性与胃癌易感性关系的Meta分析[J].兰州大学学报(医学版),2015,13(3):64-68.
[3] 孙秀娣,牧人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2004,26(4):4-9.
[4] 刘仕鹏,邹绍静,赵建强,等.XRCC1基因单核苷酸多态性与食管癌易感性的关系[J].实用肿瘤杂志,2013,28(3):253-260.
[5] 曾小云,余红平,仇小强,等.XRCC1基因多态性与肝细胞癌的病例对照研究[J].中华疾病控制杂志,2010,11(8):760-763.
[6] 樊晓妹,李魁秀,牛书怀,等.XRCC1基因多态性与宫颈癌发病风险及临床病理因素的关系[J].中华医学杂志,2013,93(43):3454-3456.
[7] 韩光明,申茂艳,刘艳霞,等.中国人群非小细胞肺癌XRCC1基因多态性与铂类药物敏感性的Meta分析[J].中国药业,2013,22(20):26-31.
[8] 成莉,李琳,邢辉,等.XRCC1基因多态性与卵巢癌对铂类药物化疗敏感性的相关性研究[J].临床肿瘤学杂志,2014,13(4):312-317.
[9] Chae S, Lee A, Lee JH. The effectiveness of the new (7th) UICC N classification in the prognosis evaluation of gastric cancer patients: a comparative study between the 5th/6th and 7th UICC N classification[J]. Gastric Cancer, 2011,14(2):166-171.
[10] Krajewski KM, Nishino M, Ramaiya NH, et al. RECIST 1.1 compared with RECIST 1.0 in patients with advanced renal cell carcinoma receiving vascular endothelial growth factor-targeted therapy[J]. AJR Am J Roentgenol, 2015,204(3):282-288.
[11] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[12] Nagasubramanian R, Innocenti F, Ratain MJ. Pharmacogenetics in cancer treatment[J]. Annu Rev Med, 2003(54):437-452.
[13] Marsh S, Mcleod HL. Cancer pharmacogenetics[J]. Br J Cancer, 2004,90(1):8-11.
[14] Park GY, Wilson JJ, Song Y, et al. Phenanthriplatin, a monofunctional DNA-binding platinum anticancer drug candidate with unusual potency and cellular activity profile[J]. Proc Natl Acad Sci, 2012,109(30):11987-11992.
[15] 韩婧,李江.DNA修复相关基因启动子甲基化和肿瘤化疗耐药的进展[J].上海交通大学学报(医学版),2011,31(1):95-98.
[16] Szaflik JP, Cuchra M, Przybylowska-Sygut K, et al. Association of the 399Arg/Gln XRCC1, the 194 Arg/Trp XRCC1, the 326Ser/Cys OGG1, and the 324Gln/His MUTYH gene polymorphisms with clinical parameters and the risk for development of primary open-angle glaucoma[J]. Mutat Res, 2013,753(1):12-22.
[17] Takahashi H, Kaniwa N, Saito Y, et al. Identification of a candidate single-nucleotide polymorphism related to chemotherapeutic response through a combination of knowledge-based algorithm and hypothesis-free genomic data[J]. J Biosci Bioeng, 2013,116(6):768-773.
[18] Moreno E, Tovar-Palacio C, de los Heros P, et al. A single nucleotide polymorphism alters the activity of the renal Na+: Cl-cotransporter and reveals a role for transmembrane segment 4 in chloride and thiazide affinity[J]. J Biol Chem, 2004,279(16):16553-16560.
[19] Savas S, Kim DY, Ahmad MF, et al. Identifying functional genetic variants in DNA repair pathway using protein conservation analysis[J]. Cancer Epidemiol Biomarkers Prev, 2004,13(5):801-807.
[20] Caldecott KW, Aoufouchi S, Johnson P, et al. XRCC1 polypeptide interacts with DNA polymerase beta and possibly poly (ADP-ribose) polymerase, and DNA ligase Ⅲ is a novel molecular nick-sensor in vitro[J]. Nucleic Acids Res, 1996,24(22):4387-4394.
[21] Zhu GY, Lippard SJ. Photoaffinity labeling reveals nuclear proteins that uniquely recognize cisplatin-DNA interstrand cross-Links[J]. Biochemistry, 2009,48(22):4916-4925.
[22] Bernig T, Chanock SJ. Challenges of SNP genotyping and genetic variation: its future role in diagnosis and treatment of cancer[J]. Expert Rev Mol Diagn, 2006,6(3):319-331.
[23] Abdel-Rahman SZ, El-Zein RA. The 399 Gln polymorphism in the DNA repair gene XRCC1 modulates the genotoxic response induced in human lymphocytes by the tobacco-specific nitrosamine NNK[J]. Cancer Lett, 2000,159(1):63-71.
[24] Matullo G, Palli D, Peluso M, et al. XRCC1, XRCC3, XPD gene polymorphisms, smoking and (32)P-DNA adducts in a sample of healthy subjects[J]. Carcinogenesis, 2001,22(9):1437-1445.
[25] Ruzzo A, Graziano F, Kawakami K, et al. Pharmacogenetic profiling and clinical outcome of patients with advanced gastric cancer treated with palliative chemotherapy[J]. J Clin Oncol, 2006,24(12):1883-1891.
[26] Pramanik S, Devi S, Chowdhary S, et al. DNA repair gene polymorphisms at XRCC1, XRCC3, XPD, and OGG1 loci in Maharashtrian population of central India[J]. Chemosphere, 2011,82(7):941-946.
[27] 成莉,李琳,邢辉,等.XRCC1基因多态性与卵巢癌对铂类药物化疗敏感性的相关性研究[J].临床肿瘤学杂志,2014,19(4):312-317.
[28] 魏嘉,张微,邹征云,等.胃癌铂类化疗预后与XRCC1多态性关系[J].中国公共卫生,2007,23(7):839-840.
[29] 黄朝晖,华东,李莉华,等.XRCC 1 Arg399Gln基因多态性对铂类药物化疗胃癌患者预后的影响[J].肿瘤,2008,28(3):242-245.
Correlation between XRCC1 gene Arg194Trp polymorphism and platinum-based chemotherapy in patients with gastric cancer
ZHONGLan1,HUANGTao,XIEXianhe,FUShengmiao,GAOYunsuo,WUHua,ZHONGPeijun
(1HainanGeneralHospital,Haikou570311,China)
Objective To explore the correlation between X-ray cross complementing repair gene 1 (XRCC1) gene Arg194Trp polymorphism and platinum-based chemotherapy in patients with gastric cancer. Methods Eighty patients with gastric cancer who underwent platinum-based chemotherapy were selected, and the XRCC1 genotypes were detected by multiplex PCR and ligase detection reaction (LDR). All patients were treated with oxaliplatin-based first-line chemotherapy. Accorded to the curative effect standard of gastric cancer treatment, the patients were divided into the platinum sensitive group and platinum resistance group, and the correlation between XRCC1 gene Arg194Trp polymorphism and platinum-based chemotherapy was analyzed. Results There were three kinds of genotypes in XRCC1 gene Arg194Trp: Arg/Arg, Arg/Trp, and Trp/Trp, their distribution frequencies were 42.5% (34/80), 50% (40/80), and 7.5% (6/80), respectively. The proportional distribution of the three genotypes met genetic equilibrium law of Hardy-Weiberg, and the experimental subjects were representative. There were no significant differences in sex, age, histological type, TNM stage, chemotherapy regimen in patients with Arg/Arg, Arg/Trp, and Trp/Trp genetypes (allP>0.05). In 80 patients, platinum drug sensitivity (CR+PR) was found in 39 patients (48.8%), and platinum drug resistance (SD+PD) in 41 patients (51.2%). The sensitivity of platinum drugs in patients with Arg/Trp and Trp/Trp genotypes was significantly higher than that in patients with Arg/Arg genotype (P<0.05), and there was no significant difference between Arg/Trp and Trp/Trp genotypes in patients (P>0.05). Conclusion The XRCC1 gene Arg194Trp is related with the sensitivity of platinum-based drugs in patients with gastric cancer, and the detection of Arg194Trp polymorphism can provide a basis for individual chemotherapy of gastric cancer.
gastric carcinoma; X-ray cross complementing repair gene 1; single nucleotide polymorphism; platinum resistance
海南省医学科研立项课题(琼卫[2012]PT-17)。
钟兰(1966-),女,副主任技师,研究方向为临床医学检验。E-mail: zhonglan3144@163.com
10.3969/j.issn.1002-266X.2017.08.002
R735.2
A
1002-266X(2017)08-0005-04
2016-11-21)

