肺鳞癌组织PD-L1表达变化及其与患者临床病理参数和预后的关系
王玲玲,高颖,沈冰,昌红
(首都医科大学附属北京世纪坛医院,北京100038)
肺鳞癌组织PD-L1表达变化及其与患者临床病理参数和预后的关系
王玲玲,高颖,沈冰,昌红
(首都医科大学附属北京世纪坛医院,北京100038)
目的 探讨程序性死亡配体1(PD-L1)在肺鳞状细胞癌(简称肺鳞癌)发生、发展中的作用。方法 选择肺鳞癌组织90例份、正常肺组织15例份,采用免疫组化法检测PD-L1表达,分析PD-L1表达与患者临床病理参数及预后的关系,应用Cox比例风险回归模型分析影响患者预后的危险因素。结果 肺鳞癌组织PD-L1阳性表达率为66.67%(60/90),正常肺组织均为阴性表达,二者比较P<0.01。肺鳞癌组织PD-L1阳性表达与患者性别、年龄、肿瘤直径、吸烟史无关(P均>0.05),与pTNM分期、淋巴结转移有关(P均<0.05)。PD-L1阳性表达者中位生存时间明显低于阴性表达者(P<0.05)。Cox比例风险回归模型分析显示,PD-L1阳性、淋巴结转移、pTNM分期(Ⅲ期)是影响肺鳞癌预后的独立危险因素(P均<0.05)。结论 肺鳞癌组织PD-L1表达升高,其表达变化可促进肺鳞癌的进展和转移;检测PD-L1表达情况有助于判断患者预后。
肺鳞状细胞癌;程序性死亡配体1;临床病理特征;预后
肺癌是世界范围内最常见的恶性肿瘤之一,已居于癌症相关死亡原因的首位[1],近年来在我国发病率呈明显上升趋势[2]。肺鳞状细胞癌(简称肺鳞癌)是肺癌的常见病理类型,其发病率仅次于肺腺癌[3]。随着肿瘤相关分子靶点的筛选及相关信号通路的研究,针对驱动基因的靶向治疗在肺腺癌中取得了一定效果,但在肺鳞癌中收效甚小。因此,寻找针对肺鳞癌有效治疗的潜在靶基因及判断肺鳞癌预后的分子标志物意义重大。程序性死亡配体1(PD-L1)是一种跨膜糖蛋白,属于B7家族成员之一。有研究发现,PD-L1在多种恶性肿瘤组织中表达升高[4~6]。PD-L1与其受体程序性死亡分子1(PD-1)结合形成PD-1/PD-L通路,该通路可介导形成机体的免疫抑制微环境,参与肿瘤细胞的免疫逃逸[7,8]。但PD-L1在肺鳞癌组织中的表达变化及其与患者预后的关系鲜见报道。2006年1月~2015年1月,我们观察了肺鳞癌组织PD-L1表达变化,现分析结果并探讨其与患者临床病理参数和预后的关系。
1 资料与方法
1.1 临床资料 选择同期我院手术切除的90例肺患者的癌组织标本,均经术后组织病理检查明确为肺鳞癌。患者男79例、女11例,年龄(59±6)岁;肿瘤直径>3 cm 65例,≤3 cm 25例;pTNM分期Ⅰ、Ⅱ期50例,Ⅲ期40例;有淋巴转移53例,无淋巴结转移37例;有吸烟史66例,无吸烟史24例。所有患者接受肺癌根治性手术,术前未行放疗、化疗及生物免疫治疗,术后除Ⅰa期患者外,均接受4个疗程的顺铂+吉西他滨辅助化疗,且无其他癌症病史。同期收集15例因咯血、外伤等肺良性疾病行肺叶切除的正常肺组织标本,患者男12例、女3例,年龄(57±8)岁。其性别、年龄与肺鳞癌患者相匹配。本研究经首都医科大学附属北京世纪坛医院医学伦理委员会批准,患者均知情同意。
1.2 肺组织PD-L1表达检测 采用免疫组化SP法。取手术切除的肺鳞癌组织及正常肺组织,10%中性甲醛固定,常规石蜡包埋,4 μm厚连续切片,切片常规脱蜡、水化,微波修复,封闭组织非特异性抗原;以兔抗人PD-L1多克隆抗体作为一抗,抗体稀释至1∶100,室温孵育60 min,再滴加即用型二抗室温孵育30 min;DAB显色,苏木精复染,中性树胶封片,以PBS代替一抗作阴性对照。显微镜下观察切片,每张切片至少观察5个高倍镜(×400)视野,每个视野至少观察100个细胞。PD-L1阳性染色主要定位于细胞质,呈黄至棕褐色颗粒。采用染色强度和阳性细胞百分比综合判断PD-L1阳性表达。染色强度评分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。阳性细胞百分比评分:无阳性细胞计0分,阳性细胞≤10%计1分,>10%~≤25%计2分,>26%~≤50%计3分,>50%计4分。两项得分相乘结果≥3分为阳性表达。分析PD-L1阳性表达与患者临床病理参数的关系。
1.3 肺鳞癌组织PD-L1表达与患者预后的关系 对肺鳞癌患者术后通过门诊和电话咨询的方式进行随访,随访从患者手术当日算起,截至2016年1月1日。分析PD-L1表达与患者中位生存时间的关系。
1.4 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验或Fisher确切概率检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。多因素生存分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 肺鳞癌组织和正常肺组织PD-L1表达比较 肺鳞癌组织PD-L1阳性表达率为66.67%(60/90),正常肺组织无PD-L1阳性表达,二者比较差异有统计学意义﹙χ2=23.33,P<0.01﹚。
2.2 肺鳞癌组织PD-L1阳性表达与患者临床病理参数的关系 肺鳞癌组织PD-L1阳性表达与pTNM分期、淋巴结转移密切相关,Ⅲ期者PD-L1蛋白表达显著高于Ⅰ、Ⅱ期者,有淋巴结转移者显著高于无淋巴结转移者(P均<0.05)。PD-L1蛋白表达与性别、年龄、吸烟史、肿瘤直径等均无关(P均>0.05)。见表1。
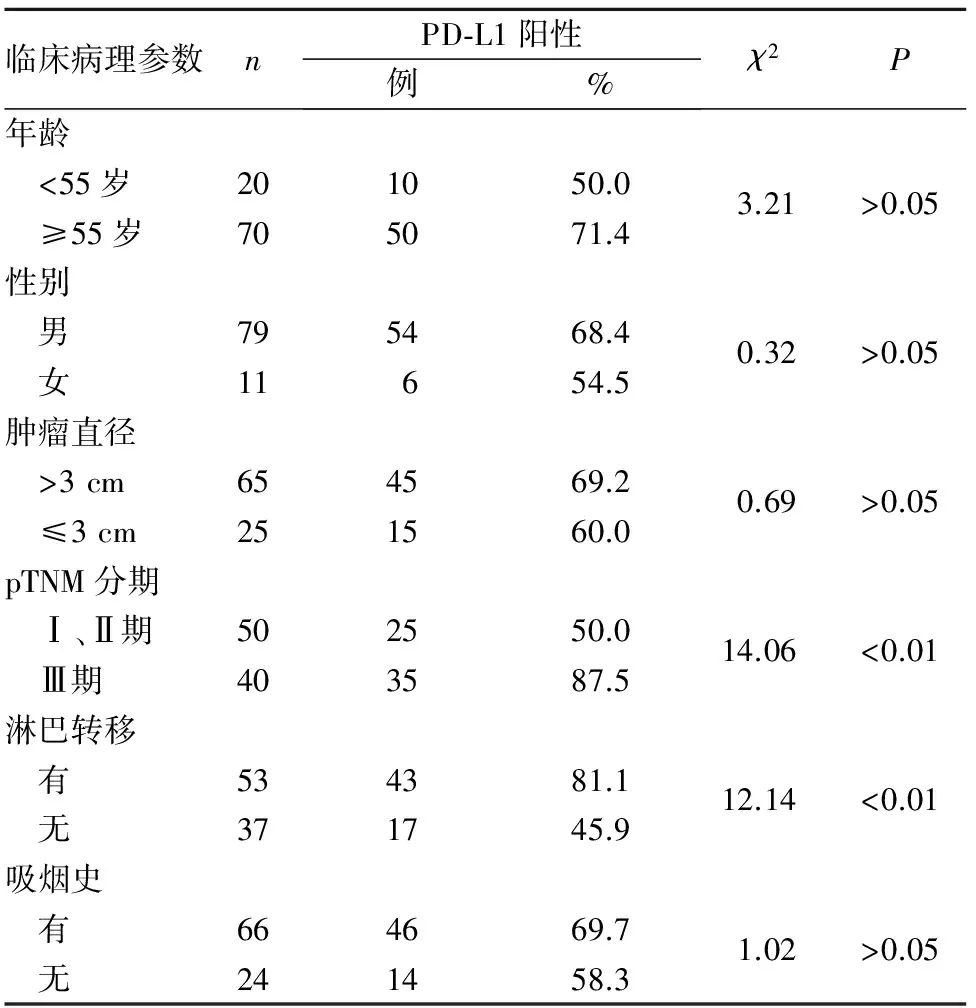
表1 肺鳞癌组织PD-L1阳性表达与患者临床病理参数的关系
2.3 肺鳞癌组织PD-L1表达与患者预后的关系 中位生存时间:PD-L1阳性表达者(60例)与阴性表达者(30例)分别为25、61个月,P<0.05;男性与女性分别为46、38个月,P>0.05;年龄<55岁者与≥55岁者分别为43、37个月,P>0.05;肿瘤直径>3 cm者与≤3 cm者分别为41、48个月,P>0.05;pTNM分期Ⅰ、Ⅱ期者与Ⅲ期者分别为58、36个月,P<0.05;有淋巴结转移者与无淋巴结转移者分别为26、49个月,P<0.05;有吸烟史者与无吸烟史者分别为42、46个月,P>0.05。Kaplan-Meier生存分析显示,pTNM分期、淋巴结转移可能与中位生存时间有关(P均<0.05)。Cox比例风险回归模型显示,PD-L1(HR=9.758,95%CI为2.459~22.717)、淋巴结转移(HR=2.251,95%CI为1.051~7.669)、pTNM分期Ⅲ期(HR=1.556,95%CI为1.060~5.923)是影响肺鳞癌患者预后的独立危险因素(P均<0.05)。
3 讨论
肺癌是当今危害人类健康最常见的恶性肿瘤之一,目前在世界范围内,每年约有180万新发肺癌患者,每年因肺癌造成的相关性死亡患者近160万人,占肿瘤相关性死亡的19.4%,其发病率和死亡率均位于所有恶性肿瘤之首[9]。在肺癌的常见病理类型中,肺鳞癌的发病率仅次于肺腺癌,位于肺癌所有病理类型的第二位,近年来其发病率有明显上升趋势[10,11]。目前,针对肺腺癌的靶向治疗药物已取得了一定进展,如EML4-ALK融合基因的抑制剂[12]、EGFR酪氨酸激酶抑制剂[13]等,但针对肺鳞癌的靶向治疗研究进展缓慢,目前对进展期肺鳞癌主要依靠化疗,患者预后较差,导致肺癌的总体预后依然较差,5年生存率仍不足15%。因此,寻找针对肺鳞癌治疗有效的潜在靶基因及判断肺鳞癌预后的分子标志物意义重大。
PD-1是CD28/细胞毒性T细胞相关抗原4家族成员,由位于第2号染色体的Pdcd1基因编码,包含一个胞外IgV样区、一个疏水跨膜区、一个胞内区。PD-L1是一种Ⅰ型跨膜糖蛋白,属于B7家族成员之一,一级结构包括290个氨基酸,亦由胞外区、疏水跨膜及尾部胞浆区组成。PD-L1蛋白广泛表达于活化T淋巴细胞、巨噬细胞、B细胞等免疫细胞[14],还表达于多种类型的恶性肿瘤细胞表面。有研究发现,PD-L1与其受体PD-1结合后激活PD-1/PD-L通路,可对T细胞功能产生负性调节作用,从而产生对机体的免疫抑制作用[15],在恶性肿瘤的发生、发展中起着一定作用。已有研究报道,PD-L1在乳腺癌、胶质瘤、恶性黑色素瘤等肿瘤组织中表达升高,并参与肿瘤的免疫逃逸,继而促进肿瘤的发展[4~6]。PD-L1表达升高,可通过增强PD-1/PD-L1信号通路,抑制肿瘤特异性T淋巴细胞的增殖及正常功能,使肿瘤细胞得以生存及快速发展。Koh等[16]研究发现,在肺腺癌组织中PD-L1的阳性表达率为59%,且其阳性表达与患者淋巴结转移、组织分化程度及吸烟有关。但其与患者性别、年龄、吸烟史等基本特征关系的研究结果尚不一致[17,18]。本研究发现,肺鳞癌组织PD-L1阳性表达明显高于正常肺组织;PD-L1阳性表达与患者pTNM分期、淋巴转移有关。提示PD-L1在肺鳞癌的发生、进展过程中具有重要作用。
目前,PD-L1对恶性肿瘤患者预后影响的结果尚不一致。有研究发现,PD-L1过表达的胰腺癌、结肠癌、肝癌等侵袭性高,患者预后差[19,20]。Chen等[21]研究发现,PD-L1阳性的非小细胞肺癌患者预后差,生存期短;而Yang等[22]研究则显示,PD-L1阳性的早期肺腺癌患者无进展生存期更长;Velcheti等[23]研究亦发现,PD-L1阳性的非小细胞癌患者生存时间更长。但Konishi等[24]研究则认为,PD-L1与肺癌患者预后无明显相关性。这些研究结果不一致可能与PD-L1的表达易受肿瘤样本质量、肿瘤病理类型及肿瘤异质性等因素影响有关。目前单独研究PD-L1对肺鳞癌患者预后影响的报道甚少。本研究发现,PD-L1阳性、有淋巴结转移、pTNM分期较晚的肺鳞癌患者生存时间较短,是影响肺鳞癌患者预后的独立危险因素。进一步提示PD-L1与肺鳞癌的发生、发展及患者预后相关。
近年来,随着EGFR、ROS1、AKL等基因突变在肺腺癌中的深入研究,针对非小细胞肺癌基因检测的关注达到了前所未有的高度,相应的靶向药物研发也取得了巨大进步,明显改善了患者的预后。近期研究发现,非小细胞肺癌PD-L1的表达与驱动基因有一定相关性,且与靶向药物的疗效有关。Tang等[25]研究发现,在非小细胞肺癌组织中PD-L1的表达与EGFR突变存在明显相关性。Ota等[26]研究发现,PD-L1在EML4-ALK阳性的非小细胞肺癌细胞株中表达较EML4-ALK阴性的非小细胞肺癌细胞株明显升高,并且干扰EML4-ALK的表达可导致PD-L1表达下降。有研究还发现,非小细胞肺癌患者靶向药物的疗效与PD-L1的表达密切相关,在存在EGFR突变且给予EGFR酪氨酸激酶抑制剂治疗的晚期非小细胞肺癌患者中,PD-L1阳性者疾病进展时间及总生存时间均优于PD-L1阴性者[27],提示PD-L1在筛选靶向药物优势人群方面有着潜在的临床价值,并且在靶向药物耐药性日益严重的今天,免疫药物治疗可能会在抗肿瘤治疗中取得突破,抗PD-L1药物可能在未来与靶向药物的联合应用中有着巨大前景。在小鼠模型中,应用抗PD-L1抗体阻断PD-1/PD-L1信号通路,能够增强效应T细胞功能,改善肿瘤免疫微环境,使肿瘤小鼠的生存期明显延长[28,29]。目前抗PD-L1药物如MPDL3280A、BMS-936559等已进入临床试验阶段,但有关抗PD-1/PD-L1药物的治疗主要局限在肺腺癌方面,在肺鳞癌方面的研究尚缺乏,有待于大规模的临床试验。
综述所述,PD-L1的高表达与肺鳞癌的发生、发展及不良预后密切相关,PD-L1阳性表达提示肺鳞癌患者预后较差,PD-L1阳性表达有可能成为判断肺鳞癌预后的重要的分子学标志。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[2] 洪群英,白春学.应重视肺癌的早期诊断技术[J].中华医学杂志,2012,92(8):507-509.
[3] 段玉忠,蒋仁容.1 152例肺癌患者临床病理资料分析[J].山东医药,2008,48(18):84.
[4] Soliman H, Khalil F, Antonia S. PD-L1 expression is increased in a subset of basal type breast cancer cells[J]. PLoS One, 2014,9(2):e88557.
[5] Liu Y, Carlsson R, Ambjorn M, et al. PD-L1 expression by neurons nearby tumors indicates better prognosis in glioblastoma patients[J]. J Neurosci, 2013,33(35):14231-14245.
[6] Spranger S, Spaapen RM, Zha Y, et al. Up-regulation of PD-L1, IDO, and T (regs) in the melanoma tumor microenvironment is driven by CD8(+) T cells[J]. Sci Transl Med, 2013,5(200):200ra116.
[7] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012,12(4):252-264.
[8] 宋红林,孟保福,李艳霞,等.强直性脊柱炎患者外周血淋巴细胞及血清PD-1、HLA-B27水平变化[J].山东医药,2016,56(16):55-57.
[9] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[10] Leidinger P, Backes C, Blatt M, et al. The blood-borne miRNA signature of lung cancer patients is independent of histology but influenced by metastases[J]. Mol Cancer, 2014(13):202.
[11] Cheng H, Shcherba M, Kandavelou K, et al. Emerging drugs for squamous cell lung cancer[J]. Expert Opin Emerg Drugs, 2015,20(1):149-160.
[12] Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med, 2013,368(25):2385-2394.
[13] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EUR-TAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012,13(3):239-246.
[14] Al-Shibli K, Al-Saad S, Donnem T, et al. The prognostic value of intraepithelial and stromal innate immune system cells in non-small cell lung carcinoma [J]. Histopathology, 2009,55(3):301-312.
[15] Haspot F, Fehr T, Gibbons C, et al. Peripheral deletional tolerance of alloreactive CD8 but not CD4 T cells is dependent on the PD-1/PD-L1 pathway[J]. Blood, 2008,112(5):2149-2155.
[16] Koh J, Go H, Keam B, et al. Clinicopathologic analysis of programmed cell death-1 and programmed cell death-ligand 1 and 2 expressions in pulmonary adenocarcinoma: comparison with histology and driver oncogenic alteration status[J]. Mod Pathol, 2015,28(9):1154-1166.
[17] Zhang Y, Wang L, Li Y, et al. Protein expression of programmed death 1 ligand 1 and ligand 2 independently predict poor prognosis in surgically resected lung adenocarcinoma[J]. Onco Targets Ther, 2014,7(1):567-573.
[18] Yang CY, Lin MW, Chang YL, et al. Programmed cell death-ligand 1 expression in surgically resected stage I pulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes[J]. Eur J Cancer, 2014,50(7):1361-1369.
[19] Wang L, Ma Q, Chen X, et al. Clinical significance of B7-H1 and B7-1 expressions in pancreatic carcinoma[J]. World J Surg, 2010,34(5):1059-1065.
[20] Song M, Chen D, Lu B, et al. PTEN loss increases PD-L1 protein expression and affects the correlation between PD-L1 expression and clinical parameters in colorectal cancer[J]. PLoS One, 2013,8(6):e65821.
[21] Chen YB, Mu CY, Huang JA. Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer: a 5-year-follow-up study[J]. Tumori, 2012,98(6):751-755.
[22] Yang CY, Lin MW, Chang YL, et al. Programmed cell death-ligand 1 expression in surgically resected stage I pulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes[J]. Eur J Cancer, 2014,50(7):1361-1369.
[23] Velcheti V, Schalper KA, Carvajal DE, et al. Programmed death ligand-1 expression in non-small cell lung cancer[J]. Lab Invest, 2014,94(1):107-116.
[24] Konishi J, Yamazaki K, Azuma M, et al. B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression[J]. Clin Cancer Res, 2004,10(15):5094-5100.
[25] Tang Y, Fang W, Zhang Y, et al. The association between PD-L1 and EGFR status and the prognostic value of PD-L1 in advanced non-small cell lung cancer patients treated with EGFR-TKIs[J]. Oncotarget, 2015,6(16):14209-14219.
[26] Ota K, Azuma K, Kawahara A, et al. Induction of PD-L1 expression by the EML4-ALK oncoprotein and downstream signaling pathways in non-small cell lung cancer[J]. Clin Cancer Res, 2015,21(17):4014-4021.
[27] D'Incecco A, Andreozzi M, Ludovini V, et al. PD-1 and PD-L1 expression in molecularly selected non-small-cell lung cancer patients[J]. Br J Cancer, 2015,112(1):95-102.
[28] Akbay EA, Koyama S, Carretero J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors[J]. Cancer Discov, 2013,3(12):1355-1363.
[29] Belai EB, de Oliveira CE, Gasparoto TH, et al. PD-1 blockage delays murine squamous cell carcinoma development[J]. Carcinogenesis, 2014,35(2):424-431.
Expression of PD-L1 in pulmonary squamous-cell carcinoma and its correlation with clinicopathological features and prognosis
WANGLingling,GAOYing,SHENBing,CHANGHong
(BeijingShijitanHospitalAffiliatedtoCapitalMedicalUniversity,Beijing100038,China)
Objective To investigate the effect of programmed death ligand-1 (PD-L1) in the occurrence and development of pulmonary squamous-cell carcinoma. Methods PD-L1 protein expression was detected in 90 cases of pulmonary squamous-cell carcinoma and 15 cases of normal lung tissues by immunohistochemistry. The relationship of PD-L1 protein expression with clinicopathological features and prognosis was evaluated, and Kaplan-Meier method was used for the survival analysis. The independent prognostic factors of pulmonary squamous carcinoma were analyzed by Cox regression model. Results The positive expression of PD-L1 was 66.67% (60/90) in the pulmonary squamous-cell carcinoma tissues, and the expression of PD-L1 in the normal lung tissues was negative (P<0.05). The expression of PD-L1 was not related with gender, age, smoking history or tumor diameter (allP>0.05), but was closely correlated with lymph nodes metastasis and pTNM stage (allP<0.05). The median survival time of patients with PD-L1 positive expression was significantly lower than that of patients with negative expression (P<0.05). Multivariate Cox regression analysis showed that PD-L1 positive, lymph node metastasis and pTNM stage were independent prognostic factors for patients with lung squamous-cell carcinoma (allP<0.05). Conclusion The expression of PD-L1 is significantly increased in pulmonary squamous-cell carcinoma, which can promote the progression and metastasis of lung squamous-cell carcinoma and help to determine the prognosis of patients.
pulmonary squamous-cell carcinoma; programmed death ligand-1; clinicopathological features; prognosis
国家自然科学基金资助项目(81101480)。
王玲玲(1983-),女,主治医师,研究方向为肿瘤病理学。E-mail: wanglingling_1983@yeah.net
昌红(1961-),女,主任医师,研究方向为肿瘤病理学。E-mail: changhongblk@163.com
10.3969/j.issn.1002-266X.2017.08.007
R734.2
A
1002-266X(2017)08-0025-04
2016-07-24)

