沉默葡萄糖调节蛋白75对人肝癌细胞HCCLM3增殖和凋亡的影响
康强,邹浩,刘立鑫,王连敏,赵松凌,张小文
(昆明医科大学第二附属医院,昆明650101)
沉默葡萄糖调节蛋白75对人肝癌细胞HCCLM3增殖和凋亡的影响
康强,邹浩,刘立鑫,王连敏,赵松凌,张小文
(昆明医科大学第二附属医院,昆明650101)
目的 探讨沉默葡萄糖调节蛋白75(GRP75)表达对人肝癌细胞HCCLM3增殖和凋亡的影响。方法 体外培养人肝癌细胞HCCLM3,随机分为对照组、siRNA-1组、siRNA-2组,采用脂质体转染法将siRNA导入siRNA-1组(上游序列5′-GAGACGGUUUCCAAAUGAATT-3′,下游序列5′-UUCAUUUGGAAACCGUCUCTT-3′)、siRNA-2组(上游序列5′-GCUCUAAGGCUUCCAACCUTT-3′,下游序列5′-AGGUUGGAAGCCUUAGAGCTT-3′),对照组不予干扰序列。采用Western blotting法检测各组GRP75表达,采用CCK-8法检测各组转染2、24、48、96 h细胞增殖情况,采用流式细胞术检测各组细胞凋亡情况。结果 与对照组比较,siRNA-1组、siRNA-2组GRP75表达明显降低(P均<0.01),以siRNA-2组降低更明显(P<0.05)。与对照组比较,siRNA-1组、siRNA-2组各时点细胞增殖能力均降低(P均<0.01),且以siRNA-2组降低更明显(P<0.01);与对照组比较,siRNA-1组、siRNA-2组细胞凋亡率均明显升高(P均<0.01),且siRNA-2组升高更明显(P<0.01)。结论 沉默GRP75表达可抑制人肝癌细胞HCCLM3增殖活性,并促进其凋亡。
肝癌;葡萄糖调节蛋白75 ;细胞增殖;细胞凋亡
肝细胞癌(HCC)恶性程度高,患者预后差,5年生存率不足9%,即使是接受肝移植患者5年生存率也只有30%左右[1~3]。葡萄糖调节蛋白75(GRP75)属于热休克蛋白70家族成员之一,参与线粒体生成、细胞内运输、细胞增殖及信号传导等生物学过程[4~6]。研究证实,GRP75在正常组织中低表达或不表达,而在多种肿瘤中表达上调[7,8]。与其他肝癌细胞株比较,肝癌HCCLM3细胞株恶性程度更高。前期研究发现,肝癌细胞HCCLM3中GRP75表达明显上调,并与肿瘤的恶性程度密切相关。2015年7~12月,我们通过脂质体转染法沉默人肝癌细胞HCCLM3 GRP75表达,并观察其对人肝癌细胞HCCLM3增殖及凋亡的影响。现分析结果并报告如下。
1 材料与方法
1.1 材料 人肝癌细胞株HCCLM3,复旦大学附属中山医院肝癌研究所馈赠。PBS、TBST、RIPA裂解液、PVDF膜、PMSF及不含EDTA的胰酶消化液购自江苏凯基生物技术股份有限公司。DMEM培养基、BCA蛋白定量试剂盒、驴抗兔二抗、驴抗小鼠二抗、ECL发光液、CCK-8试剂和小鼠抗GAPDH单克隆抗体购自上海翊圣生物科技有限公司。脂质体转染试剂Lipofectamine2000和Opti-MEM Ⅰ Reduced Serum Medium,美国Thermo Fisher Scientific。siRNA干扰序列,由上海吉玛生物技术有限公司合成,考虑到siRNA干扰序列可能存在脱靶效应且序列之间的特性有所差异,为提高实验科学性,故设计、合成两条siRNA干扰序列进行后续实验。siRNA序列:siRNA-1:上游序列5′-GAGACGGUUUCCAAAUGAATT-3′,下游序列5′-UUCAUUUGGAAACCGUCUCTT-3′;siRNA-2:上游序列5′-GCUCUAAGGCUUCCAACCUTT-3′,下游序列5′-AGGUUGGAAGCCUUAGAGCTT-3′。AnnexinV-FITC/PI细胞凋亡双染试剂盒,美国BD公司;兔抗GRP75单克隆抗体,美国Cell Signaling Techonolg;南美FBS,德国PAN公司。5200型ECL成像系统,上海天能科技有限公司; SP-2300A2型多功能酶标仪,上海闪谱生物科技有限公司;FACSCalibur型流式细胞仪,美国BD公司。
1.2 细胞培养及沉默GRP75表达 取人肝癌细胞HCCLM3置于37 ℃、5% CO2细胞培养箱中培养,培养基为含10% FBS和双抗DMEM,待细胞处于对数生长期且细胞融合达80%时,经无菌PBS冲洗、胰酶消化、培养基中和、吹打、悬浮细胞等,制成细胞密度为2.5×104个/mL的细胞悬液。取部分细胞悬液接种于6孔板,每孔2 mL。随机将细胞分为siRNA-1组、siRNA-2组及对照组。待细胞生长至对数生长期且细胞融合达50%时,siRNA-1组、siRNA-2组分别加入siRNA-1、siRNA-2序列沉默GRP75表达,对照组不予干扰序列,其余步骤相同。用Opti-MEM Ⅰ Reduced Serum Medium稀释转染试剂Lipofectamine2000(50∶1),室温放置5 min;用Opti-MEM Ⅰ Reduced Serum Medium稀释siRNA(25∶1),对照组以培养基替代siRNA;将稀释的转染试剂与稀释的RNA混合,形成siRNA转染混合物,室温放置20 min。取400 μL转染混合物加入含1 600 μL无血清的DMEM培养基中,混匀后分别置于siRNA-1组、siRNA-2组及对照组。37 ℃ 5% CO2细胞培养箱中继续培养6 h,用含10% FBS的DMEM培养基行换液处理,48 h后在荧光显微镜下观察细胞转染情况,当细胞融合达80%时收集细胞,进行后续实验。
1.3 siRNA沉默GRP75表达效率检测 采用Western blotting法。取各组转染48 h细胞,RIPA裂解提取总蛋白,BCA法蛋白定量。取蛋白裂解液80 μL,加入20 μL上样缓冲液,100 ℃加热10 min使蛋白变性,-80 ℃保存;蛋白变性后每孔上样30 μg,经5%的浓缩胶和10%的分离胶80 V恒压电泳,350 mA电流条件下90 min转印至PVDF膜,转膜完成后将PVDF膜置于TBST中漂洗1 min,用10%脱脂牛奶封闭1 h,兔抗GRP75单克隆抗体(1∶1 000)和小鼠抗GAPDH单克隆抗体(1∶5 000)4 ℃孵育过夜,次日TBST洗膜3次,分别加入驴抗兔二抗(1∶10 000)和驴抗兔二抗(1∶10 000),室温孵育1 h,TBST洗膜3次,ECL发光液浸润2 min,在5200型ECL成像系统中曝光显影,保存图像,并进行灰度分析。
1.4 沉默GRP75表达对人肝癌细胞HCCLM3增殖能力的影响 采用CCK-8法。取各组转染48 h细胞,接种于96孔板,每孔2×103个,37 ℃、5% CO2细胞培养箱中培养。每组设3个复孔。各组分别于贴壁2、24、48、72、96 h加入10 μL CCK-8试剂,继续培养2 h,用SP-2300A2型多功能酶标仪在480 nm处测定各孔的光密度(OD)值。以OD值为纵坐标,检测时间点为横坐标,绘制细胞增殖曲线。
1.5 沉默GRP75表达对人肝癌细胞HCCLM3凋亡的影响 取各组转染48 h细胞,待细胞融合达80%时,用不含EDTA的胰酶消化、中和、吹打,收集细胞于EP管中,用预冷的PBS洗涤2次,加入100 μL结合缓冲液重悬细胞,加入5 μL Annexin-V至细胞悬液,室温避光10 min,再加入5 μL PI染液至细胞悬液,室温避光10 min。上机检测时再加入400 μL结合缓冲液,在FACSCalibur型流式细胞仪上检测细胞凋亡情况,采用流式分析软件Flow-JO分析。

2 结果
2.1 各组GRP75相对表达量比较 对照组、siRNA-1组、siRNA-2组GRP75相对表达量分别为1.81±0.12、0.33±0.02、0.18±0.02,组间两两比较P均<0.05。siRNA-2组转染细胞荧光强度高于siRNA-1组。各组转染前、转染24 h GRP75表达效率见插页Ⅰ图2。
2.2 沉默GRP75表达对HCCLM3细胞增殖能力的影响 见表1。
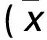
表1 各组不同时间HCCLM3细胞增殖能力比较±s)
注:与对照组同时间点比较,*P<0.01。
2.3 沉默GRP75对HCCLM3细胞凋亡的影响 对照组、siRNA-1组、siRNA-2组细胞凋亡率分别为(7.78±0.80)%、(11.18±0.89)%、(14.68±0.99)%,组间两两比较P均<0.01。
3 讨论
GRP75是热休克蛋白70家族成员之一,属于分子伴侣,其分子量约为74 kDa,又名线粒体热休克蛋白70、肽结合蛋白74,常定位于细胞质[4,9],在正常组织中不表达或低表达,在恶性肿瘤组织中往往呈过表达;GRP75的生物学作用与其结合的蛋白密切相关,在肿瘤的发生发展、化疗药物耐药、恶性表型以及肿瘤免疫中扮演重要角色[8,10~12]。GRP75调节增殖和凋亡的机制目前尚未完全清楚,可能与以下机制有关[4,13,14]:①GRP75和电压依赖阴离子选择通道结合,调节通道性能参与能量代谢、线粒体内部稳态以及调节细胞凋亡;②GRP75与p66Shc(SHC蛋白家族成员之一,位于线粒体)相互作用,可调节线粒体凋亡的信号通路,影响细胞增殖;③GRP75结合p53蛋白,可将p53“扣留”在细胞质中,从而抑制p53蛋白转位至细胞核,抑制p53活化转录,促进凋亡和遗传稳定性;④GRP75与凋亡相关蛋白p21、p27和Bcl-2家族蛋白等相互作用,调节细胞增殖和凋亡。
Starenki等[12]研究发现,甲状腺髓样癌细胞GRP75表达上调,沉默GRP75可影响Bcl-2家族蛋白表达变化,如诱导p53、p21、p27表达增加,并可激活MEK/ERK信号通路,最终抑制细胞增殖,诱导细胞死亡和生长停滞。Hu等[15]研究发现,敲除GRP75能明显抑制卵巢癌细胞A2780的增殖速度,其机制可能与GRP75激活MAPK-ERK信号通路有关。本研究发现,siRNA转染HCCLM3细胞后,能够有效沉默GRP75表达,细胞增殖速度明显降低,且在沉默CRP75表达效率较好的siRNA-2组中效果更加明显。提示沉默GRP75基因能够抑制HCCLM3的增殖能力,与相关研究[12,16]结果基本一致。
细胞异常凋亡和肿瘤恶性程度密切相关,GRP75能够通过多种途径调控细胞凋亡。Wadhwa等[16]研究发现,沉默GRP75能够调控黑色素瘤细胞中凋亡相关蛋白OAG、p53、p21、p14、Bcl-2及Bcl-xl表达,从而抑制肿瘤细胞凋亡,增强细胞的恶性增殖。Wang等[17]研究发现,利用墨角藻黄素下调人膀胱癌细胞T24 GRP75表达后,同样能够诱导细胞凋亡。Nigam等[18]研究证实,贝恩酸能解除乳腺癌细胞MCF7和MDA-MB-231 GRP75和p53复合物的形成,促进p53向核易位后激活其转录功能,可诱导p53相关的凋亡信号通路。本研究发现,沉默GRP75后,HCCLM3细胞凋亡率明显增加,且在沉默GRP75表达效率较好的siRNA-2组中效果更明显。提示沉默GRP75表达可增加HCCLM3细胞凋亡率,与以往研究[16~18]结果基本一致。
综上所述,siRNA沉默HCCLM3 细胞GRP75表达能够抑制细胞增殖活性,促进其凋亡,有可能作为HCC潜在的治疗靶点。
[1] Yu Z, Luo X, Wang C, et al. Baicalin promoted site-2 protease and not site-1 protease in endoplasmic reticulum stress-induced apoptosis of human hepatocellular carcinoma cells[J]. FEBS Open Bio, 2016,6(11):1093-1101.
[2] Grandhi MS, Kim AK, Ronnekleiv-Kelly SM, et al. Hepatocellular carcinoma: from diagnosis to treatment[J]. Surg Oncol, 2016,25(2):74-85.
[3] 林志东,唐丹,朱耿隆,等.肝癌切除术后复发的危险因素分析[J].山东医药,2015,55(34):16-18.
[4] Londono C, Osorio C, Gama V, et al. Mortalin, apoptosis, and neurodegeneration[J]. Biomolecules, 2012,2(1):143-164.
[5] Wadhwa R, Takano S, Kaur K, et al. Identification and characterization of molecular interactions between mortalin/mtHsp70 and HSP60[J]. Biochem J, 2005,391(Pt 2):185-190.
[6] Grover A, Priyandoko D, Gao R, et al. Withanone binds to mortalin and abrogates mortalin-p53 complex: computational and experimental evidence[J]. Int J Biochem Cell Biol, 2012,44(3):496-504.
[7] Ryu J, Kaul Z, Yoon AR, et al. Identification and functional characterization of nuclear mortalin in human carcinogenesis[J]. J Biol Chem, 2014,289(36):24832-24844.
[8] Ando K, Oki E, Zhao Y, et al. Mortalin is a prognostic factor of gastric cancer with normal p53 function[J]. Gastric Cancer, 2014,17(2):255-262.
[9] Wadhwa R, Taira K, Kaul SC. An Hsp70 family chaperone, mortalin/mthsp70/PBP74/Grp75: what, when, and where[J]. Cell Stress Chaperones, 2002,7(3):309-316.
[10] Na Y, Kaul SC, Ryu J, et al. Stress chaperone mortalin contributes to epithelial-mesenchymal transition and cancer metastasis[J]. Cancer Res, 2016,76(9):2754-2765.
[11] Yang L, Li H, Jiang Y, et al. Inhibition of mortalin expression reverses cisplatin resistance and attenuates growth of ovarian cancer cells[J]. Cancer Lett, 2013,336(1):213-221.
[12] Starenki D, Hong SK, Lloyd RV, et al. Mortalin (GRP75/HSPA9) upregulation promotes survival and proliferation of medullary thyroid carcinoma cells[J]. Oncogene, 2015,34(35):4624-4634.
[13] Saxena N, Katiyar SP, Liu Y, et al. Molecular interactions of Bcl-2 and Bcl-xL with mortalin: identification and functional characterization[J]. Biosci Rep, 2013,33(5):e00073.
[14] Amick J, Schlanger SE, Wachnowsky C, et al. Crystal structure of the nucleotide-binding domain of mortalin, the mitochondrial Hsp70 chaperone[J]. Protein Sci, 2014,23(6):833-842.
[15] Hu Y, Yang L, Yang Y, et al. Oncogenic role of mortalin contributes to ovarian tumorigenesis by activating the MAPK-ERK pathway[J]. J Cell Mol Med, 2016,20(11):2111-2121.
[16] Wadhwa R, Priyandoko D, Gao R, et al. Stress chaperone mortalin regulates human melanogenesis[J]. Cell Stress Chaperones, 2016,21(4):631-644.
[17] Wang L, Zeng Y, Liu Y, et al. Fucoxanthin induces growth arrest and apoptosis in human bladder cancer T24 cells by up-regulation of p21 and down-regulation of mortalin[J]. Acta Biochim Biophys Sin (Shanghai), 2014,46(10):877-884.
[18] Nigam N, Grover A, Goyal S, et al. Targeting Mortalin by embelin causes activation of tumor suppressor p53 and deactivation of metastatic signaling in human breast cancer cells[J]. PLoS One, 2015,10(9):e138192.
国家自然科学基金资助项目(81260084)。
张小文(E-mail: zhangxiaowenlu@hotmail.com)
10.3969/j.issn.1002-266X.2017.08.009
R735.7
A
1002-266X(2017)08-0032-03
2016-08-29)

