BMP4对胃癌细胞迁移和侵袭的影响及其作用机制
马松林,张姮,廖宇圣,徐丹,吴杰
(华中科技大学同济医学院附属武汉中心医院,武汉430014)
BMP4对胃癌细胞迁移和侵袭的影响及其作用机制
马松林,张姮,廖宇圣,徐丹,吴杰
(华中科技大学同济医学院附属武汉中心医院,武汉430014)
目的 探讨骨形态发生蛋白4(BMP4)在胃癌细胞迁移和侵袭过程中的作用及其可能机制。方法 传代培养胃癌细胞MGC-803,随机分为BMP4组、anti-BMP4组和对照组。BMP4组、anti-BMP4组分别加入基因重组BMP4、anti-BMP4抗体,对照组加入等量阴性血清。培养48 h,分别取三组细胞,检测细胞迁移能力(细胞划痕实验)、侵袭能力(Transwell小室法),采用qRT-PCR法、Western blotting法检测Snail mRNA和蛋白表达。结果 BMP4组划痕愈合率为(80.6±7.3)%,anti-BMP4组为(43.2±2.6)%,对照组为(39.9±1.7)%;BMP4组侵袭细胞数为(83.2±5.3)个,anti-BMP4组为(49.7±3.1)个,对照组为(46.9±4.6)个;BMP4组划痕愈合率、侵袭细胞数均明显高于anti-BMP4组和对照组(P均<0.05),而anti-BMP4组和对照组比较差异均无统计学意义(P均>0.05)。BMP4组Snail mRNA的相对表达量为4.3±0.20,anti-BMP4组为1.4±0.23,对照组为1.0±0.17;BMP4组Snail蛋白的相对表达量为5.3±0.59,anti-BMP4组为1.9±0.29,对照组为2.1±0.17;BMP4组Snail mRNA和蛋白的相对表达量均明显高于anti-BMP4组、对照组(P均<0.05),而anti-BMP4组和对照组比较差异均无统计学意义(P均>0.05)。结论 BMP4能促进胃癌细胞的迁移及侵袭,其机制可能与上调Snail表达有关。
胃癌;骨形态发生蛋白4;细胞迁移;细胞侵袭
胃癌是临床常见的恶性肿瘤之一,尽管通过手术、放疗及化疗等可在一定程度上提高胃癌的治疗效果,但患者5年生存率仍低于30%,特别是转移性胃癌患者生存时间一般不足2年[1,2]。目前对胃癌转移的机制仍不完全清楚。骨形态发生蛋白4(BMP4)属于转化生长因子β(TGF-β)超家族成员之一,在肿瘤形成过程中具有重要作用[3]。BMP4可抑制胶质瘤干细胞活性[4],还可诱导癌细胞发生上皮间质转化(EMT),进而促进癌细胞恶性表型[5]。但目前关于BMP4在胃癌迁移和侵袭中的作用鲜见报道。2015年1月~2016年1月,我们观察了BMP4对胃癌细胞迁移和侵袭的影响。现分析结果并探讨其可能的作用机制,以期为治疗转移性胃癌提供理论基础和新思路。
1 材料与方法
1.1 材料 胃癌细胞MGC-803,购自华中科技大
学同济医学院实验动物中心。TRIzol试剂,购自美国Invitrogen公司;cDNA Synthesis Kit反转录试剂盒、RR014A qRT-PCR Kits试剂盒,购自日本TaKaRa公司;BMP4及内参GAPDH引物,由华大基因生物科技有限公司合成;BMP4一抗、GAPDH一抗、羊抗鼠二抗,购自美国Abcam公司;基因重组BMP4、anti-BMP4抗体,购自美国Sigma公司;Transwell小室,购自美国Millipore公司。全自动Western blotting实验系统,购自美国Bio-Rad公司。
1.2 细胞培养及细胞处理 取胃癌细胞MGC-803约2×104个,置于含10% FBS的DMEM中,37 ℃ 5% CO2培养箱培养48 h。待细胞生长至对数生长期时,胰酶消化后传代,将传代后细胞置于不同培养皿中,随机分为BMP4组、anti-BMP4组、对照组。BMP4组加入10 ng/mL基因重组BMP4 20 μL,anti-BMP4组加入10 ng/mL anti-BMP4抗体20 μL,对照组加入等量阴性血清,培养48 h。
1.3 相关指标观察
1.3.1 细胞迁移能力 采用细胞划痕实验。取三组细胞接种于6孔板,待细胞完全融合时,用200 μL移液器枪头在细胞表面作“一”字划痕。采用WimScratch在线图像分析系统测定48 h划痕愈合率。划痕愈合率=(划痕即刻面积-划痕48 h面积)/划痕即刻面积×100%。划痕愈合率越高,表示细胞迁移能力越强。实验重复3次,取平均值。
1.3.2 细胞侵袭能力 采用Transwell小室法。取三组细胞各2×104个,接种于Matirge胶包被的Transwell小室,下室为常规培养基,培养48 h,取出Transwell小室,小心擦掉上室表面细胞,甲醇固定,结晶紫染色,显微镜下观察。随机取10个200倍视野,计数侵袭细胞数。实验重复3次,取平均值。
1.3.3 Snail mRNA和蛋白表达 ①Snail mRNA:采用qRT-PCR法。取三组细胞,采用TRIzol法提取细胞总RNA。取各组细胞总RNA 1 μg,按cDNA反转录试剂盒说明书反转录为cDNA。引物序列:Snail上游引物:5′-AGGTTGGAGCGGTCAGC-3′,下游引物:5′-CCTTCTCTAGGCCCTGGCT-3′;GAPDH上游引物:5′-TCATACTCCTGCTTGCTGAT-3′,下游引物:5′-GGGACCTGACTGACTACCTC-3′。反应条件:94 ℃ 10 s,60 ℃ 30 s,68 ℃ 2 min,共40个循环。以内参GAPDH进行标准化,按qRT-PCR Kits试剂盒说明书要求配制反应体系并进行PCR扩增反应。采用2-ΔΔCt法计算Snail mRNA的相对表达量。②Snail蛋白:采用Western blotting法。取三组细胞,RIPA冰上裂解,4 ℃ 12 000 r/min离心30 min,取上清液,BCA法进行蛋白定量。取30 μL蛋白样品经聚丙烯酰胺凝胶电泳分离,并转印至PVDF膜,5%脱脂牛奶封闭2~3 h,一抗(1∶500)4 ℃孵育过夜,0.5% PBST洗膜3次,辣根过氧化物酶标记的二抗(1∶1 000)室温孵育1 h,0.5% PBST洗膜后,ECL发光液化学发光,凝胶成像系统显影。采用用Quantity One 1-D分析软件对蛋白印迹条带进行定量。以目的蛋白测定值与GAPDH测定值的比值作为Snail蛋白的相对表达量。

2 结果
2.1 各组细胞迁移和侵袭能力比较 见表1。
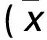
表1 各组细胞迁移和侵袭能力比较±s)
注:与对照组比较,*P<0.05;与anti-BMP4组比较,#P<0.05。
2.2 各组Snail表达比较 见表2。

表2 各组Snail mRNA和蛋白相对表达量比较
注:与对照组比较,*P<0.05;与anti-BMP4组比较,#P<0.05。
3 讨论
胃癌是世界范围内常见的恶性肿瘤[6],全国肿瘤防治研究办公室2012年的数据显示,胃癌年龄标化发病率为22.06/10万,居所有恶性肿瘤的第二位[7]。进食腌制食品、幽门螺杆菌感染等都是导致胃癌发病的重要因素。目前认为,肿瘤的发生、发展是一系列关键信号通路及分子变异的结果,如p53、p21、Ras、TGF-β信号通路、BMP4、EMT等;肿瘤转移是导致患者死亡的重要原因[8]。 研究证实,EMT是肿瘤转移起始所经历的必须步骤,其过程涉及细胞表型的改变,由上皮细胞表型转变为间质细胞表型,涉及到上皮标志物E-cadherin表达下调,间质标志物N-cadherin、Vimentin表达上调[9]。Snail是EMT过程中的关键转录调控因子,能下调E-cadherin表达、上调Vimentin表达,进而诱导EMT的发生,促进肿瘤侵袭、转移和演进[10,11]。
BMP4作为TGF-β超家族成员之一,具有广泛的生物学作用,包括促进骨与软骨的生成、调控多种细胞的增殖与分化,在胚胎发育早期以及骨的形成过程中发挥重要作用[12,13]。近年研究发现,BMP4在肿瘤形成过程中亦具有重要作用[3]。BMP4能够促进癌细胞发生EMT,在多种肿瘤中已有报道。如BMP4促进细胞卵巢癌、胰腺癌、舌鳞癌等细胞的EMT[14~17]。在肝癌中,BMP4还能诱导肝癌细胞分化[18]。BMP4主要通过与相应的细胞受体结合,进而通过TGF-β/Smads信号通路影响EMT,促进肿瘤的迁移和侵袭[19,20]。有研究发现,胃癌组织BMP4高表达,抑制BMP4能增加胃癌细胞对化疗药物顺铂的敏感性[21]。但BMP4对胃癌细胞迁移和侵袭的影响目前鲜见报道。
本研究发现,BMP4组划痕愈合率明显高于anti-BMP4组和对照组,侵袭细胞数明显多于anti-BMP4组和对照组,表明上调BMP4表达能显著增强胃癌细胞的迁移及侵袭能力。BMP4组Snail mRNA和蛋白的相对表达量显著高于anti-BMP4组和对照组,表明上调BMP4表达可增加Snail表达;而Snail是调控EMT的关键分子,其表达增加可显著抑制E-cadherin表达及促进Vimentin表达[10,11,22],促进EMT过程,进而增强胃癌细胞迁移及侵袭能力。这与其在卵巢癌[23]和胰腺癌[24]中的研究结果类似。
综上所述,BMP4能促进胃癌细胞的迁移及侵袭,其机制可能与上调Snail表达有关。阻断BMP4的表达或抑制BMP4的功能有望成为治疗转移性胃癌的重要策略。
[1] 张涛.胃癌手术患者生活质量影响因素分析[J].山东医药,2011,51(2):58-59.
[2] Qiu M, Xu RH. The progress of targeted therapy in advanced gastric cancer[J]. Biomark Res, 2013,1(1):1.
[3] Kallioniemi A. Bone morphogenetic protein 4-a fascinating regulator of cancer cell behavior[J]. Cancer Genet, 2012,205(6):267-277.
[4] Piccirillo SG, Reynolds BA, Zanetti N, et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells[J]. Nature, 2006,444(7120):761-765.
[5] Hamada S, Satoh K, Hirota M, et al. Bone morphogenetic protein 4 induces epithelial-mesenchymal transition through MSX2 induction on pancreatic cancer cell line[J]. J Cell Physiol, 2007,213(3):768-774.
[6] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[7] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[8] De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression[J]. Nat Rev Cancer, 2013,13(2):97-110.
[9] Tsai JH, Yang J. Epithelial-mesenchymal plasticity in carcinoma metastasis[J]. Genes Dev, 2013,27(20):2192-2206.
[10] Katoh M, Katoh M. Identification and characterization of human SNAIL3 (SNAI3) gene in silico[J]. Int J Mol Med, 2003,11(3):383-388.
[11] Kaufhold S, Bonavida B. Central role of Snail1 in the regulation of EMT and resistance in cancer: a target for therapeutic intervention[J]. J Exp Clin Cancer Res, 2014(33):62.
[12] Liem KF Jr, Tremml G, Roelink H, et al. Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm[J]. Cell, 1995,82(6):969-979.
[13] Watanabe Y, Le Douarin NM. A role for BMP-4 in the development of subcutaneous cartilage[J]. Mech Dev, 1996,57(1):69-78.
[14] Thériault BL, Shepherd TG, Mujoomdar ML, et al. BMP4 induces EMT and Rho GTPase activation in human ovarian cancer cells[J]. Carcinogenesis, 2007,28(6):1153-1162.
[15] Gordon KJ, Kirkbride KC, How T, et al. Bone morphogenetic proteins induce pancreatic cancer cell invasiveness through a Smad1-dependent mechanism that involves matrix metalloproteinase-2[J]. Carcinogenesis, 2009,30(2):238-248.
[16] Qiao B, Johnson NW, Chen X, et al. Disclosure of a stem cell phenotype in an oral squamous cell carcinoma cell line induced by BMP-4 via an epithelial-mesenchymal transition[J]. Oncol Rep, 2011,26(2):455-461.
[17] 李霄,孙保存,邵兵,等.BMP4通过诱导EMT促进肝癌迁移侵袭[J].中国肿瘤临床,2015,42(4):207-211.
[18] Zhang L, Sun H, Zhao F, et al. BMP4 administration induces differentiation of CD133+hepatic cancer stem cells, blocking their contributions to hepatocellular carcinoma[J]. Cancer Res, 2012,72(16):4276-4285.
[19] Lee YC, Cheng CJ, Bilen MA, et al. BMP4 promotes prostate tumor growth in bone through osteogenesis[J]. Cancer Res, 2011,71(15):5194-5203.
[20] Bai H, Gao Y, Arzigian M, et al. BMP4 regulates vascular progenitor development in human embryonic stem cells through a Smad-dependent pathway[J]. J Cell Biochem, 2010,109(2):363-374.
[21] Ivanova T, Zouridis H, Wu Y, et al. Integrated epigenomics identifies BMP4 as a modulator of cisplatin sensitivity in gastric cancer[J]. Gut, 2013,62(1):22-33.
[22] Myong NH. Loss of E-cadherin and acquisition of Vimentin in epithelial-mesenchymal transition are noble indicators of uterine cervix cancer progression[J]. Korean J Pathol, 2012,46(4):341-348.
[23] 金鸿雁,丰有吉.反义Snail转录因子抑制卵巢癌转移的实验研究[J].中华妇产科杂志,2005,40(6):400-403.
[24] 殷涛,王春友,刘涛,等.胰腺癌组织中Snail与E-钙黏素蛋白的表达及临床意义[J].中华医学杂志,2006,86(40):2821-2825.
吴杰(E-mail: wujiezxhospital@hotmail.com)
10.3969/j.issn.1002-266X.2017.08.011
R735.2
A
1002-266X(2017)08-0038-03
2016-03-01)

