大肠癌组织PTEN表达变化及意义
严晓丽,苏永志,杜梦楠,刘海丽,郑纪宁
(1承德医学院,河北承德067000;2承德市中心医院)
大肠癌组织PTEN表达变化及意义
严晓丽1,苏永志1,杜梦楠1,刘海丽2,郑纪宁1
(1承德医学院,河北承德067000;2承德市中心医院)
目的 探讨第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)在大肠癌发生、发展中的作用及其对化疗耐药的影响。方法 选择大肠癌患者65例,取手术切除的癌组织及癌旁正常组织,采用免疫组化SP法检测PTEN、P-糖蛋白(P-gp)表达;分析PTEN表达与患者临床病理参数及化疗耐药的关系。结果 大肠癌组织及癌旁正常组织PTEN阳性表达率分别为52.3%(34/65)、76.9%(50/65);P-gp阳性表达率分别为89.2%(58/65)、75.4%(49/65)。大肠癌组织PTEN、P-gp阳性表达率均高于癌旁正常组织(χ2分别为8.613、4.279,P均<0.05)。PTEN阳性表达与大肠癌患者性别、年龄、肿瘤部位、肿瘤形态无关(P均>0.05),与组织分化程度、肿瘤浸润深度、淋巴结转移有关(P均<0.05)。大肠癌组织中PTEN阳性表达和P-gp阳性表达呈负相关(r=-0.332,P<0.05)。结论 大肠癌组织PTEN表达降低,其表达变化与肿瘤发生、发展及化疗耐药有关。
大肠癌;第10号染色体缺失的磷酸酶及张力蛋白同源基因;P-糖蛋白
近年来大肠癌的发病率逐年升高,已跃居所有恶性肿瘤的第2位[1,2]。大肠癌的治疗主要采用手术+辅助性化疗的综合治疗。化疗耐药是导致治疗失败的主要原因之一。P-糖蛋白(P-gp)是一种ATP能量依赖性药物输出泵,可将细胞内药物泵至细胞外,从而降低细胞内药物蓄积,导致化疗效果降低[3,4]。P-gp过表达和化疗耐药密切相关。第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)是一种重要的抑癌基因,在多种肿瘤组织中低表达或表达缺失[5,6],并与肿瘤的发生、发展密切相关。但PTEN是否参与大肠癌多药耐药(MDR)的机制目前尚不清楚。2013年1月~2015年1月,我们观察了大肠癌组织PTEN表达变化,并分析其表达变化与患者临床病理特征和化疗耐药的关系。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择同期承德医学院附属医院和承德市中心医院收治的大肠癌患者65例。所有患者行大肠癌根治术,术后组织病理检查明确诊断,术前均未行放化疗。其中,男37例、女28例,年龄35~86岁、中位年龄58.5岁;结肠癌35例,直肠癌30例;溃疡型37例,隆起型28例;高分化25例,中低分化40例;未浸透浆膜层26例,浸透浆膜层39例;无淋巴结转移35例,有淋巴结转移(N1+N2)30例。本研究经医院伦理委员会批准,患者均知情同意。
1.2 大肠癌组织和癌旁正常组织PTEN、P-gp表达检测 取手术切除的大肠癌组织和癌旁正常组织(距肿瘤边缘>5 cm),10%中性甲醛固定,常规脱水、透明,石蜡包埋,5 μm厚连续切片。切片经二甲苯脱蜡,梯度乙醇脱水,枸橼酸钠缓冲液微波100 ℃ 4 min、80 ℃ 4 min抗原修复,3%过氧化氢室温孵育8 min消除内源性过氧化物酶活性,PBS漂洗3 min×3次,山羊血清37 ℃封闭25 min,滴加一抗(PTEN鼠抗人单克隆抗体,1∶20稀释;P-gp鼠抗人单克隆抗体,1∶50稀释)4 ℃过夜,37 ℃孵育20 min,PBS漂洗3 min×3次,滴加HRP标记的羊抗鼠二抗,37 ℃孵育20 min,PBS漂洗3 min×3次,DAB显色,自来水冲洗,苏木素复染8 min,盐酸乙醇分化3 s,氨水返蓝3 s,逐级脱水、透明后封片保存。以PBS代替一抗作为阴性对照,以已知阳性切片作为阳性对照。结果判定:PTEN阳性表达定位于细胞质和细胞核,呈黄色或棕黄色颗粒;P-gp阳性表达定位于细胞膜,呈黄色或棕黄色颗粒。随机选取10个高倍镜(×400)视野,观察阳性细胞染色强度和阳性细胞所占比例。染色强度:无阳性染色计为0分,浅黄色计为1分,黄色计为2分,棕黄色计为3分。阳性细胞所占比例:采用MiVnt显微图像分析系统进行统计,阳性细胞所占比例≤5%计为1分,>5%~≤20%计为2分,>20%计为3分。以染色强度和阳性细胞所占比例综合计分,二者乘积≥2分为阳性表达。并分析大肠癌组织PTEN阳性表达与患者临床病理参数及P-gp阳性表达的关系。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验、连续校正法或Fisher确切概率法。相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 大肠癌组织和癌旁正常组织PTEN、P-gp阳性表达比较 大肠癌组织及癌旁正常组织PTEN阳性表达率分别为52.3%(34/65)、76.9%(50/65),P-gp阳性表达率分别为89.2%(58/65)、75.4%(49/65)。大肠癌组织PTEN、P-gp阳性表达率均高于癌旁正常组织(χ2分别为8.613、4.279,P均<0.05)。
2.2 大肠癌组织PTEN阳性表达与患者临床病理参数的关系 见表1。
2.3 大肠癌组织PTEN阳性表达与P-gp阳性表达的关系 65例大肠癌患者中,PTEN阳性表达34例,其中P-gp阳性表达27例、阴性表达7例;PTEN阴性表达31例,其中P-gp阳性表达31例,未见P-gp阴性表达。Spearman相关分析显示,大肠癌组织PTEN阳性表达与P-gp阳性表达呈负相关(r=-0.332,P<0.05)。
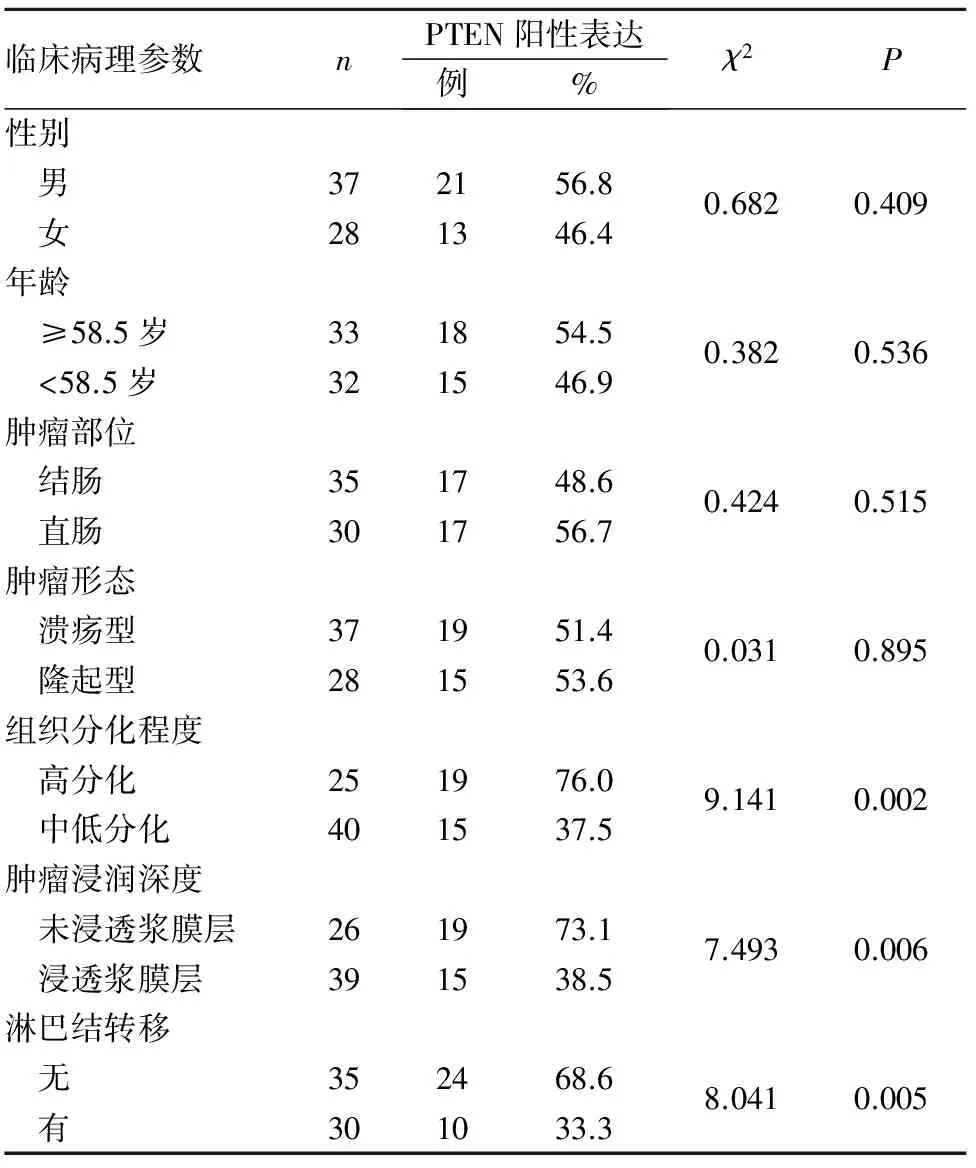
表1 PTEN阳性表达与大肠癌患者临床病理参数的关系
3 讨论
肿瘤细胞MDR是导致化疗失败的主要原因。MDR即肿瘤细胞在接触一种抗肿瘤药物后,产生了对多种结构不同、作用机制各异的其他抗肿瘤药物耐药性。引起MDR的机制非常复杂,包括细胞内药物蓄积减少、排出增多,药物靶点发生突变,细胞修复功能增强和细胞死亡通路发生改变等。但具体机制迄今尚未完全清楚。因此,寻求判断大肠癌化疗耐药的分子标志物、探讨大肠癌化疗MDR机制,对提高大肠癌患者的临床治疗效果意义重大。
MDR主要是由ATP结合盒(ABC)转运蛋白超家族介导的胞内药物浓度降低所致。在正常生理条件下,ABC超家族成员可依赖ATP水解酶水解供能,将细胞内毒素、生物异源物质(如药物)和代谢产物排至细胞外,从而降低有毒物质的积累,达到自我保护的目的。同样,ABC转运蛋白可借助自身能量依赖的跨膜外排泵功能将细胞内的药物泵至细胞外、降低细胞内药物浓度,使化疗药物疗效降低,甚至化疗失败。P-gp是由ABC转运蛋白超家族成员ABCB1(MDR1)编码的蛋白质,是最具特色的转运蛋白成员,也是第一个被发现的人类ABC转运蛋白。P-gp是分子量为170 kDa 的跨膜糖蛋白,依靠水解ATP释放的能量可将细胞内药物泵至细胞外,从而降低细胞内药物蓄积,导致化疗药物效果下降乃至消失。经查阅PharmGKB数据库中药物代谢通路得知,P-gp作为细胞膜上的跨膜糖蛋白,参与多种化疗药物的代谢,如长春新碱、紫杉醇、阿霉素等,其能将胞内药物泵至胞外的作用和肿瘤MDR密切相关。大量临床研究发现,P-gp内源性或外源性的高表达可导致不良的临床预后。因此,理论上任何可降低P-gp表达的物质均可使细胞内药物聚集增加,提高胞内药物浓度,从而有效杀伤肿瘤细胞,改善临床化疗效果;P-gp有可能成为临床上判断化疗效果和患者预后的一个标志物。本研究大肠癌组织P-gp阳性表达率明显高于癌旁正常组织,提示大肠癌组织更能耐受化疗药物引起的细胞损伤和死亡,这为肿瘤转移和复发提供了条件。
PTEN是一个具有脂质磷酸酶和蛋白质磷酸酶双重活性的抑癌基因。PI3K-PIP3-Akt信号通路可影响糖代谢、细胞周期及凋亡等。PTEN可阻断PI3K-PIP3-Akt信号通路,阻止细胞增殖和逃逸凋亡,影响肿瘤的发生和发展。Podsypanina等[7]利用PTEN敲除的小鼠模型证实,PTEN可抑制肿瘤发生、发展。本研究大肠癌组织PTEN阳性表达率明显低于癌旁正常组织,与马颖等[8]研究结果一致,进一步证实PTEN与大肠癌的发生、发展密切相关。近年以PTEN为靶点的肿瘤治疗策略在临床上不断应用。Podsypanina等[7]研究发现,促进野生型PTEN基因及蛋白的表达可增加传统化疗药物对相关肿瘤的化疗效果,逆转肿瘤细胞的MDR。有研究发现,PTEN-Akt通路和多种肿瘤的化疗耐药有关,包括大肠癌[9~11]。Fang等[12]研究发现,化疗可降低肿瘤组织PTEN表达,导致化疗耐药的产生。Sood等[13]研究发现,无论是在原发癌还是转移癌中,PTEN阳性表达者整体生存率明显高于PTEN缺失者。以上研究均说明,PTEN除了参与肿瘤的发生、发展外,还与肿瘤患者的整体预后和化疗耐药有关。通过UniHI数据库检索PTEN和P-gp相互作用的网络图可知,PTEN和P-gp确实存在着密切关系。因此,可考虑将采用外源性P-gp抑制剂转向采用内源性的某种调控基因,进而调控P-gp表达,而PTEN可能是一个候选靶点。但PTEN与P-gp相互作用的具体机制尚未完全清楚。本研究大肠癌组织PTEN阳性表达与P-gp阳性表达呈负相关,与Qi等[14]研究结果基本一致。因此推测,PTEN参与肿瘤化疗耐药的机制除了PTEN-Akt通路外,还与P-gp的表达有关。
综上所述,大肠癌组织PTEN表达降低,其表达变化与肿瘤发生、发展及化疗耐药有关。随着对PTEN与肿瘤化疗耐药关系的进一步研究,PTEN联合P-gp检测将有可能作为判断大肠癌病理生物学特征和预测临床化疗效果的新指标,PTEN也将会成为克服化疗耐药的一个新靶点。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] 赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:10.
[3] Johnson WW. P-glycoprotein-mediated efflux as a major factor in the variance of absorption and distribution of drugs: modulation of chemotherapy resistance[J]. Methods Find Exp Clin Pharmacol, 2002,24(8):501-514.
[4] Sui H, Fan ZZ, Li Q. Signal transduction pathways and transcriptional mechanisms of ABCB1/Pgp-mediated multiple drug resistance in human cancer cells[J]. J Int Med Res, 2012,40(2):426-435.
[5] Steck PA, Pershouse MA, Jasser SA, et al. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers[J]. Nat Genet, 1997,15(40):356-362.
[6] Wang SI, Parsons R, lttmann M. Homozygous deletion of PTEN tumor suppressor gene in a subset of prostate adenocarcinomas[J]. Clin Cancer Res, 1998,4(6):811-815.
[7] Podsypanina K, Ellenson LH, Nemes A, et al. Mutation of Pten/Mmac1 in mice causes neoplasia in multiple organ systems[J]. Proc Natl Acad Sci U S A, 1999,96(4):1563-1568.
[8] 马颖,杨向红,林连捷,等.PTEN和Caspase-3在大肠癌中的表达及临床意义[J].中国医科大学学报,2010,39(4):290-292.
[9] Frattini M, Saletti P, Romagnani E, et al. PTEN loss of expression predicts cetuximab efficacy in metastatic colorectal cancer patients[J]. Br J Cancer, 2007,97(8):1139-1145.
[10] Berns K, Horlings HM, Hennessy BT, et al. A functional genetic approach identifies the PI3K pathway as a major determinant of trastuzumab resistance in breast cancer[J]. Cancer Cell, 2007,12(4):395-402.
[11] Wang ZH, Gao QY, Fang JY. Loss of PTEN expression as a predictor of resistance to anti-EGFR monoclonal therapy in metastatic colorectal cancer: evidence from retrospective studies[J]. Cancer Chemother Pharmacol, 2012,69(6):1647-1655.
[12] Fang L, Li H, Wang L, et al. MicroRNA-17-5p promotes chemotherapeutic drug resistance and tumour metastasis of colorectal cancer by repressing PTEN expression[J]. Oncotarget, 2014,5(10):2974-2987.
[13] Sood A, McClain D, Maitra R, et al. PTEN gene expression and mutations in the PIK3CA gene as predictors of clinical benefit to anti-epidermal growth factor receptor antibody therapy in patients with KRAS wild-type metastatic colorectal cancer[J]. Clin Colorectal Cancer, 2012,11(2):143-150.
[14] Qi C, Gao S, Li H, et al. The effect and mechanism of vinorelbine on cisplatin resistance of human lung cancer cell line A549/DDP[J]. Zhongguo Fei Ai Za Zhi, 2014,17(2):148-154.
河北省高校省级重点学科建设项目(031412);河北省高等学校科学研究计划(ZD2014013);2016年河北省研究生创新资助项目(275)。
郑纪宁(E-mail: zhengjining196711@126.com)
10.3969/j.issn.1002-266X.2017.08.019
R735.3
B
1002-266X(2017)08-0061-03
2016-07-26)

