肝细胞癌患者血清miRNA-200c表达变化及其临床意义
李涛,牛丽娟,李曼,刘文宣,杨磊,马丽霞
(1河北医科大学公共卫生学院,石家庄 050017;2石家庄市第三医院)
肝细胞癌患者血清miRNA-200c表达变化及其临床意义
李涛1,牛丽娟2,李曼1,刘文宣1,杨磊1,马丽霞2
(1河北医科大学公共卫生学院,石家庄 050017;2石家庄市第三医院)
目的 探讨肝细胞癌(HCC)患者血清miRNA-200c表达变化及其临床意义。方法 选择HCC患者60例(HCC组)、体检健康者60例(对照组),采用实时荧光定量PCR技术检测两组血清miRNA-200c表达,并分析其表达与患者临床病理参数的关系。以血清miRNA-200c表达的均数为界值,分为miRNA-200c高表达和miRNA-200c低表达者,比较二者生存时间。结果 HCC组及对照组血清miRNA-200c相对表达量分别为0.51±0.11、0.78±0.13,两组比较P<0.01。HCC患者miRNA-200c低表达与肿瘤直径、TNM分期有关(P均<0.01)。miRNA-200c高表达者生存时间明显长于miRNA-200c低表达者(χ2=8.551,P<0.01)。结论 HCC患者血清miRNA-200c低表达,其表达变化可促进HCC的发生、发展,并与患者预后有关。
肝细胞癌;微小RNA-200c;生存时间;实时荧光定量PCR技术
肝细胞癌(HCC)是我国最常见的恶性肿瘤之一,每年死亡人数约12万,占全世界HCC死亡人数的40%左右[1],其发病机制目前尚未完全清楚。微小RNA(miRNA)是一类非编码蛋白的单链RNA,通过与靶mRNA结合,引起转录后的基因沉默。有研究表明,miRNA与多种肿瘤的发生、发展及转归密切相关[2]。miRNA-200c是miRNA-200家族的重要成员,在多种肿瘤组织中异常表达,是近年临床研究的热点[3]。2010年1月~2015年12月,我们观察了HCC患者血清miRNA-200c表达变化,并分析其表达变化与患者临床病理参数及预后的关系。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择同期石家庄市第三医院收治的HCC患者60例(HCC组),均为首次确诊,尚未接受任何抗肿瘤治疗,并排除既往有肿瘤史者。其中,男42例、女18例,年龄(58.6±10.2)岁;肿瘤直径≤5 cm者31例,>5 cm者29例;TNM分期:Ⅰ、Ⅱ期20例,Ⅲ、Ⅳ期40例;有淋巴结转移者33例,无淋巴结转移者27例;血清AFP≤200 ng/mL者19例,>200 ng/mL者41例;有HBV感染者44例,无HBV感染者16例;有肝硬化史者46例。同期选择在该院体检的健康志愿者60例(对照组),男40例、女20例,年龄(57.3±9.4)岁。两组性别、年龄具有可比性。本研究经石家庄市第三医院伦理委员会批准,患者均知情同意。
1.2 血清miRNA-200c表达检测 HCC组于确诊日,对照组于体检日,采集空腹肘静脉血3~5 mL,常温静置30 min,3 000 r/min离心20 mim,取上层血清,置于无RNA酶的EP管中,-80 ℃超低温冰箱保存。②mRNA提取及逆转录:将血清标本于37 ℃水浴中解冻,采用血清mRNA快速提取试剂盒提取总RNA,利用分光光度计检测总RNA的纯度,当OD260/OD280为1.8~2.0时,可用于后续试验。采用mRNA逆转录试剂盒将总RNA逆转录为cDNA,反应体系20 μL:六碱基随机引物1 μL(0.2 μg),总RNA 2 μg,RNA酶抑制剂(2 U/μL) 1 μL,10 mmol/L dNTP 2 μL,5×buffer 4 μL,反转录酶(200 U/μL) 1 μL,余用DEPC水补足至20 μL。反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。采用实时荧光定量PCR技术检测miRNA-200c:以cDNA为模板,按照实时荧光定量PCR试剂盒要求,在Rotor-GeneTM6000 PCR仪中进行实时荧光定量PCR反应。miRNA-200c上游引物:5′-GCCGATTTAATACTGCCGGGT-3′,下游引物:5′-CAGTGCAGGGTCCGAGGT-3′,以miRNA-16为内参。反应体系:2×buffer 10 μL,上下游引物各1 μL,模板cDNA 2 μL,余用DEPC水补足至20 μL。反应条件:95 ℃ 10 min,94 ℃ 30 s,56 ℃ 20 s,70 ℃ 15 s,共40个循环。每个样本重复3次,取平均值为Ct值,计算ΔCt值,ΔCt=CtmiRNA-200c-CtmiRNA-16,采用相对定量的2-ΔCt法计算miRNA-200c的相对表达量。以HCC组血清miRNA-200c相对表达量的均数为界值,将患者分为miRNA-200c高表达者、miRNA-200c低表达者。
1.3 随访 采用门诊和电话随访相结合,随访截至2016年6月30日,统计每例患者的生存时间。

2 结果
2.1 两组血清miRNA-200c表达比较 HCC组血清miRNA-200c相对表达量为0.51±0.11,对照组为0.78±0.13,两组比较差异有统计学意义(t=8.684,P<0.01)。
2.2 血清miRNA-200c表达与HCC患者临床病理参数的关系 以HCC患者血清miRNA-200c相对表达量的均数为界值,将患者分为miRNA-200c高表达者30例、miRNA-200c低表达者30例。血清miRNA-200c表达与HCC患者临床病理参数的关系见表1。
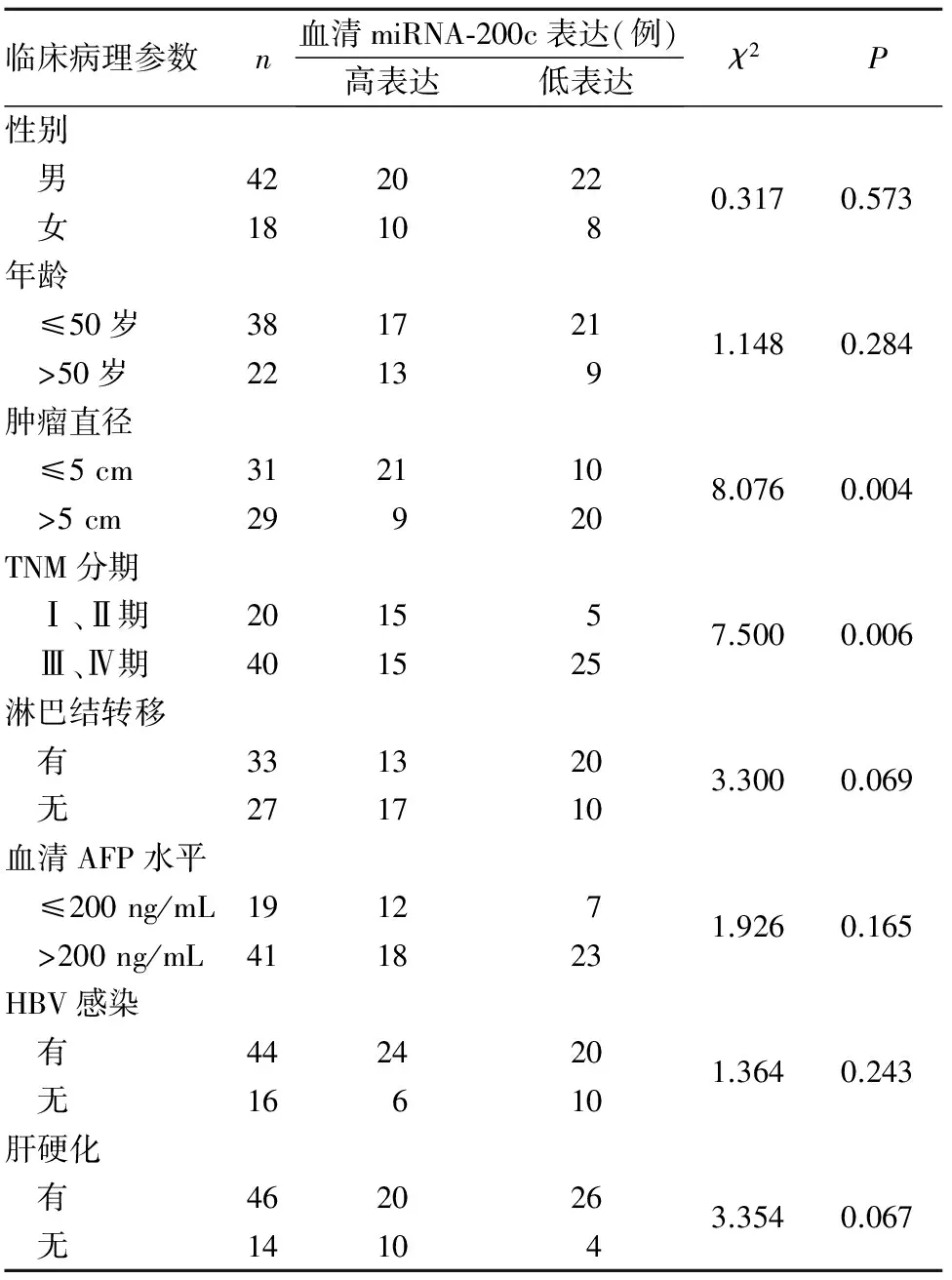
表1 血清miRNA-200c表达与HCC患者临床病理参数的关系
2.3 HCC组不同miRNA-200c表达者生存情况 随访截至2016年6月30日,20例miRNA-200c高表达者生存15例,平均生存时间29.7个月;22例低表达者生存9例,平均生存时间21.1个月。miRNA-200c高表达者生存时间长于低表达者(χ2=8.551,P=0.003)。见图1。
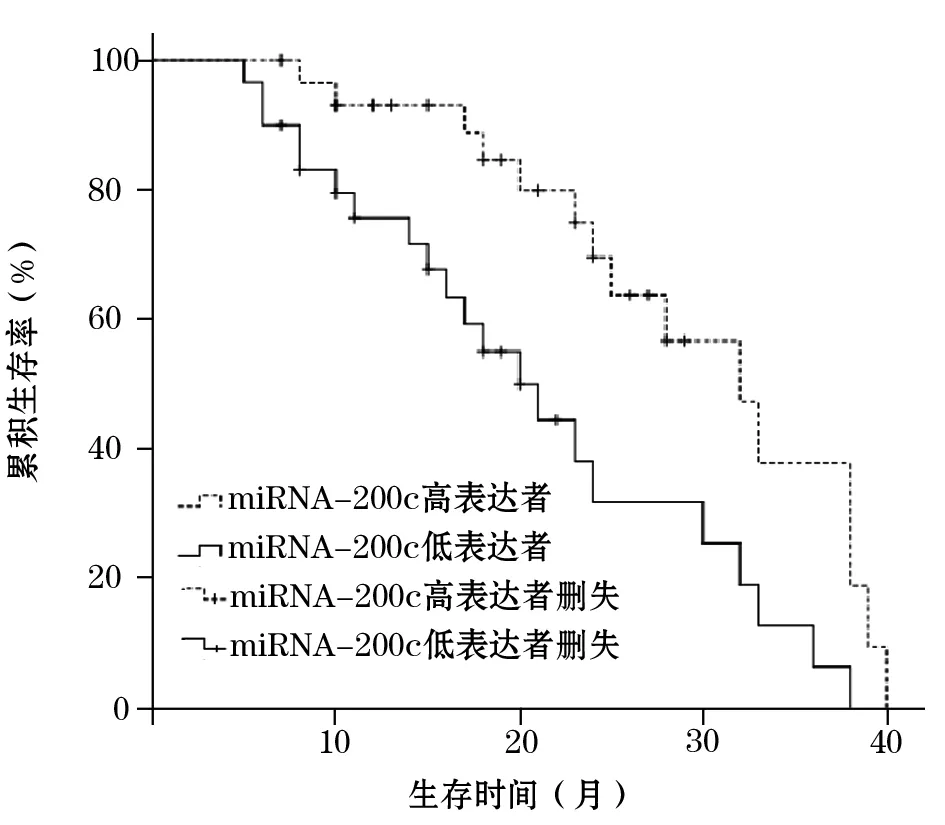
图1 HCC组不同miRNA-200c表达者的生存曲线
3 讨论
据统计, HCC的病死率居所有恶性肿瘤的第三位[4]。我国是HCC高发国,全球每年约50.5%的新发HCC患者出现在我国[5]。HCC起病隐匿,早期症状不明显,但恶性程度高,病情发展迅速,大多数患者确诊时已属中晚期,治疗效果较差,5年生存率仅7%左右[6,7]。因此,寻找早期诊断HCC的分子标志物对其防治具有重要意义。
miRNAs分子是一类由19~23个核苷酸组成的内源性非编码RNA,可通过特异性的靶基因沉默调控基因表达,在肿瘤的早期诊断、治疗监测以及预后评估中具有重要价值,且与肿瘤的发生、发展关系密切[8,9]。miRNA-200家族包括miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429和miRNA-141五个成员[10]。miRNA-200a、miRNA-200b和miRNA-429均定位于人1号染色体1p36.33区,miRNA-200c和miRNA-141定位于人12号染色体12p13.31区,这两个区域的染色体经常出现突变、缺失或易位,继而导致肿瘤的发生[11]。miRNA-200c在肿瘤发生、发展中的作用机制可能与上皮间质转化(EMT)有关。EMT是在特定的生理和病理情况下上皮细胞转化为间质细胞的过程,通过EMT可改变细胞骨架、减弱基底膜与细胞间的连接、E-钙黏着蛋白(E-cadherin)等细胞黏附分子表达减少、细胞极性丧失[12]。EMT是肿瘤细胞获得迁移和侵袭能力的一个重要步骤。其中,E-cadherin表达减少被认为是EMT的重要特征之一[13]。已有研究表明,miRNA-200c可通过上调E-cadherin抑制EMT过程,从而抑制肿瘤细胞侵袭和转移,E-cadherin是参与调控肿瘤EMT的重要调节因子[14,15]。在不同肿瘤中miRNA-200c表达情况并不一致。Zhao等[16]研究发现,非小细胞肺癌患者血清miRNA-200c低表达,且其表达与肿瘤TNM分期相关。常靓等[17]研究发现,胃癌患者血清miRNA-200c低表达,且与肿瘤组织分化程度有关。而Yu等[18]研究发现,食管癌患者血清miRNA-200c高表达。李林霞等[19]研究发现,卵巢癌患者血清miRNA-200c表达呈现先高后低的动态变化。但目前鲜见HCC患者血清miRNA-200c表达变化的报道。
研究证实,与肿瘤有关的miRNA来源于肿瘤组织,并非来源于血细胞,但可在血液中稳定存在。故血清miRNA水平可反映其在肿瘤组织中的表达情况[20]。相对于检测肿瘤组织,特别是晚期无法获得肿瘤组织者检测血清标本更方便[21]。本研究HCC组血清miRNA-200c相对表达量明显低于对照组,miRNA-200c低表达与肿瘤直径、TNM分期有关,提示其表达下调可能参与了HCC的发生、发展以及侵袭、转移过程。miRNA-200c高表达者平均生存时间长于miRNA-200c低表达者,提示miRNA-200c表达水平可反映病情的严重程度并预测生存期。
综上所述,HCC患者血清miRNA-200c表达下调,其表达变化与肿瘤直径、TNM分期及患者预后有关,有望成为诊断HCC的分子生物标志物和特异性治疗靶点。
[1] 张金梁,翟博,方泰石,等.晚期肝癌和复发性肝癌治疗的研究进展[J].现代生物医学进展,2016,16(2):358-361.
[2] 崔静,于泳,刘超,等.肝癌组织中miRNA-200b表达及其与患者生存时间的关系[J].山东医药,2016,56(8):47-49.
[3] Gu YM, Lei DQ, Qin X, et al. Integrated analysis reveals together miR-182, miR-200c and miR-221 can help in the diagnosis of prostate cancer[J]. PLoS One, 2015,10(10):e0140862.
[4] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[5] 赵荣荣,邓永东,袁宏.236例原发性肝癌患者流行病学及临床特点分析[J].临床肝胆病杂志,2016,32(8):1538-1542.
[6] Shi J, Keller JM, Zhang J, et al. A review on the diagnosis and treatment of hepatocellular carcinoma with a focus on the role of Wnts and the dickkopf family of Wnt inhibitors[J]. J Hepatocell Carcinoma, 2014(1):1-7.
[7] Soriano A, Varona A, Gianchandani R, et al. Selection of patients with hepatocellular carcinoma for liver transplantation: past and future[J]. World J Hepatol, 2016,8(1):58-68.
[8] Li T, Niu LJ, Wu LL, et al. A functional polymorphism in microRNA-196a2 is associated with increased susceptibility to non-Hodgkin lymphoma[J]. Tumor Biol, 2015,36(5):3279-3284.
[9] Tamori A, Murakami Y, Kubo S, et al. MicroRNA expression in hepatocellular carcinoma after the eradication of chronic hepatitis virus C infection using interferon therapy[J]. Hepatol Res, 2016,46(3):E26-E35.
[10] Kurashige J, Kamohara H, Watanabe M, et al. MicroRNA-200b regulates cell proliferation, invasion, and migration by directly targeting ZEB2 in gastric carcinoma[J]. Ann Surg Oncol, 2012,19 (Suppl 3):S656-S664.
[11] Elson-Schwab I, Lorentzen A, Marshall CJ. MicroRNA-200 family members differentially regulate morphological plasticity and mode of melanoma cell invasion[J]. PLoS One, 2010,5(10):e13176.
[12] Korpal M, Kang Y. The emerging role of miR-200 family of microRNAs in epithelial-mesenchymal transition and cancer metastasis[J]. RNA Biol, 2008,5(3):115-119.
[13] Nishijima N, Seike M, Soeno C, et al. miR-200/ZEB axis regulates sensitivity to nintedanib in non-small cell lung cancer cells[J]. Int J Oncol, 2016,48(3):937-944.
[14] Korpal M, Kang Y. The emerging role of miR-200 family of miRNAs in epithelial-to-mesen-chymal transition and cancer metastasis[J]. RNA Biol, 2008,5(3):115-119.
[15] Hurteau GJ, Carlson JA, Spivack SD, et al. Over expression of the miRNA has-miR-200c leads to reduced expression of transcription factor 8 and increased expression of E-cadherin[J]. Cancer Res, 2007,67(17):7972-7976.
[16] Zhao J, Zhao Y, Wang Z, et al. Loss expression of micro ribonucleic acid (miRNA)-200c induces adverse post-surgical prognosis of advanced stage non-small cell lung carcinoma and its potential relationship with ETAR messenger RNA[J]. Thorac Cancer, 2015,6(4):421-426.
[17] 常靓,王玉栋,吕稚蕾,等.miRNA-200c在胃癌中的表达及其靶基因RhoE的预测[J].肿瘤防治研究,2012,39(11):1341-1343.
[18] Yu H, Duan B, Jiang L, et al. Serum miR-200c and clinical outcome of patients with advanced esophageal squamous cancer receiving platinum-based chemotherapy[J]. Am J Transl Res, 2013,6(1):71-77.
[19] 李林霞,李双弟,杨郭霞,等.miRNA-200c在上皮性卵巢癌细胞株及肿瘤组织中的表达变化及意义[J].第二军医大学学报,2011,32(6):612-616.
[20] Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008,105(30):10513-10518.
[21] 刘华,娄杰,刘晓英,等.微RNA-21和微RNA-146α在结直肠肿瘤中的表达及临床意义[J].中华消化杂志,2015,35(7):470-475.
河北省医学科学研究重点课题计划项目(20150627)。
马丽霞(E-mail: malixia518@163.com)
10.3969/j.issn.1002-266X.2017.08.021
R735.7
B
1002-266X(2017)08-0067-03
2016-08-23)

