肝细胞癌患者外周血KIF1B、STAT4 mRNA水平变化及其临床意义
朴金梅,李成成,王建萍,刘梦,崔莲花
(1青岛大学医学部,山东青岛266021;2莒县人民医院;3青岛市标准化研究院;4青岛市中心医院)
肝细胞癌患者外周血KIF1B、STAT4 mRNA水平变化及其临床意义
朴金梅1,2,李成成1,2,王建萍3,刘梦1,4,崔莲花1
(1青岛大学医学部,山东青岛266021;2莒县人民医院;3青岛市标准化研究院;4青岛市中心医院)
目的 探讨肝细胞癌(以下称肝癌)患者外周血驱动蛋白家族成员1B(KIF1B)mRNA、信号转导与转录激活因子4(STAT4)mRNA水平变化及其临床意义。方法 采用RT-PCR法检测126例肝癌患者(肝癌组)、80例乙肝肝硬化患者(肝硬化组)、46例慢性乙肝患者(乙肝组)、100例体检健康者(对照组)外周血KIF1B mRNA和STAT4 mRNA水平,分析肝癌组KIF1B mRNA和STAT4 mRNA水平与患者临床病理参数的关系。结果 肝癌组外周血KIF1B mRNA水平明显低于肝硬化组、肝炎组和对照组(P均<0.05),而外周血STAT4 mRNA水平与肝硬化组、肝炎组和对照组比较差异均无统计学意义(P均>0.05)。肝癌患者外周血KIF1B mRNA水平与CA199水平有关(P<0.05),与其他临床病理参数,如性别、年龄、TNM分期等均无关(P均>0.05);而外周血STAT4 mRNA水平与患者年龄有关(P<0.05),与其他临床病理参数均无关(P均>0.05)。结论 肝癌患者外周血KIF1B mRNA水平降低,STAT4 mRNA水平无明显变化;外周血KIF1B mRNA水平对指导肝癌早期诊断和判断预后具有一定意义。
肝细胞癌;驱动蛋白家族成员1B;信号转导与转录激活因子4
肝细胞癌(以下称肝癌)发病较隐匿,多数患者就诊时已属晚期,预后极差[1]。甲胎蛋白(AFP)是目前最常用的肝癌标记物,但其敏感性、特异性并不理想,约1/3 肝癌患者血清AFP水平正常,而部分慢性肝病、肝硬化患者血清AFP水平亦可升高[2]。驱动蛋白家族成员1B(KIF1B)基因和信号转导与转录激活因子4(STAT4)基因是肝癌的易感基因。研究发现,肝癌组织和癌旁正常组织KIF1B mRNA和STAT4 mRNA表达差异明显[3,4]。推测肝癌患者和非肝癌患者外周血KIF1B mRNA、STAT4 mRNA水平亦存在差异,但目前相关研究较少。在我国约80%肝癌与HBV感染有关,故本研究观察了肝癌、乙肝肝硬化、慢性乙肝及体检健康者外周血KIF1B mRNA和STAT4 mRNA水平变化,旨在为肝癌的早期诊断提供依据。
1 资料与方法
1.1 临床资料 选择2013年9月~2014年7月青岛大学附属医院收治的肝癌患者126例(肝癌组),男109例,女17例,年龄(56.2±10.5)岁;乙肝肝硬化患者80例(肝硬化组),男69例、女11例,年龄(54.6±12.0)岁;慢性乙肝患者46例(乙肝组),男40例、女6例,年龄(56.7±12.1)岁。肝癌诊断符合2010年美国国立综合癌症网络肝胆肿瘤临床实践指南[5],经组织病理检查明确诊断,患者入院前未行任何抗肿瘤治疗;乙肝肝硬化、慢性乙肝诊断均符合《慢性乙型肝炎防治指南》,且未合并任何肿瘤。同期选择体检健康者100例(对照组),男86例、女14例,年龄(55.5±10.6)岁。各组性别、年龄具有可比性。本研究经青岛大学附属医院伦理委员会批准,患者均知情同意。
1.2 外周血KIF1B mRNA、STAT4 mRNA水平检测 采用RT-PCR法。所有研究对象清晨空腹采集肘静脉血5 mL,采用TRIzol法提取外周血总RNA,经紫外分光光度计检测总RNA浓度和纯度合格。取总RNA 1 μg,按第一链cDNA合成试剂盒说明逆转录合成cDNA模板,置于-20 ℃冰箱保存备用。根据GenBank中KIF1B、STAT4、GAPDH RNA序列设计引物,由南京金斯瑞生物技术有限公司合成。引物序列:KIF1B上游引物:5′-CAGTGAAAGCCATCTCGGAGGA-3′,下游引物:5′-TGTAGTCTCGCAGGATGTCAGC-3′;STAT4上游引物:5′-CAGTGAAAGCCATCTCGGAGGA-3′,下游引物:5′-TGTAGTCTCGCAGGATGTCAGC-3′;GAPDH上游引物:5′-GAAGGTGAAGGTCGCAGTC-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。PCR反应体系共15 μL:Ultra SYBR Mixture 7.5 μL,cDNA 1 μL,上下游引物各0.5 μL,无酶水5.5 μL;反应条件:95 ℃ 10 min,95 ℃ 15 s,61 ℃ 1 min,共40个循环。以2-ΔΔCt法计算目的mRNA的相对水平。
1.3 统计学方法 采用SPSS 17.0统计软件。计量资料不符合正态分布,以M(P25,P75)表示,结果比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组外周血KIF1B mRNA、STAT4 mRNA水平比较 见表1。

表1 各组外周血KIF1B mRNA和STAT4 mRNA相对水平比较[M(P25,P75)]
注:与肝硬化组、乙肝组、对照组比较,*P<0.05。
2.2 肝癌组外周血KIF1B mRNA、STAT4 mRNA水平与患者临床病理参数的关系 见表2。
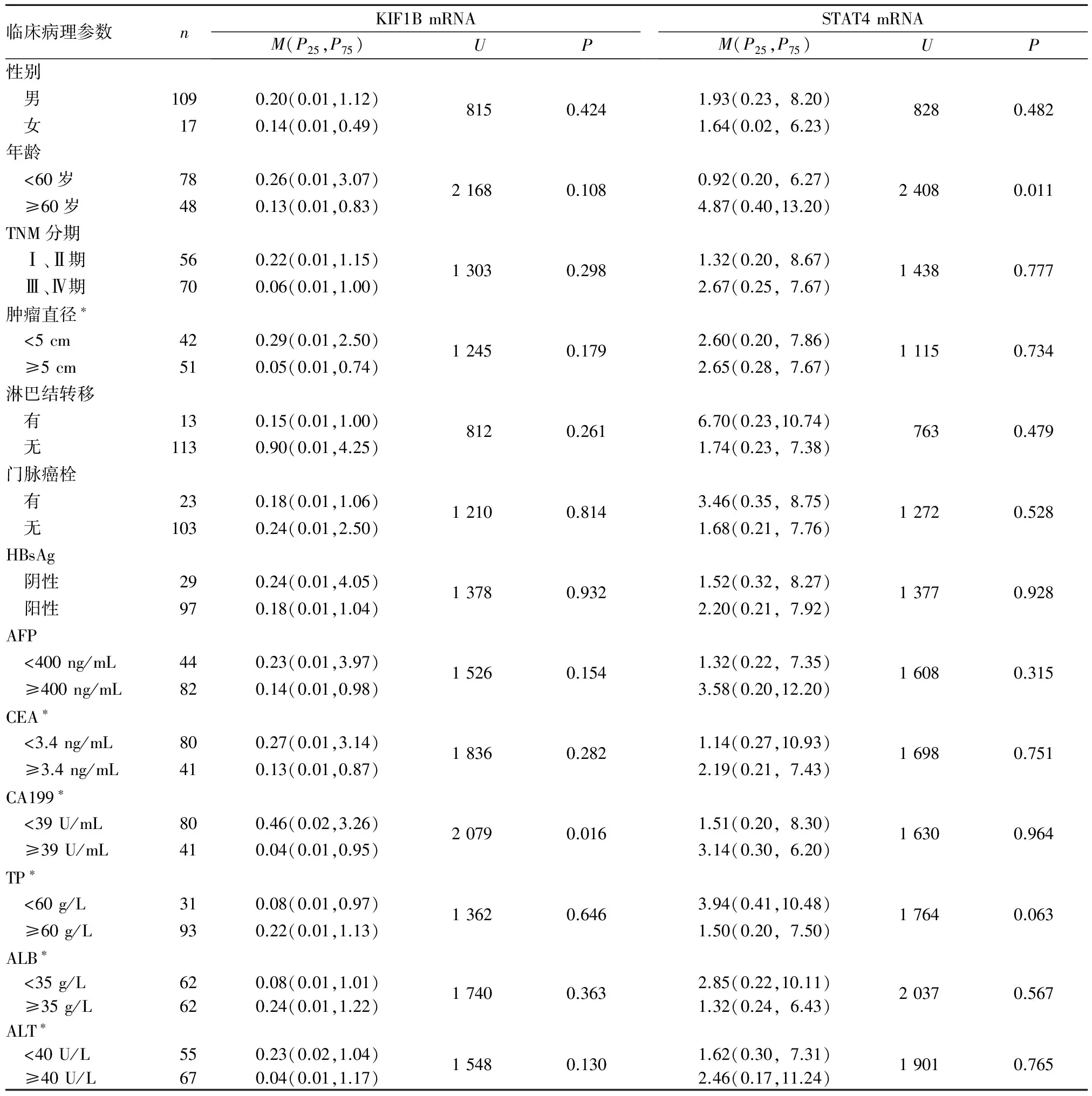
表2 肝癌组外周血KIF1B mRNA、STAT4 mRNA水平与患者临床参数的关系
注:*表示部分患者数据未能获得。
3 讨论
肝癌是世界上最常见的消化系统恶性肿瘤之一,每年新发病例一半以上在中国。HBV感染是我国肝癌高发的主要原因[6]。由于肝癌发病较隐匿,早期即可发生转移,患者预后极差,故早期发现并及时治疗至关重要。AFP是目前最常用的诊断肝癌的生物标记物,但其敏感性(36%~64%)、特异性(79%~91%)并不理想。目前循环肿瘤细胞检测在肺癌、乳腺癌、前列腺癌等多种肿瘤的诊断、预后判断中展现出较好价值[7]。但外周血肿瘤细胞数量极少,RT-PCR技术可在基因水平检测隐匿性肿瘤细胞,其敏感性较其他方法高10~100倍。因此,采用RT-PCR技术对外周血相应肿瘤标记物进行检测成为诊断肝癌早期转移的重要方法之一。
KIF1B基因是驱动蛋白家族成员之一,属于抑癌基因。KIFIB基因在正常成人和胎儿的心、脑、脾、肺、肝、肾和结肠等广泛表达,尤以脑和神经组织的表达最为丰富。近年研究发现,包括神经系统肿瘤在内的多种肿瘤都存在KIF1B表达缺失。Schlisio等[8]研究发现,KIFIB基因突变后,其mRNA表达下调,可导致神经母细胞瘤的发生。Shi等[9]研究亦发现,KIF1B mRNA表达下调能够增加卵巢癌的患病风险。Zhang等[3]研究发现,KIF1B基因rs17401966为HBV相关肝癌的易感基因。组织中KIF1B蛋白高表达与个体携带rs17401966的保护性等位型G显著相关[9,10],而携带rs17401966的危险性等位型A的个体组织中KIF1B蛋白相对低表达。周钢桥等[10]研究发现,KIF1B能显著影响肝癌细胞增殖、侵袭和转移能力;Yang等[11]研究发现,KIF1B mRNA低表达或表达缺失可促进肝癌的发生和转移,并影响患者预后。本研究发现,肝癌组外周血KIF1B mRNA水平低于肝硬化组、乙肝组及对照组,表明外周血KIF1B mRNA水平降低可能增加肝癌的患病风险。肿瘤标志物CA199与许多恶性肿瘤的侵袭和转移密切有关[12]。在Ⅱ~Ⅲ期结直肠癌患者中,术前CA199正常者较CA199升高者5年总生存率和5年无病生存率均明显降低[13]。本研究发现,肝癌患者外周血KIF1B mRNA水平与CA199水平有关,CA199高水平者外周血KIF1B mRNA低表达。因此认为,外周血KIF1B mRNA水平对评价肝癌患者预后具有一定价值。
STAT4是STATs家族成员之一,是JAK/STAT4信号通路重要的转录激活因子,在细胞免疫反应、生长分化、增殖凋亡及肿瘤发生过程中具有重要作用。在大多数癌组织及肿瘤细胞中STAT4表达异常,并与肿瘤的发生、发展密切相关。目前关于STAT4在肿瘤组织中的表达结论并不一致[4,14~16]。Wubetu等[14]研究发现,肝癌组织STAT4 mRNA表达下调者肿瘤侵袭性更强,患者预后更差;而辛彩霞等[15]研究显示,非小细胞肺癌组织STAT4表达明显高于正常肺组织。Kim等[17]经过重复全基因组关联分析验证,在肝癌组织中STAT4 mRNA表达下调。Jiang等[4]研究发现,肝癌患病风险与STAT4基因rs7574865位点突变有关,且癌组织STAT4 mRNA表达明显低于癌旁正常组织,表明STAT4基因在肝癌的发生、发展过程中具有重要作用。本研究肝癌组外周血STAT4 mRNA水平虽然高于肝硬化组、乙肝组及对照组,但结果比较无统计学差异,与Ni等[18]研究结果相似。其原因可能与影响外周血STAT4 mRNA水平的因素较多、样本量较少及研究对象不一致等有关。本研究还发现,肝癌患者外周血STAT4 mRNA水平仅与年龄有关,与其他临床病理参数无关。提示外周血STAT4 mRNA水平能否用于肝癌诊断及预后评价尚需进一步研究。
总之,外周血KIF1B mRNA检测对肝癌的早期诊断和预后评价具有一定指导意义。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] Bruix J, Sherman M, Llovet JM, et al. Clinical management of hepatocellular carcinoma. Conclusions of the barcelona-2000 EASL conference. European association for the study of the liver[J]. J Hepatol, 2001,35(3):421-430.
[3] Zhang H, Zhai Y, Hu Z, et al. Genome-wide association study identifies 1p36.22 as a new susceptibility locus for hepatocellular carcinoma in chronic hepatitis B virus carriers[J]. Nat Genet, 2010,42(9):755-758.
[4] Jiang DK, Sun J, Cao G, et al. Genetic variants in STAT4 and HLA-DQ genes confer risk of hepatitis B virus-related hepatocellular carcinoma[J]. Nat Genet, 2012,45(1):72-75.
[5] 徐贵升,王育盛,王沐廷.NCCN肝胆癌临床指引(2010.1版)[J].循证医学,2010,10(5):294-314.
[6] Tong HV, Bock CT, Velavan TP. Genetic insights on host and hepatitis B virus in liver diseases[J]. Mutat Res Rev Mutat Res, 2014(762):65-75.
[7] Chen Q, Ge F, Cui W, et al. Lung cancer circulating tumor cells isolated by the epcam-independent enrichment strategy correlate with cytokeratin 19-derived cyfra21-1 and pathological staging[J]. Clin Chim Acta, 2013(419):57-61.
[8] Schlisio S, Kenchappa R, Vredeveld LC, et al. The kinesin KIF1Bbeta acts downstream from EglN3 to induce apoptosis and is a potential 1p36 tumor suppressor[J]. Genes Dev, 2008,22(7):884-893.
[9] Shi T, Jiang Z, Jiang R, et al. Polymorphisms in the kinesin-like factor 1 B gene and risk of epithelial ovarian cancer in Eastern Chinese women[J]. Tumour Biol, 2015,36(9):6919-6927.
[10] 周钢桥,贺福初,张红星.中国人群肝癌的易感基因研究[J].中国科学:生命科学,2011,41(10):785-789.
[11] Yang SZ, Wang JT, Yu WW, et al. Downregulation of KIF1B mRNA in hepatocellular carcinoma tissues correlates with poor prognosis[J]. World J Gastroenterol, 2015,21(27):8418-8424.
[12] Zhou G, Niu L, Chiu D, et al. Changes in the expression of serum markers CA242, CA199, CA125, CEA, TNF-α and TSGF after cryosurgery in pancreatic cancer patients[J]. Biotechnol Lett, 2012,34(7):1235-1241.
[13] 陈蕾,姜北海,邸佳柏,等.术前检测癌胚抗原和糖链抗原199对结直肠癌Ⅱ~Ⅲ期患者预后的判断价值[J].中华胃肠外科杂志,2015,18(9):914-919.
[14] Wubetu GY, Utsunomiya T, Ishikawa D, et al. High STAT4 expression is a better prognostic indicator in patients with hepatocellular carcinoma after hepatectomy[J]. Ann Surg Oncol, 2014,21(Suppl 4):S721-S728.
[15] 辛彩霞,左自立,王鸿程,等.STAT4、STAT6与c-myc在非小细胞肺癌组织中的表达及相关性[J].肿瘤基础与临床,2011,24(4):280-283.
[16] 闻淑娟,杨顺娥,古力克孜,等.ICAM-1、STAT4在胃腺癌中的表达及意义[J].河北职工医学院学报,2008,25(2):15-18.
[17] Kim LH, Cheong HS, Namgoong S, et al. Replication of genome wide association studies on hepatocellular carcinoma susceptibility loci of STAT4 and HLA-DQ in a Korean population[J]. Infect Genet Evol, 2015(33):72-76.
[18] Ni Z, Lou W, Lee S, et al. Selective activation of members of the signal transducers and activators of transcription family in prostate carcinoma[J]. J Urol, 2002,167(4):1859-1862.
山东省自然科学基金资助项目(ZR2014JL053);山东省医药卫生科技发展计划项目(2013WS0264);青岛市科技计划基础研究项目(13-1-4-192-jch)。
10.3969/j.issn.1002-266X.2017.08.025
R735.7
B
1002-266X(2017)08-0077-04
2016-09-22)

