舌癌组织肿瘤坏死因子受体相关因子6表达变化及临床意义
邓卓峰,周峥,齐娟
(1武汉市妇女儿童医疗保健中心,武汉 430015;2江汉大学;3武汉大学口腔医院)
舌癌组织肿瘤坏死因子受体相关因子6表达变化及临床意义
邓卓峰1,周峥2,齐娟3
(1武汉市妇女儿童医疗保健中心,武汉 430015;2江汉大学;3武汉大学口腔医院)
目的 探讨肿瘤坏死因子受体相关因子6(TRAF6)在舌癌发生、发展中的作用。方法 选择65例舌癌患者的癌组织及癌旁正常组织,采用免疫组化法检测其TRAF6表达,分析舌癌组织TRAF6表达与患者临床病理参数及预后的关系。结果 舌癌组织TRAF6阳性表达47例(72.3%),癌旁正常组织为13例(20.0%),二者比较P<0.01。舌癌组织TRAF6阳性表达与患者性别、年龄及肿瘤组织分化程度、直径均无关(P均>0.05),与淋巴结转移及临床分期相关(P均<0.01)。舌癌组织TRAF6阳性者5年中位生存时间为27.00个月、5年生存率为6.38%,阴性者分别为49.50个月、27.78%,两者比较P均<0.05。结论 舌癌患者癌组织TRAF6高表达,其表达变化参与舌癌的进展;舌癌组织TRAF6表达对判断患者预后可能具有重要意义。
舌癌;肿瘤坏死因子受体相关因子6;临床病理特征;预后
舌癌的发病率及病死率高居口腔癌症的第一位,其发生、发展的分子学机制尚未完全阐明[1]。手术是治疗舌癌的主要方法,但由于肿瘤细胞常侵袭颌面部器官,患者术后多存在明显的容貌和功能破坏,严重影响其生存质量[2,3];放化疗由于毒副作用较大且特异性较低,难以特异性地杀伤肿瘤细胞[4]。研究发现,肿瘤坏死因子受体相关因子6(TRAF6)在多种肿瘤组织中高表达[5,6]。但其在舌癌组织中的表达变化鲜见报道。为此,我们进行了如下研究。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2000年9月~2010年1月武汉大学口腔医院收治的舌癌患者65例,男39例、女26例,年龄32~64(47.22±4.62)岁。所有患者首次发病,术前未接受过放疗、化疗及生物免疫性治疗,术后经组织病理检查明确诊断。肿瘤组织分化程度:低分化12例、中分化24例、高分化29例,临床分期:Ⅰ期12例、Ⅱ期30例、Ⅲ期16例、Ⅳ期7例,淋巴结转移25例,肿瘤直径<3 cm 46例、≥3 cm 19例。所有患者临床资料完整,术后随访均>5年。
1.2 舌癌组织及癌旁正常组织TRAF6表达检测 采用免疫组化法。分别取舌癌组织及癌旁正常组织(距离肿瘤边缘>5 cm),10%甲醛固定,常规石蜡包埋,4 μm厚切片;将石蜡切片脱蜡、水化,PBS冲洗后用蒸馏水浸泡,然后行抗原修复;滴加过氧化酶阻断溶液,室温孵育15 min以阻断内源性过氧化物酶活性;滴加动物非免疫血清,室温孵育10 min;滴加1∶100的TRAF6一抗稀释液(美国Santa Cruz公司),室温孵育1 h;PBS冲洗后滴加羊抗兔IgG二抗(美国Santa Cruz公司),室温孵育10 min;PBS冲洗后滴加链霉菌抗生物素—过氧化物酶溶液,室温孵育10 min;DAB显色后自来水冲洗,苏木素复染后再次自来水冲洗,乙醇脱水干燥,二甲苯透明,中性树胶封片。随机选择20个高倍镜(×400)视野。采用双盲法由两位经验丰富的病理科医师计数TRAF6阳性表达。TRAF6阳性表达定位于细胞质中,呈棕黄色沉淀。以阳性细胞百分比评分与阳性细胞染色强度综合判断结果[7]:①阳性细胞百分比<1%为0分,≥1%~<10%为1分,≥10%~<30%为2分,≥30%~<60%为3分,≥60%为4分;②无阳性染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。两者之和0~2分为阴性,3~7分为阳性。分析舌癌组织TRAF6阳性表达与患者临床病理参数及5年生存率的关系。
1.3 统计学方法 采用SPSS18.0统计软件。计数资料比较采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 舌癌组织及癌旁正常组织TRAF6阳性表达比较 舌癌组织TRAF6阳性表达47例(72.3%),癌旁正常组织为13例(20.0%),二者比较P<0.01。 见插页Ⅱ图5。
2.2 舌癌组织TRAF6阳性表达与患者临床病理参数的关系 舌癌组织TRAF6阳性表达与患者性别、年龄及肿瘤组织分化程度、直径均无关(P均>0.05),与淋巴结转移及临床分期相关(P均<0.01),即临床分期高、有淋巴结转移患者TRAF6阳性表达率高于临床分期低、无淋巴结转移患者。见表1。
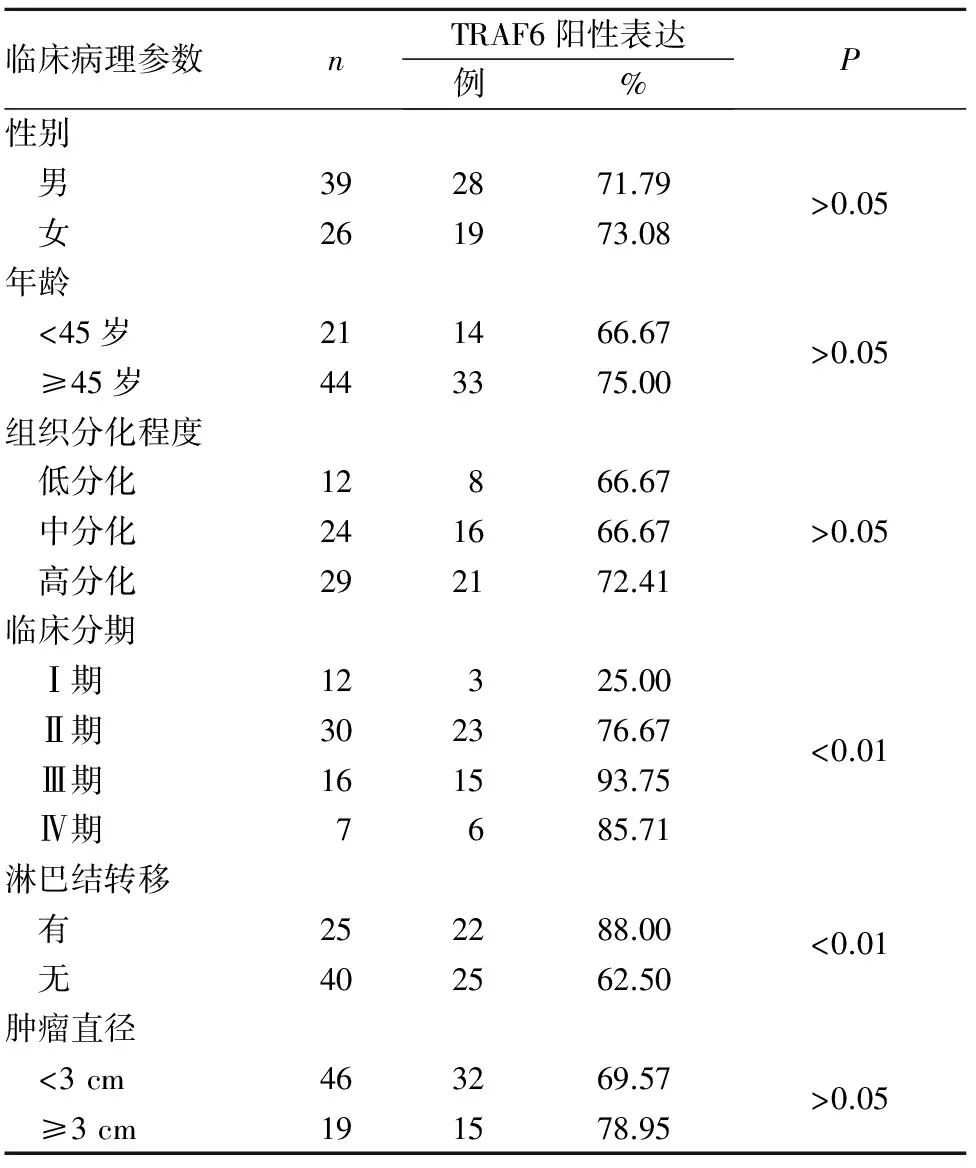
表1 舌癌组织TRAF6阳性表达与患者临床病理参数的关系
2.3 舌癌组织TRAF6表达与患者5年生存率的关系 舌癌组织TRAF6阳性表达者与阴性表达者5年中位生存时间分别为27.00、49.50个月,5年生存率分别为6.38%,27.78%,两者5年生存率比较P<0.05。见图1。
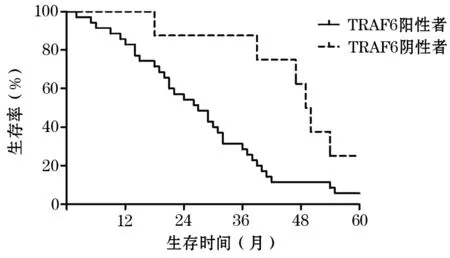
图1 舌癌组织TRAF6表达与患者5年生存率的关系
3 讨论
TRAF6是肿瘤坏死因子超家族和Toll样/IL-1受体超家族的重要接头分子,由530个氨基酸组成,主要包括两个结构域,即TRAF6结构域(C端)和螺旋卷曲激活结构域(N端)[8],介导TRAF分子之间形成同源/异源二(多)聚体。研究表明,TRAF6处于多条信号通路向下游传导的关键节点,TRAF6激活后可同时激活NF-κB和MAPK信号通路[9]。NF-κB信号通路在舌癌组织中异常激活,靶向下调NF-κB活性可抑制舌癌细胞增殖、侵袭,加速舌癌细胞凋亡[10]。MAPK信号通路在舌癌组织中亦存在异常激活,MAPK活性下调可抑制舌癌细胞增殖,促进舌癌细胞凋亡[11~13]。尽管如此,目前尚无NF-κB或MAPK特异性抑制剂用于舌癌治疗的报道,其主要原因可能为单纯阻断一条信号通路难以达到对舌癌的有效治疗,必须同时阻断NF-κB和MAPK信号通路才有可能对舌癌发挥治疗作用。
以往研究发现,TRAF6在多种肿瘤组织中存在异常高表达,特异性抑制TRAF6可显著抑制肿瘤细胞增殖并促进其凋亡[14~16]。本研究结果表明,舌癌组织TRAF6存在异常高表达;舌癌组织TRAF6阳性表达与患者性别、年龄及肿瘤组织分化程度、直径均无关,与临床分期及淋巴结转移有关,即临床分期高、有淋巴结转移者TRAF6阳性表达率高于临床分期低、无淋巴结转移者;进一步研究发现,舌癌组织TRAF6阳性表达与患者预后有关,TRAF6阳性表达者5年生存率明显低于TRAF6阴性表达者。上述结果提示,TRAF6高表达可能促进舌癌的发生、发展和侵袭,早期检测TRAF6表达有助于判断患者预后。同时阻断NF-κB、MAPK等信号通路有可能是TRAF6的作用机制。
综上所述,舌癌组织中TRAF6异常高表达,其表达增加可促进舌癌的发生、发展,早期检测TRAF6表达对判断舌癌患者预后可能具有重要意义。
[1] 任振虎,吴汉江.舌癌手术治疗的进展[J].实用口腔医学杂志,2014,30(1):110-114.
[2] Watanabe K, Okumura Y, Hashimoto K, et al. Clear cell carcinoma of the base of the tongue: case report and literature review[J]. Ann Otol Rhinol Laryngol, 2015,124(1):55-61.
[3] Lam L, Samman N. Speech and swallowing following tongue cancer surgery and free flap reconstruction--a systematic review[J]. Oral Oncol, 2013,49(6):507-524.
[4] Omura K. Current status of oral cancer treatment strategies:surgical treatments for oral squamous cell carcinoma[J]. Int J Clin Oncol, 2014,19(3):423-430.
[5] Nordfors C, Vlastos A, Du J, et al. Human papillomavirus prevalence is high in oral samples of patients with tonsillar and base of tongue cancer[J]. Oral Oncol, 2014,50(5):491-497.
[6] Landstrom M. The TAK1-TRAF6 signalling pathway[J]. Int J Biochem Cell Biol, 2010,42(5):585-589.
[7] Yang L, Yang S, Liu J, et al. Expression of GRP78 predicts taxane-based therapeutic resistance and recurrence of human gastric cancer[J]. Exp Mol Pathol, 2014,96(2):235-241.
[8] Liu H, Tamashiro S, Baritaki S, et al. TRAF6 activation in multiple myeloma: a potential therapeutic target[J]. Clin Lymphoma Myeloma Leuk, 2012,12(3):155-163.
[9] Landstrom M. The TAK1-TRAF6 signalling pathway[J]. Int J Biochem Cell Biol, 2010,42(5):585-589.
[10] Wang Y, Lin Z, Sun L, et al. Akt/Ezrin Tyr353/NF-kappaB pathway regulates EGF-induced EMT and metastasis in tongue squamous cell carcinoma[J]. Br J Cancer, 2014,110(3):695-705.
[11] Liang D, Xiao-Feng H, Guan-Jun D, et al. Activated STING enhances Tregs infiltration in the HPV-related carcinogenesis of tongue squamous cells via the c-jun/CCL22 signal[J]. Biochim Biophys Acta, 2015,1852(11):2494-2503.
[12] Pan ST, Qin Y, Zhou ZW, et al. Plumbagin induces G2/M arrest, apoptosis, and autophagy via p38 MAPK- and PI3K/Akt/mTOR-mediated pathways in human tongue squamous cell carcinoma cells[J]. Drug Des Devel Ther, 2015(9):1601-1626.
[13] Choi BB, Choi JH, Park SR, et al. Scutellariae radix induces apoptosis in chemoresistant SCC-25 human tongue squamous carcinoma cells[J]. Am J Chin Med, 2015,43(1):167-181.
[14] Han F, Zhang L, Qiu W, et al. TRAF6 promotes the invasion and metastasis and predicts a poor prognosis in gastric cancer[J]. Pathol Res Pract, 2016,212(1):31-37.
[15] Chiu HW, Lin SW, Lin LC, et al. Synergistic antitumor effects of radiation and proteasome inhibitor treatment in pancreatic cancer through the induction of autophagy and the downregulation of TRAF6[J]. Cancer Lett, 2015,365(2):229-239.
[16] Zhang XL, Dang YW, Li P, et al. Expression of tumor necrosis factor receptor-associated factor 6 in lung cancer tissues[J]. Asian Pac J Cancer Prev, 2014,15(24):10591-10596.
10.3969/j.issn.1002-266X.2017.08.029
R739.86
B
1002-266X(2017)08-0089-03
2016-09-13)

