牡丹籽油纳米乳凝胶的制备及体外透皮特性研究*
王小宁,曹 斌,张存劳,白佳怡
(1.西安医学院 药学院,陕西 西安 710021;2.陕西医药控股集团山海丹药业有限责任公司,陕西 西安 710075)
牡丹(PaeoniasuffruticosaAndr.)为毛茛科芍药属木本植物,是我国特有的木本名贵花卉。牡丹籽油来源于牡丹的种籽,具有很丰富的药用及食用价值[1-2]。研究发现,牡丹籽油在200~420 nm有强吸收,恰好能够有效吸收紫外线中波长为320~420 nm的UVA,因此具有显著的防晒美白功效[3-4]。据研究,牡丹籽油中发挥防晒功效的成分为不饱和脂肪酸亚油酸,其质量分数可达19.09%~34.9%[5]。然而,牡丹籽油水溶解度低,直接使用易引起皮肤干燥、刺激等问题,因此开发牡丹籽油的新型经皮给药制剂具有重要意义。纳米乳凝胶(nanoemulsion-based gels,NBGs) 是将药物与纳米乳液加入凝胶基质中形成的透明、稳定的网状结构胶体。纳米乳能够显著改善药物的刺激性,并具有良好的透皮性和稳定性[6-7],凝胶则能提高乳剂的黏度,增强其黏附性和涂布性,延长药物滞留时间[8-9]。因此,作者制备了牡丹籽油纳米乳凝胶,对其质量进行评价,并考察其体外透皮特性,为进一步研究与开发牡丹籽油新剂型并促进其在化妆品领域的应用提供依据。
1 实验部分
1.1 试剂与仪器
牡丹籽油:压榨提取,由陕西兴森源生物科技有限公司提供;卡波姆-980、聚氧乙烯氢化蓖麻油、PEG400:药用级,甲醇、乙腈:色谱纯,天津科密欧化学试剂有限公司;吐温-80、异丙醇、三乙醇胺:分析纯,国药集团化学试剂有限公司;亚油酸对照品:批号B21241,纯度≥98.0%,上海源叶生物科技有限公司。
万分之一电子分析天平:ALC-210.4,赛多利斯科学仪器(北京)有限公司;实验室高剪切均质乳化机:ESR-500,上海易勒机电设备有限公司;超声波清洗器:KQ5200E,昆山市超声仪器有限公司;低速大容量离心机:TD5M,上海卢湘仪离心机仪器有限公司;马尔文激光粒度仪:ZEN3600,英国马尔文仪器有限公司;药物透皮扩散试验仪:RYJ-6B,上海黄海药检仪器有限公司;高效液相色谱仪:Agilent Tech-1260,安捷伦科技有限公司;数显黏度计:SNB,上海方瑞仪器有限公司;差示扫描量热仪:DSC1,梅特勒-托利多国际贸易(上海)有限公司。
1.2 牡丹籽油纳米乳的处方筛选
以粒径及多分散系数(polydispersity index,PDI)为指标,按表1处方,取牡丹籽油、乳化剂、助乳化剂混匀,加入50 mL蒸馏水(纯化水),经高剪切均质乳化机乳化3 min,制得牡丹籽油纳米乳。
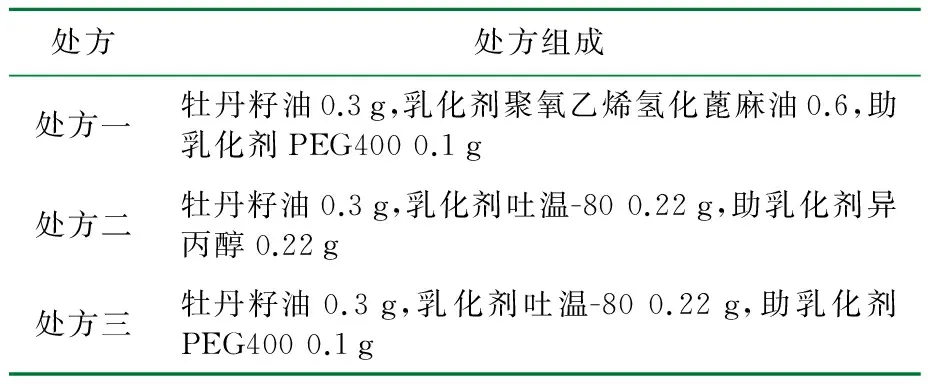
表1 牡丹籽油纳米乳处方
1.3 凝胶基质的处方筛选
称取卡波姆-980适量,加适量甘油润湿后,加蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀,用体积分数为20%三乙醇胺溶液调节pH至一定值,3 000 r/min离心10 min即得凝胶基质[10]。以凝胶基质的外观性状、成型性、黏稠度、涂布性为评价指标,考察卡波姆-980的用量(0.3、0.5、0.8、1.0、1.5 g)、甘油用量(5、8、10、12、15 g)、pH值(4.0、5.0、6.0、7.0、8.0)对凝胶基质的影响,筛选最优凝胶基质处方。其中,外观包括凝胶的澄清透明度、有无光泽、有无沉淀等,涂展性分为快速铺展、慢速铺展与难以铺展[11]。
1.4 牡丹籽油纳米乳凝胶的制备
按“1.2”方法制备牡丹油纳米乳,按“1.3”方法制备凝胶基质,将牡丹油纳米乳缓慢加入到已经溶胀好的卡波姆-980凝胶基质中,搅拌均匀,加蒸馏水至50 g,3 000 r/min离心10 min除气泡,得牡丹油纳米乳凝胶[12]。
1.5 牡丹籽油纳米乳凝胶的质量评价
观察纳米乳凝胶的外观形态,采用黏度计测定凝胶黏度,采用马尔文激光粒度仪测定粒径及Zeta电位,采用高速离心法考察其物理稳定性,通过涂布实验考察其皮肤涂布性。
1.6 牡丹籽油的含量测定方法学考察
色谱条件:Diamond C18柱(4.6 mm×250 mm,5 μm),流动相为乙腈-φ(磷酸)=0.1%溶液(体积比为90∶10),流速为1.0 mL/min,检测波长为203 nm,进样量为20 μL,柱温为30 ℃[13]。
方法学考察:精密称取亚油酸对照品7 mg,用甲醇定容至10 mL,配制成0.7 mg/mL的溶液,再量取1 mL至另一容量瓶中,用甲醇定容至10 mL,制得母液适量。分别量取母液0、2、4、6和8 mL,用甲醇定容至10 mL容量瓶,得质量浓度分别为0.014、0.028、0.042、0.056和0.070 mg/mL的对照品溶液。按色谱条件依次进样。以峰面积(A)为纵坐标,质量浓度(ρ)为横坐标,进行线性回归。同时,进行精密度、稳定性、重复性和加样回收率考察。
1.7 体外透皮特性研究
离体皮肤的制备:断颈法处死小白鼠,剥离小鼠皮肤后,取小鼠腹部皮肤,剪去多余皮毛,除去其皮下组织,仔细用棉签擦去皮下脂肪,直到皮肤白皙为止,以少量生理盐水湿润后,4 ℃冰箱保存,24 h内使用。
体外透皮实验:采用Franz扩散池进行体外透皮实验[14]。用手术剪将已处理好的小鼠皮剪成适量大小,固定于供给室和接受池之间(注意使皮肤表层面向供给室,皮肤内侧面向接受室),分别量取牡丹籽油、牡丹籽油纳米乳,牡丹籽油纳米乳凝胶适量作为待测样,保证其中含有的牡丹籽油质量均为0.06g,在37 ℃、600 r/min的条件下进行实验,分别在0.5、1、2、4、6、8、10、12 h取2 mL接收液(同时补充同温等量生理盐水),按照“1.6”的色谱条件测其药物浓度,并计算累积渗透量(Q,mg/cm2),计算公式见式(1)。
(1)
式中,ρn为不同时间点时接收液质量浓度,mg/mL;ρi为不同时间点时取样液质量浓度,mg/mL;V为接受池体积,mL;Vi为取样体积,mL;A为扩散面积,cm2。
差示扫描量热(DSC)扫描:12 h后,将空白及凝胶组实验后皮肤置于流水下冲洗 60 s,取样,用差示扫描量热仪进行差式扫描分析。DSC条件:40 μL 铝坩埚,温度在-20~200 ℃,升温速率为20 ℃/min。
2 结果与讨论
2.1 牡丹籽油纳米乳的处方筛选
按表1中三个处方所制得纳米乳的粒径分别为161.7、274.4、779.7nm,PDI分别为0.180、0.973、1.000。经比较,处方一所制得的纳米乳粒径较小且分布均匀,因此选定处方一作为纳米乳处方。
2.2 凝胶基质的处方筛选
卡波姆-980用量的筛选结果见表2。

表2 卡波姆-980 用量的筛选结果
由表2可见,当卡波姆-980用量为1.5 g时,涂布性较差,难以铺展,而在0.8 g时,形成的凝胶基质透明、均匀细腻、黏稠度适中、易涂布,且成型性较好,因此,选择卡波姆-980 用量为0.8 g。
甘油用量的筛选结果见表3。

表3 甘油用量的筛选结果
由表3可见,随着甘油用量的增大,凝胶黏度随之增大,黏稠度、油腻感也显著增强,外观结团现象明显,导致凝胶基质难以涂展,在甘油用量为15 g时,基质结团现象明显,黏度大,难以涂展,而在用量为10 g时,黏稠度适中,均匀细腻,易涂展,因此,选择甘油用量为10 g。
pH值的筛选结果见表4。

表4 pH值的筛选结果
由表4可见,当pH=4.0~5.0时,黏度低、流动性强,皮肤黏附性差;当pH=6.0时,黏稠度适中,皮肤黏附性好;当pH=7.0~8.0时,有明显的结团现象,较为黏稠,影响皮肤涂展性。因此,选择调节 pH=6.0。
综上,确定牡丹籽油纳米乳凝胶的处方为牡丹籽油0.3 g、聚氧乙烯氢化蓖麻油0.6 g、PEG400 0.1 g,卡波姆-980 0.8 g,甘油10 g,最终调节pH值至6.0。
2.3 牡丹籽油纳米乳凝胶的质量评价
2.3.1 制剂的外观、黏度
本实验所得样品外观为无沉淀、具有一定黏稠度的乳白色凝胶,膏体细腻均匀,黏稠度适中,经测定,黏度为37 010 Pa·s。
2.3.2 粒径及电位
粒径与Zeta电位结果分别见图1、图2。
粒径/nm图1 牡丹籽油纳米乳凝胶的粒径分布图
由图1、图2可知,牡丹籽油纳米乳的平均粒径约为160.0 nm,PDI为0.173,Zeta电位为-20.1 mV,说明纳米乳粒径分布均匀,物理稳定性强。
2.3.3 物理稳定性实验
分别取牡丹油纳米乳、纳米乳凝胶各三份,分别放置24 h、48 h、72 h后,3 000 r/min离心10 min,观察纳米乳及纳米乳凝胶是否出现分层、沉淀或浑浊。结果表明,纳米乳及纳米乳凝胶在离心期间未发生分层和沉淀现象,具有良好的稳定性。
2.3.4 涂布性实验
取所制得牡丹籽油及牡丹籽油纳米乳凝胶适量,分别涂布于双硅纸(具有类似于皮肤的疏水性)上进行观察[15]。结果表明,涂布牡丹籽油之后,油滴很快出现聚集,不易涂布均匀,而牡丹籽油纳米乳凝胶涂布后,无油滴聚集现象,说明将牡丹籽油纳米乳凝胶剂涂布性好,减少了刺激性和油腻感。
2.4 含量测定方法学考察
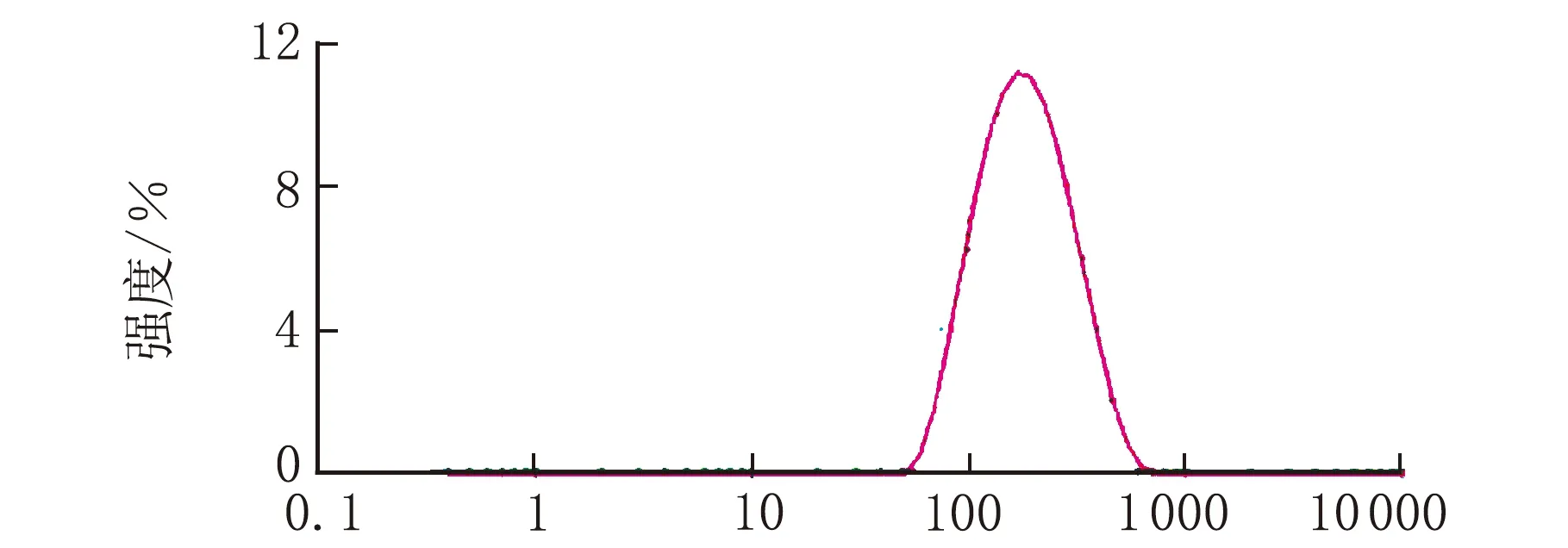
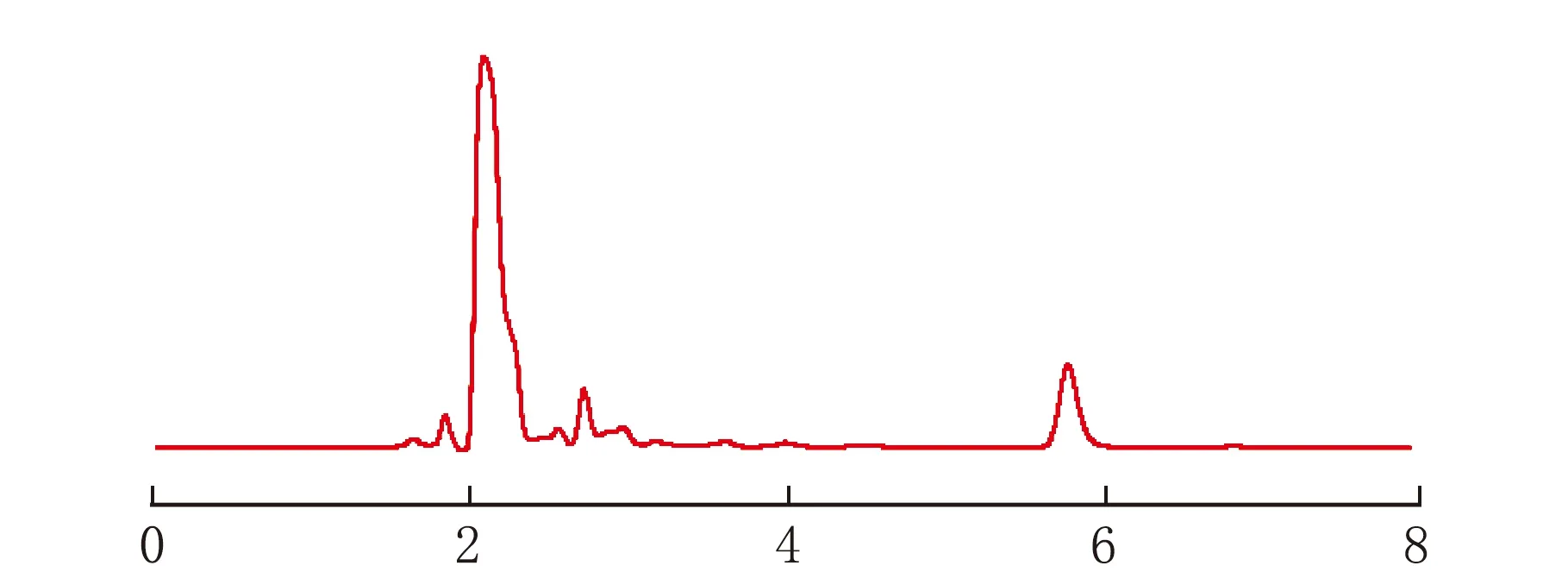
按1.6的色谱条件进样,得到对照品溶液、样品溶液、不含亚油酸的阴性溶液的色谱图见图3。
t/mina 亚油酸标准品
t/minb 样品溶液
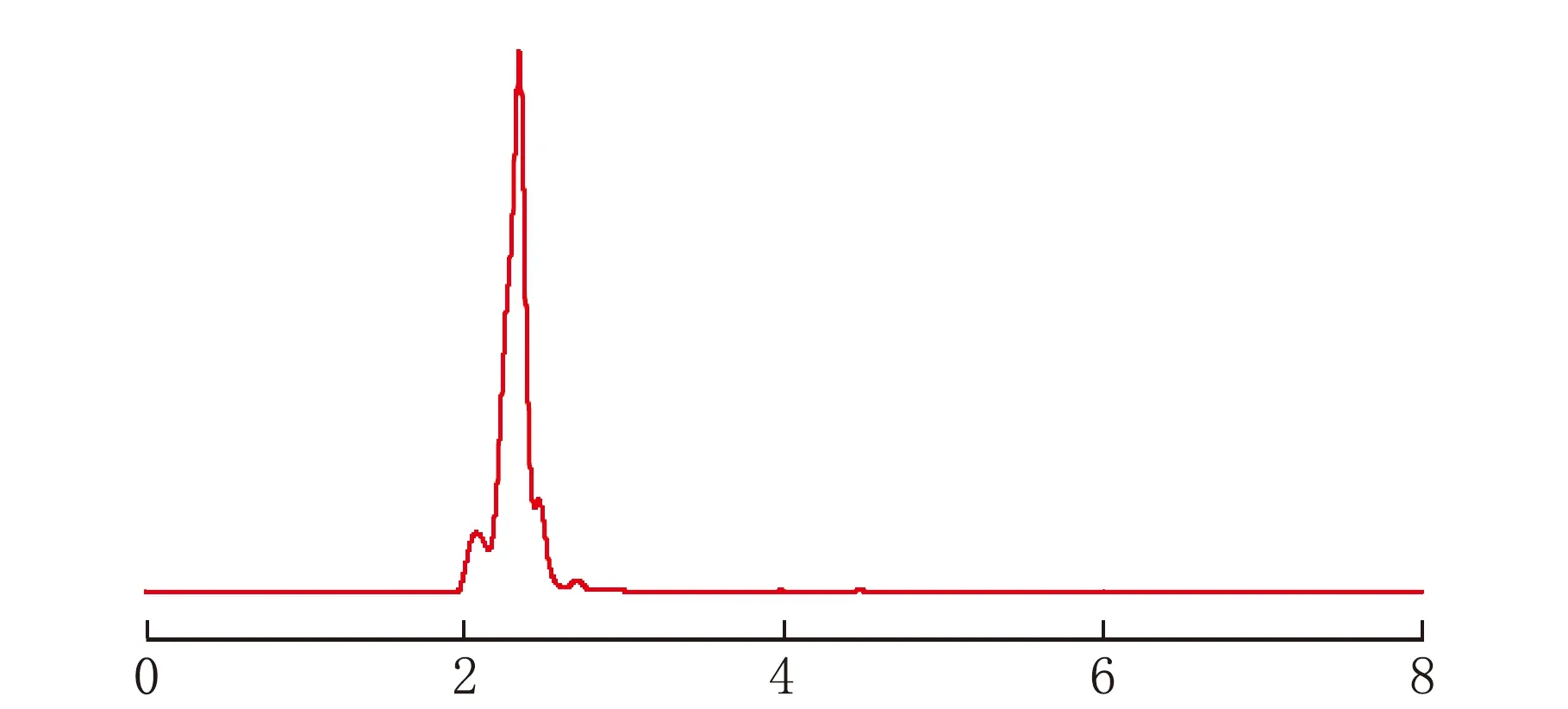
t/minc 阴性溶液图3 各溶液色谱图
由图3可知,指标成分亚油酸的亚油酸标准品的保留时间为5.79 min(图3a),样品溶液在5.65 min处出现了亚油酸的色谱峰(图3b),不含亚油酸的阴性溶液在相应位置无色谱峰的出现(图3c),表明辅料对亚油酸的测定无干扰,本方法专属性好。
按标准曲线绘制方法,得标准曲线方程为A=4 439.3ρ+5.25,R=0.999 7,表明在质量浓度为0.01~0.07 mg/mL线性关系良好。经精密度、稳定性、重复性考察,计算得RSD值分别为0.53%、0.49%、1.22%,加样回收率在90%~110%,表明精密度、稳定性、重复性、加样回收率均良好。
2.5 体外透皮特性考察
按照1.7的实验方法进行体外透皮特性考察,计算各组的皮肤累积渗透量,结果见图4。
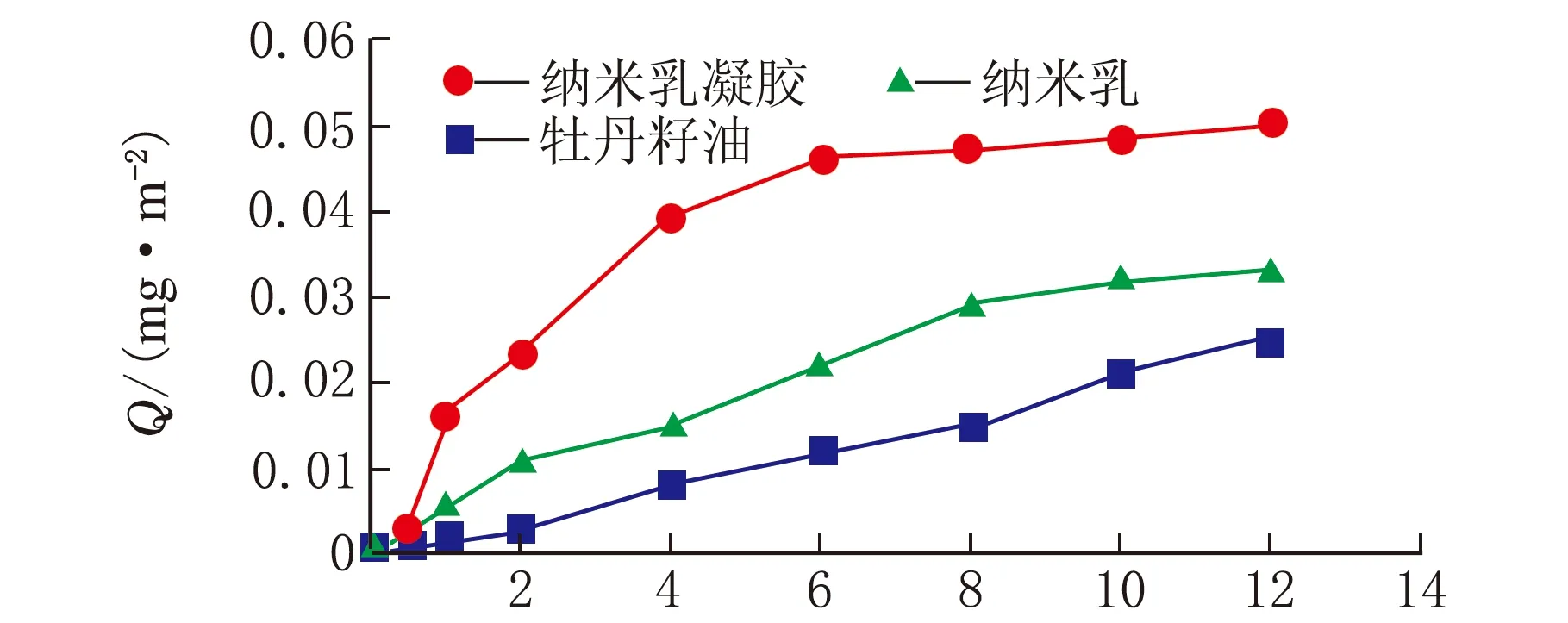
t/h图4 体外透皮实验结果
由图4可知,三个实验组中,亚油酸的累积渗透量均随着时间的增加而增加,12 h时累积渗透量由高到低依次为纳米乳凝胶>纳米乳>牡丹籽油,并且纳米乳凝胶与牡丹籽油相比,累积渗透量具有显著性差异(p<0.05),而纳米乳与牡丹籽油相比不具有显著性差异(p>0.05),说明纳米乳凝胶具有更好的透皮性能,12 h时亚油酸的累积渗透量为0.05 mg/cm2。
将空白及凝胶组实验后皮肤置于流水下冲洗 60 s,取样,用差示扫描量热仪进行差式扫描分析,结果见图5。
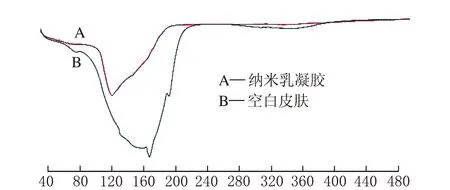
t/℃图5 DSC曲线
由图5可知,空白皮肤的熔融峰出现在约140 ℃,而涂抹有纳米乳凝胶的皮肤与空白皮肤相比,吸收热量速率更快,在126 ℃处出现熔融峰,说明凝胶乳对皮肤的结构有影响,这可能与皮肤角质层的致密结构被打开有关,证实了纳米乳凝胶增强牡丹籽油透皮吸收的性能。
3 结 论
(1) 用聚氧乙烯氢化蓖麻油作为乳化剂,经高速剪切乳匀法制备牡丹籽油纳米乳,制得的纳米乳细微、均匀,以卡波姆作凝胶基质,制得的凝胶细腻、均匀,稳定性好,质地清爽,易于涂抹;
(2) 用Franz扩散池进行透皮吸收实验,能够较好地模拟透皮制剂的药物释放过程。由透皮结果可以看出,牡丹籽油纳米乳凝胶透皮速率显著大于牡丹籽油及其纳米乳,说明凝胶基质的加入可能影响了皮肤的结构,使角质层细胞间隙增大,增强了牡丹籽油的透皮吸收。
[1] 李凯,周宁,李赫宇.牡丹花、牡丹籽成分与功能研究进展[J].食品研究与开发,2012,33(3):228-230.
[2] 朱献标,翟文婷,董秀勋,等.牡丹籽油化学成分及功能研究进展[J].中国油脂,2014,39(1):88-91.
[3] 高婷婷,王亚芸,任建武.GC-MS法分析牡丹籽油的成分及其防晒效果的评定[J].食品科技,2013,38(6):296-299.
[4] 程安玮,孙金月,王维婷,等.牡丹籽油的研究进展[J].食品科学技术学报,2016,34(3):79-84.
[5] 周畅.牡丹籽油作为化妆品基础油的开发研究[D].上海:上海交通大学,2015.
[6] 李艳萍,张志荣.纳米乳的研究进展及其应用[J].华西药学杂志,2010,25(4):485-488.
[7] 蔡霞,吕竹芬.纳米乳在透皮给药系统中的应用概况[J].广东药学院学报,2009,25(4):429-432.
[8] 谢明华,葛敏,高建青.微乳凝胶经皮给药制剂的研究与应用进展[J].中国现代应用药学,2015,32(6):764-768.
[9] 祝雨薇,蒋曙光,周建平.伊曲康唑温敏微乳凝胶的研制[J].中国新药杂志,2013,22(16):1942-1947.
[10] 卢秀霞,潘婷婷,洪于琦,等.茶树油微乳凝胶的制备及其质量评价[J].中草药,2015,46(13):1892-1900.
[11] 刘继勇,韩盈,杨明,等.丹皮酚微乳凝胶剂的制备及体外透皮特性研究[J].中国中药杂志,2009,34(21):2730-2733.
[12] 王利胜,张升,刘丽萍,等.青藤碱微乳凝胶的制备及体外透皮特性研究[J].中药新药与临床药理,2011,22(1):21-24.
[13] 杨会芳,李德坤,周大铮,等.HPLC法测定红参提取物中的α-亚麻酸、亚油酸[J].药物评价研究,2016,24(2):110-112.
[14] 白发丽,曹芬,蔡林.丹皮酚脂质体凝胶的制备及其透皮作用[J].华南国防医学杂志,2015,29(2):89-92.
[15] 赵宁,程玉钏,李伟泽,等.以白芨多糖为骨架材料的沙棘油凝胶乳的制备及性质研究[J].中国油脂,2016,41(6):79-82.

